Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Es La Fuerza Existente Dos o Más Átomos Que Los Mantienen Unidos en Las Moléculas
Caricato da
Uriel A DavalosCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Es La Fuerza Existente Dos o Más Átomos Que Los Mantienen Unidos en Las Moléculas
Caricato da
Uriel A DavalosCopyright:
Formati disponibili
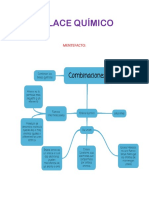
Es la fuerza existente dos o ms tomos que los mantienen unidos en
las molculas.
Covalente, moleculares, ionicos, metlicos
La regla del octeto funciona principalmente para los elementos del
segundo periodo de la tabla peridica., los cuales pueden contener un
total de ocho electrones. Cuando un tomo de uno de estos elementos
forman un compuesto covalente, pueden obtener la configuracin
electrnica de gas noble [Ne]
Los enlaces covalentes son las fuerzas que mantienen unidos entre s
los tomos no metlicos
"Es el fenmeno qumico mediante el cual dos tomos se unen
compartiendo una o varias parejas de electrones; por lo tanto, no
pierden ni ganan electrones, sino que los comparten".
En enlace covalente puede ser: sencillo, doble o triple, segn se
compartan uno, dos o tres pares de electrones.
Coordinado
Se define de la siguiente forma: "Es el enlace que se produce cuando
dos tomos comparten una pareja de electrones, pero dicha pareja
procede solamente de uno de los tomos combinados.
la teora del enlace de valencia explica la naturaleza de un enlace
qumico en una molcula, en trminos de las valencias atmicas.[1] La
teora del enlace de valencia resume la regla que el tomo central en
una molcula tiende a formar pares de electrones, en concordancia con
restricciones geomtricas, segn est definido por la regla del octeto.
La geometra tridimensional de las molculas est determinada por la
orientacin relativa de sus enlaces covalentes.
En qumica, se habla de hibridacin cuando en un tomo se mezclan
varios orbitales atmicos para formar nuevos orbitales hbridos. Los
orbitales hbridos explican la forma en que se disponen los electrones en
la formacin de los enlaces, dentro de la teora del enlace de valencia, y
justifican la geometra molecular.
La Teora de Orbitales Moleculares (T.O.M.) es la segunda aproximacin
al estudio del enlace covalente, y la ms ampliamente empleada para
explicar la estructura y la geometra de muchos slidos inorgnicos.
El enlace inico consiste en la atraccin electrosttica entre tomos con
cargas elctricas de signo contrario. Este tipo de enlace se establece
entre tomos de elementos poco electronegativos con los de elementos
muy electronegativos. Es necesario que uno de los elementos pueda
ganar electrones y el otro perderlo, y como se ha dicho anteriormente
este tipo de enlace se suele producir entre un no metal (electronegativo)
y un metal (electropositivo).
Los compuestos inicos forman redes cristalinas constituidas por iones
de carga opuesta, unidos por fuerzas electrostticas. Este tipo de
atraccin determina las propiedades observadas.
La red cristalina est formada por iones de signo opuesto, de manera
que cada uno crea a su alrededor un campo elctrico que posibilita que
estn rodeados de iones contrarios
La estructura cristalina es la forma slida de cmo se ordenan y
empaquetan los tomos, molculas, o iones. Estos son empaquetados
de manera ordenada y con patrones de repeticin que se extienden en
las tres dimensiones del espacio.
La energa reticular, tambin conocida como energa de red, es la
energa que se necesita para poder separar de manera completa un mol
de un compuesto de tipo inico en sus respectivos iones gaseosos.
Tambin se puede decir que la energa reticular es la energa que se
consigue a travs de la formacin de un compuesto de tipo inico
partiendo siempre de sus iones gaseosos.
Potrebbero piacerti anche
- Símbolo y Estructura de LewisDocumento11 pagineSímbolo y Estructura de LewisHuchin Amores Leticia100% (1)
- Enlaces iónico y covalenteDocumento13 pagineEnlaces iónico y covalenteDavid Conza TorresNessuna valutazione finora
- Enlaces químicos y fuerzas intermolecularesDocumento28 pagineEnlaces químicos y fuerzas intermolecularesEDUCAMOS BarillasNessuna valutazione finora
- enlacesquimicosDocumento4 pagineenlacesquimicosHolaNessuna valutazione finora
- Enlaces Quimicos - Guzman Morales Deysi EmelyDocumento4 pagineEnlaces Quimicos - Guzman Morales Deysi Emelyemely guzmanNessuna valutazione finora
- Unidad 2 Compuestos 2doDocumento9 pagineUnidad 2 Compuestos 2doJuan Carlos LucianoNessuna valutazione finora
- Trabajo Fisica y Quimica IntermolecularDocumento27 pagineTrabajo Fisica y Quimica IntermolecularFernando M. TorresNessuna valutazione finora
- EnlacesDocumento6 pagineEnlacesMichell SanchezNessuna valutazione finora
- Quimica ExpoDocumento18 pagineQuimica ExpoJorge Alexander Aguilar CastilloNessuna valutazione finora
- Taller QuimicaDocumento18 pagineTaller Quimicaisako hatakeNessuna valutazione finora
- Investigacion Previa.5Documento16 pagineInvestigacion Previa.5Gina Cabrera EspinosaNessuna valutazione finora
- 1b-Clases de Enlaces Quimicos - 1a - 3 - 2024Documento19 pagine1b-Clases de Enlaces Quimicos - 1a - 3 - 2024vilma tuctaguanoNessuna valutazione finora
- Distribucion ElecrtronicaDocumento12 pagineDistribucion ElecrtronicaJENNIFER DANIELA TOAPANTA CAMACHONessuna valutazione finora
- Como Se Forman Las MoleculasDocumento11 pagineComo Se Forman Las MoleculasChristian ColloguazoNessuna valutazione finora
- Tema Enlace QuimicoDocumento33 pagineTema Enlace QuimicoLaura Laiolo MorenoNessuna valutazione finora
- Temas Selectos de QuímicaDocumento2 pagineTemas Selectos de QuímicaTania Torres ANessuna valutazione finora
- U3 Eje 4.2 Act. 3Documento2 pagineU3 Eje 4.2 Act. 3Calderas Rivera Jenifer ZamaraNessuna valutazione finora
- Enlace Ionico y CovalenteDocumento5 pagineEnlace Ionico y CovalenteRoxi Cool Rmrz100% (1)
- Enlaces QuimicosDocumento17 pagineEnlaces QuimicosrosirisNessuna valutazione finora
- Enlaces Quimicos DE BIOQUIMICADocumento8 pagineEnlaces Quimicos DE BIOQUIMICADMCTNessuna valutazione finora
- Quimica D1Documento2 pagineQuimica D1Fabricio ValdezNessuna valutazione finora
- Cueva Perez Informe 3 Química GeneralDocumento17 pagineCueva Perez Informe 3 Química GeneralEduardo Cueva PérezNessuna valutazione finora
- Objetivo 3 EnlacesDocumento11 pagineObjetivo 3 EnlacesIbeth Henao de AponteNessuna valutazione finora
- Enlace Químico y sus ClasesDocumento6 pagineEnlace Químico y sus ClasesEnrique FrikaDas Las JusTas0% (2)
- Enlaces Químicos: Tipos y CaracterísticasDocumento24 pagineEnlaces Químicos: Tipos y CaracterísticasKatia VelásquezNessuna valutazione finora
- Enlaces Químicos: Tipos, Características y Estructura de LewisDocumento5 pagineEnlaces Químicos: Tipos, Características y Estructura de LewisLina Rosa MorenoNessuna valutazione finora
- Enlace QuimicoDocumento6 pagineEnlace QuimicoGustavo Moya AtahuichiNessuna valutazione finora
- resumen enlacesDocumento1 paginaresumen enlacesRomina Ameluz GarciaNessuna valutazione finora
- Apuntes Subtemas Unidad IiiDocumento27 pagineApuntes Subtemas Unidad IiiJose Castro AlbertoNessuna valutazione finora
- Unicaribe - Quimica I - Unidad 3. Actividad 1. EntregableDocumento2 pagineUnicaribe - Quimica I - Unidad 3. Actividad 1. EntregableAlvert MartinezNessuna valutazione finora
- Enlaces Químicos ExpoDocumento15 pagineEnlaces Químicos Expogabby_01100% (1)
- Enlaces químicos y estructuras molecularesDocumento90 pagineEnlaces químicos y estructuras molecularesTorres Lázaro MarlenNessuna valutazione finora
- Práctica 1 ESIMEDocumento17 paginePráctica 1 ESIMEElaine AlbiterNessuna valutazione finora
- Enlace QuímicoDocumento2 pagineEnlace QuímicoLuis TumeNessuna valutazione finora
- Enlaces QuimicosDocumento4 pagineEnlaces QuimicosPablo ReyesNessuna valutazione finora
- Act#9 - ResumenDocumento7 pagineAct#9 - ResumenJoelEmiliano195Nessuna valutazione finora
- Enlace QuimicoDocumento19 pagineEnlace QuimicoDiego Hanan HerreraNessuna valutazione finora
- Uniones QuímicasDocumento15 pagineUniones QuímicasFelipe Alejandro JaraNessuna valutazione finora
- Actividad 01Documento11 pagineActividad 01Yael MorgadoNessuna valutazione finora
- Tema 2. El Enlace QuímicoDocumento9 pagineTema 2. El Enlace Químicoishaan bhatiaNessuna valutazione finora
- Enlaces Químicos GlosarioDocumento2 pagineEnlaces Químicos GlosariojaviNessuna valutazione finora
- Relación Entre Los Enlaces Químicos, Materiales y Sus PropiedadesDocumento14 pagineRelación Entre Los Enlaces Químicos, Materiales y Sus PropiedadesRodrigo Andrés33% (3)
- Lectura EnlacesDocumento4 pagineLectura EnlacesMario OG100% (1)
- Enlaces QuímicosDocumento2 pagineEnlaces QuímicosZanabria LopezNessuna valutazione finora
- Qué EsDocumento2 pagineQué Esfabianaguilar1219Nessuna valutazione finora
- Analiza Los Fundamentos de Los Enlaces Químicos y El Enlace IónicoDocumento3 pagineAnaliza Los Fundamentos de Los Enlaces Químicos y El Enlace IónicoMARIAM AYLLONNessuna valutazione finora
- Trabajo de Quimica, Enlace QuimicoDocumento11 pagineTrabajo de Quimica, Enlace QuimicoAna MartinezNessuna valutazione finora
- ElectronegatividadDocumento5 pagineElectronegatividadYeritzon VeraNessuna valutazione finora
- Tipos de enlaces químicos: metálico, iónico, covalente polar y no polarDocumento4 pagineTipos de enlaces químicos: metálico, iónico, covalente polar y no polarDesInc Colectivo de DiseñoNessuna valutazione finora
- Tarea Quimica MuchaDocumento2 pagineTarea Quimica MuchaSkarleth PancardoNessuna valutazione finora
- Enlaces químicos octavo gradoDocumento9 pagineEnlaces químicos octavo gradoFreddy Santiago MartinezNessuna valutazione finora
- QuimicaaaaaDocumento17 pagineQuimicaaaaajjsoiNessuna valutazione finora
- Unidad 3. Enlace QuímicoDocumento117 pagineUnidad 3. Enlace QuímicoXhuxhii D GivesNessuna valutazione finora
- Guia de Actividades Grado 10Documento4 pagineGuia de Actividades Grado 10chuquifourNessuna valutazione finora
- Apuntes Enlace Químico PDFDocumento7 pagineApuntes Enlace Químico PDFConsuelo Andrea Escobar MolinaNessuna valutazione finora
- Clasificacion de Los Enlaces QuimicosDocumento6 pagineClasificacion de Los Enlaces QuimicosJeremy AlvarezNessuna valutazione finora
- Tarea Quimica 3 UnidadDocumento10 pagineTarea Quimica 3 UnidadJorge Luis Hernandez VNessuna valutazione finora
- Cristalografia Estructural (2021)Documento8 pagineCristalografia Estructural (2021)Fernando Velasquez DiazNessuna valutazione finora
- El Enlace QuimicoDocumento5 pagineEl Enlace QuimicoMARS992Nessuna valutazione finora
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDa EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseValutazione: 4.5 su 5 stelle4.5/5 (7)
- Reporte Practica 8Documento8 pagineReporte Practica 8Uriel A DavalosNessuna valutazione finora
- Reporte Practica 6Documento10 pagineReporte Practica 6Uriel A DavalosNessuna valutazione finora
- Reporte Practica 9Documento8 pagineReporte Practica 9Uriel A DavalosNessuna valutazione finora
- Reporte Practica 1Documento4 pagineReporte Practica 1Uriel A DavalosNessuna valutazione finora
- Reporte Practica 3Documento5 pagineReporte Practica 3Uriel A DavalosNessuna valutazione finora
- Reporte Práctica Óxidos e HidróxidosDocumento6 pagineReporte Práctica Óxidos e HidróxidosUriel A DavalosNessuna valutazione finora
- Conductividad eléctrica de sustancias y solucionesDocumento6 pagineConductividad eléctrica de sustancias y solucionesUriel A DavalosNessuna valutazione finora
- GraficaDocumento1 paginaGraficaUriel A DavalosNessuna valutazione finora
- Ensaye de compresión triaxialDocumento25 pagineEnsaye de compresión triaxialUriel A DavalosNessuna valutazione finora
- GraficaDocumento1 paginaGraficaUriel A DavalosNessuna valutazione finora
- Reporte Practica 0Documento3 pagineReporte Practica 0Uriel A DavalosNessuna valutazione finora
- 1.4 Analisis de Cargas Por GravedadDocumento50 pagine1.4 Analisis de Cargas Por GravedadUriel A Davalos100% (6)
- YooyoyDocumento7 pagineYooyoyUriel A DavalosNessuna valutazione finora
- GRANULOMETRIADocumento62 pagineGRANULOMETRIAUriel A DavalosNessuna valutazione finora
- Vivienda 2014Documento359 pagineVivienda 2014Juan Del Angel PabloNessuna valutazione finora
- Dra Lorella Castorena Anlisis Social y Demogrfico de Los OasisDocumento27 pagineDra Lorella Castorena Anlisis Social y Demogrfico de Los OasisUriel A DavalosNessuna valutazione finora
- Afiliacion de Voluntarios-3Documento3 pagineAfiliacion de Voluntarios-3Uriel A DavalosNessuna valutazione finora
- Practicas de Mecanica de SuelosDocumento24 paginePracticas de Mecanica de SuelosPedro Enrique100% (1)
- 05 ConvocatoriaDocumento45 pagine05 ConvocatoriaUriel A DavalosNessuna valutazione finora
- Ensaye de compresión triaxialDocumento25 pagineEnsaye de compresión triaxialUriel A DavalosNessuna valutazione finora
- M MMP 1 07 07Documento9 pagineM MMP 1 07 07Marcos CordobaNessuna valutazione finora
- Por Precio AlzadoDocumento57 paginePor Precio AlzadoGabriel VizcarraNessuna valutazione finora
- Documento 28 C Programa de MaterialesDocumento1 paginaDocumento 28 C Programa de MaterialesUriel A DavalosNessuna valutazione finora
- YeeeDocumento117 pagineYeeeUriel A DavalosNessuna valutazione finora
- Sistemas de Bombeo MecanicoDocumento8 pagineSistemas de Bombeo MecanicoRafael Sanchez NavarroNessuna valutazione finora
- Bombas CalculoDocumento34 pagineBombas CalculoLuis Rincon100% (6)
- Conceptos Corregidos)Documento18 pagineConceptos Corregidos)Uriel A DavalosNessuna valutazione finora
- Trabajo 2da UnidadDocumento18 pagineTrabajo 2da UnidadUriel A DavalosNessuna valutazione finora
- Por Precio AlzadoDocumento57 paginePor Precio AlzadoGabriel VizcarraNessuna valutazione finora
- ESPECIF. PARTICULARESa N109Documento52 pagineESPECIF. PARTICULARESa N109Uriel A DavalosNessuna valutazione finora
- CTM Clase 10-2019-1Documento49 pagineCTM Clase 10-2019-1Joel GarcíaNessuna valutazione finora
- Ciencia de Los Materiales LaboratorioDocumento2 pagineCiencia de Los Materiales LaboratorioSantiago BeltranNessuna valutazione finora
- Enlaces químicos polaresDocumento4 pagineEnlaces químicos polaresMARIA VALENTINA ARANA VASQUEZNessuna valutazione finora
- Quimica Expo PracticaDocumento8 pagineQuimica Expo PracticaKatheryn Ruesta AlarconNessuna valutazione finora
- Tarea2 401582 26Documento20 pagineTarea2 401582 26JefferssonFlorezMeneses100% (1)
- Química Polaridad y SimetríaDocumento6 pagineQuímica Polaridad y SimetríaJuan FernandoNessuna valutazione finora
- Enlaces AtomicosDocumento42 pagineEnlaces AtomicosvaleriaNessuna valutazione finora
- Enlace Químico CienciasDocumento7 pagineEnlace Químico CienciasJuana Valentina Perdomo RinconNessuna valutazione finora
- Examen Simulacro 1 IpnDocumento8 pagineExamen Simulacro 1 IpnFrida escalanteNessuna valutazione finora
- Sesión 10Documento53 pagineSesión 10Adolfo GuerreroNessuna valutazione finora
- Guia Ciencias Naturales Tercer Periodo NovenoDocumento27 pagineGuia Ciencias Naturales Tercer Periodo NovenoJuan LoaizaNessuna valutazione finora
- Enlaces QuimicosDocumento2 pagineEnlaces Quimicos- Saky -Nessuna valutazione finora
- Radiación en medicinaDocumento3 pagineRadiación en medicinaCamilo QuinteroNessuna valutazione finora
- Practica 1-2 PDFDocumento18 paginePractica 1-2 PDFMiilagros Aliaga CruzNessuna valutazione finora
- Eje 1 - Limpiando La Fabrica de La Negatividad y Malas EnergiasDocumento17 pagineEje 1 - Limpiando La Fabrica de La Negatividad y Malas EnergiasLuisa Fernanda Pulgarin Hoyos100% (1)
- Laboratorio Tabla PeriodicaDocumento32 pagineLaboratorio Tabla PeriodicaArte CervezaNessuna valutazione finora
- Enlaces químicos y propiedades de los compuestosDocumento69 pagineEnlaces químicos y propiedades de los compuestosGuadalupe Calihua PerroniNessuna valutazione finora
- Informe de Propiedades Ionicas y CovalentesDocumento3 pagineInforme de Propiedades Ionicas y CovalentesAnonymous PuN1VQHqfrNessuna valutazione finora
- Examen de Quimica Bachillerato OrdinarioDocumento34 pagineExamen de Quimica Bachillerato OrdinarioErick QuirósNessuna valutazione finora
- Flotación de Minerales (Libro) PDFDocumento127 pagineFlotación de Minerales (Libro) PDFElena Tobar VelásquezNessuna valutazione finora
- Cuadros IcmDocumento5 pagineCuadros IcmMichael Sernaque CordovaNessuna valutazione finora
- Syllabus Del Curso Estructura Molecular.Documento13 pagineSyllabus Del Curso Estructura Molecular.Diego Javier Cohecha León SenaNessuna valutazione finora
- HibridacionDocumento154 pagineHibridacionIngrid Espinoza100% (2)
- Química 3ero Guia Quimica Organica 2020Documento11 pagineQuímica 3ero Guia Quimica Organica 2020Pamela SalasNessuna valutazione finora
- Exámenes FyQ 3º ESODocumento62 pagineExámenes FyQ 3º ESOJuan Carlos Rodríguez Pérez100% (1)
- Nomenclatura Compuestos - Inorganicos 2020ADocumento37 pagineNomenclatura Compuestos - Inorganicos 2020ALyn SamanoNessuna valutazione finora
- QUÍMICA BÁSICADocumento9 pagineQUÍMICA BÁSICAJUALGUVANessuna valutazione finora
- Resumen de Compuesto Inorgánicos de Estructura Compleja PDFDocumento146 pagineResumen de Compuesto Inorgánicos de Estructura Compleja PDFAlberto RodríguezNessuna valutazione finora
- ESTRUCTURA DE LEWIsDocumento16 pagineESTRUCTURA DE LEWIsPriscila Lanado HuacacNessuna valutazione finora
- Informe Laboratorio 1 Identificacion de Enlaces QuimicosDocumento8 pagineInforme Laboratorio 1 Identificacion de Enlaces QuimicosDiego Salinas Umeres100% (2)