Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Unidad VII Gases
Caricato da
BegoPGCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Unidad VII Gases
Caricato da
BegoPGCopyright:
Formati disponibili
29/03/2014
UNIDAD VII
ESTADO GASEOSO
DE LA MATERIA
Prof. Mayra Garca
PUCMM
Elementos que existen como gases a 250C y 1 atm
29/03/2014
Sustancias que aparecen como gases a 25C y 1 atm
Elementos
Compuestos
H2
HF
78%
N2
HCl
21%
O2
esencial para la vida
HBr
O3
HI
F2
CO
Cl2
CO2
He
NH3
Ne
NO
Ar
NO2
Kr
N2O
Xe
SO2
Rn
H2S
1%
color caf oscuro
} muy txicos
HCN
Caractersticas fsicas de los gases
Los gases adoptan el volumen y forma del recipiente que
los contiene.
Se consideran los ms compresibles de los estados de
la materia.
Cuando se encuentran confinados en el mismo
recipiente se mezclan uniforme y completamente.
Cuentan con densidades mucho menores que los
lquidos y slidos (g/L)
29/03/2014
PRESIN DE UN GAS
Presin =
Fuerza
rea
Presin
atmosfrica
Unidades de presin
1 pascal (Pa) = 1 Nw/m2
1 atm = 760 mmHg = 760 torr
1 atm = 101,325 Pa = 101.3KPa
Barmetro
Columna
de aire
10 millas
4 millas
0.2 atm
0.5 atm
Nivel del mar 1 atm
29/03/2014
Manmetros usados para medir las presiones de los gases
Vaco
Gas
Gas
Para medir presiones menores
que la presin atmosfrica
Para medir presiones iguales o
mayores que la presin atmosfrica
Ley de Boyle (relacin volumen-presin)
1
P
V1
P
V= k 1
P
PV=k
Siempre que la cantidad
de gas y la temperatura
permanezcan constantes
Aplicacin de la ley
P1V1 = P2V2
29/03/2014
Ley de Charles y Gay-Lussac
(relacin volumen-temperatura)
La temperatura ser
en escala Kelvin
K = 0C + 273
VT
V=kT
V1 V2
=
T1 T2
k=V
T
Aplicacin de la ley
La presin y la
cantidad de gas
permanecen
constantes
Ley combinada de los gases (relacin
volumen, presin y temperatura)
Ley de Boyle : V 1 ( n y T constante)
P
Ley de Charles : V T ( n y P constante)
V
T
P
V=k
T
P
VP
T
= constante
V1 P1
V P
= 2 2
T1
T2
29/03/2014
Van
V1
V2
n1 = n2
A temperatura
constante, presin
constante
V=kn
Aplicacin
de la ley
molculas
moles
volmenes
molcula
moles
volumen
molculas
moles
volmenes
Ley de Boyle : V 1 (a n y T constante)
P
Ley de Charles : V T (a n y P constante)
Ley de Avogadro : V n (a P y T constante)
V
V = constante x
nT
P
nT
nT
=R
P
P
R es la
constante de
los gases
PV = nRT
29/03/2014
Las condiciones 0 0C (273.15K) y 1 atm son
llamadas temperatura y presin estndar (TPE)
Los experimentos
muestran que a TPE,
1 mol de un gas ideal
ocupa 22.414 L.
PV = nRT
R=
(1 atm)(22.414L)
PV
=
nT
(1 mol)(273.15 K)
R = 0.082057 L atm / K mol
Clculos de densidad (d)
PV = nRT
PV = mRT
densidad
P = mRT
V
m es la masa del gas en g
P
d=
RT
es la masa molar del gas
d es la densidad del gas en g/L
Masa molar ( ) de una sustancia gaseosa
=
dRT
P
mRT
VP
29/03/2014
Un gas que inicialmente tiene un volumen de 4.0L, presin de
1.2 atm y una temperatura de 66C experimenta un cambio de
manera que su volumen y temperatura finales son 1.7L y 42C.
Cul ser la presin final si el nmero de moles permanece
constante?
V1 P1
V P
= 2 2
T1
T2
P2 = V1 P1 T2 = 4.0L x 1.2atm x 315K
V2 T1
1.7L x 339K
= 2.6 atm
Cul es el volumen (en litros) ocupado por 49.8 g de
HCl a TPE?
T = 0 0C = 273.15 K
PV = nRT
nRT
V=
P
P = 1 atm
n = 49.8 g x
1.37 mol x 0.0821
V=
Latm
molK
1 mol HCl
= 1.37 mol
36.45 g HCl
x 273.15 K
1 atm
V = 30.6 L
29/03/2014
Calcule la densidad del bromuro de hidrgeno (HBr)
gaseoso en gramos por litro a 733 mmHg y 46C.
d=
733 mmHg
P
RT
1atm
= 0.964 atm
760 mmHg
K = 46C + 273 = 319 K
d = 0.964 atm x 80.9 g/mol
HBr=
80.9 g/mol
= 2.98 g/L
0.082 L atm / K mol x 319 K
El anlisis qumico de un compuesto gaseoso formado por
78.14% de B y 21.86% de H. A 27C, 74.3mL del gas ejercen una
presin de 1.12atm. Si la masa del gas es 0.0934g. Cul es su
frmula molecular?
Asumimos 100g de compuesto: 78.14g B y 21.86g H
nB= 78.14g B x 1 mol
= 7.23 mol B / 7.23
10.81g B
=1
nH= 21.86g H x 1 mol
= 21.69 mol H / 7.23 =3
1.008g H
=
dRT
mRT
VP
0.0934g x 0.082 L.atm/K.mol x 300K
0.0743L x 1.12atm
BH3
Frmula
emprica
= 27.9g/mol
29/03/2014
compuesto= 27.9 g/mol
Frmula emprica: BH3 emprica = 10.81 + 3(1.008) = 13.83 g/mol
factor =
compuesto
emprica
27.9 g/mol
13.83 g/mol
Si la frmula emprica es BH3
Para obtener la frmula molecular multiplicamos
los subndices por el factor obtenido
Frmula molecular:
B2H6
Ley de Dalton de las presiones parciales
V y T son
constantes
Combinacin
de gases
P1
P2
Ptotal = P1 + P2
10
29/03/2014
Si queremos determinar la presin de algn
componente dentro de la mezcla gaseosa:
P1 = X1 PT
X1 =
P2 = X2 PT
X2 =
n1
n1 + n2
n2
n1 + n2
Pi = Xi PT
Botella llenndose con
oxgeno gaseoso
KClO3 y MnO2
TABLA
Presin de vapor de agua
para diferentes temperaturas
Temperatura Pv H2O
C
Botella llena de agua
lista para colocarse
en la tina de plstico
2KClO3 (s)
mmHg
Botella llena de
oxgeno gaseoso y
vapor de agua
2KCl (s) + 3O2 (g)
PT = PO2 + PH2 O
11
29/03/2014
Una muestra de gas natural contiene 8.24 moles de
CH4, 0.421 moles de C2H6, y 0.116 moles de C3H8. Si
la presin total de los gases es 1.37 atm, cul es la
presin parcial del propano (C3H8)?
PT = 1.37 atm
Pi = Xi PT
0.116 mol
= 0.0132
Xpropano =
(8.24 + 0.421 + 0.116) mol
Ppropano = 0.0132 x 1.37 atm = 0.0181 atm
Un gas se recolecta sobre agua, la presin total fue
medida en 0.92 atm y la presin de vapor a la
temperatura que se encuentra es 31.8 mmHg.
Determine la presin parcial del gas en mmHg.
PT = Pgas + PH 2 O
Pgas = PT - PH 2O
Pgas = 699.2 mmHg 31.8 mmHg = 667.4 mmHg
1 atm ---- 760 mmHg
0.92 atm ---x
= 699.2 mmHg
12
29/03/2014
Estequiometra de los gases
Cul es el volumen de CO2 producido a 37C y 1.00
atm cuando 5.60 g de glucosa se agotan en la
reaccin?:
C6H12O6 (s) + 6O2 (g)
C6H12O6
6CO2
180 g
5.60 g
6 x 44 g
x
nRT
V=
=
P
x = 8.21 g CO2
6CO2 (g) + 6H2O (l)
1 mol CO2
44 g CO2
Latm
x 310.15 K
molK
1.00 atm
= 0.187 mol CO2
0.187 mol x 0.0821
= 4.76 L
EJERCICIOS:
En condiciones de presin constante, una muestra
de gas hidrgeno con un volumen inicial de 9.6 L a
88C se enfra hasta que su volumen es de 3.4 L.
Cul es su temperatura final? Resp: 128 K
A 741 Torr y 44C, 7.10g de un gas ocupan un volumen de
5.40 L. ?Cul es la masa molar del gas? Resp: 35.1 g/mol
Calcule la masa en gramos de cloruro de hidrgeno que se
forma cuando 5.6 L de hidrgeno molecular, medido a TPE
reacciona con un exceso de cloro molecular gaseoso.
H2 (g) + Cl2 (g)
2 HCl (g)
Resp: 18.2 g HCl
13
Potrebbero piacerti anche
- N.E 4 JusticeDocumento177 pagineN.E 4 JusticeBegoPG100% (3)
- Equivalencias de Unidades PDFDocumento1 paginaEquivalencias de Unidades PDFbego_m127Nessuna valutazione finora
- Unidad 3 Teoria Cuántica y Estructura Electrónica de Los ÁtomosDocumento50 pagineUnidad 3 Teoria Cuántica y Estructura Electrónica de Los ÁtomosBegoPGNessuna valutazione finora
- Unidad 1 La Química y Las MedicionesDocumento31 pagineUnidad 1 La Química y Las MedicionesBegoPGNessuna valutazione finora
- Unidad IV Relaciones Periódicas Entre Los ElementosDocumento11 pagineUnidad IV Relaciones Periódicas Entre Los ElementosBegoPGNessuna valutazione finora
- Bases de RadiofísicaDocumento229 pagineBases de Radiofísicacurisuchian50% (2)
- Cálculo de la altura diferencial h usando la fórmula de presión hidrostática P= ρ1gh1 + ρ2gh2 + ρ3gh3Documento2 pagineCálculo de la altura diferencial h usando la fórmula de presión hidrostática P= ρ1gh1 + ρ2gh2 + ρ3gh3Maggi RamirezNessuna valutazione finora
- Armonía Funcional - Alejandro ReyesDocumento107 pagineArmonía Funcional - Alejandro ReyesRafael Solís Oporto75% (4)
- 100000TE02L - Fisica IIDocumento10 pagine100000TE02L - Fisica IIMayra CastroNessuna valutazione finora
- 01 INTRODUCCION A LOS CIRCUITOS ELECTRICOS - PDF Versión 1Documento28 pagine01 INTRODUCCION A LOS CIRCUITOS ELECTRICOS - PDF Versión 1Gustavo Alfonso Torres MorenoNessuna valutazione finora
- PLANIFICACIÓN Desarrollo de Estrategías de Tolerancia A La FrustraciónDocumento4 paginePLANIFICACIÓN Desarrollo de Estrategías de Tolerancia A La FrustraciónClaudio Mena100% (1)
- Ejercicios resueltos de MRU y MRUVDocumento14 pagineEjercicios resueltos de MRU y MRUVNathan FuraNessuna valutazione finora
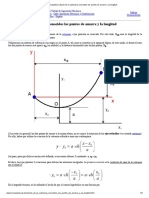
- Mecapedia-Cálculo de La Catenaria Conocidos Los Puntos de Amarre y La LongitudDocumento4 pagineMecapedia-Cálculo de La Catenaria Conocidos Los Puntos de Amarre y La LongitudErnesto Simón Ascencios Zorrilla100% (1)
- Tarea IiDocumento10 pagineTarea IiYohanna Santana de HicioanoNessuna valutazione finora
- Geoquímica de las rocas sedimentariasDocumento29 pagineGeoquímica de las rocas sedimentariasEsther VargasNessuna valutazione finora
- Corriente Alterna TrifásicaDocumento11 pagineCorriente Alterna TrifásicaRicar0% (1)
- El GoniometroDocumento27 pagineEl GoniometroAndres Bermudez Parra50% (4)
- Procesos Del Gas Natural Gonzalo Fiorilo 17 02 18Documento112 pagineProcesos Del Gas Natural Gonzalo Fiorilo 17 02 18Jimmy JohnsNessuna valutazione finora
- Lentes de SeguridadDocumento22 pagineLentes de SeguridadNishaAniitaAroneNessuna valutazione finora
- 3 3 Coeficiente TauDocumento7 pagine3 3 Coeficiente TauFer Castillo A.Nessuna valutazione finora
- Silabo de Mecanica de Suelos I: Escuela de Ingeniería CivilDocumento4 pagineSilabo de Mecanica de Suelos I: Escuela de Ingeniería CivilNiler Maicol Ocrospoma AlvaNessuna valutazione finora
- Sistema de Control I - Análisis de Sistemas de ControlDocumento3 pagineSistema de Control I - Análisis de Sistemas de Controljhon valdivia vasquezNessuna valutazione finora
- Flujo Externo Alrededor de Cilindros2Documento7 pagineFlujo Externo Alrededor de Cilindros2Christopher CervantesNessuna valutazione finora
- FAARALDocumento15 pagineFAARALFERNANDA BECERRA100% (1)
- Fichas de Fisica y Quimica 3 EsoDocumento68 pagineFichas de Fisica y Quimica 3 EsogeorginaNessuna valutazione finora
- Manual de Oceaografia 2018Documento104 pagineManual de Oceaografia 2018Erick Oriol Sanchez VargasNessuna valutazione finora
- Laboratorio 2Documento22 pagineLaboratorio 2Darina CastilloNessuna valutazione finora
- Propiedades Mecánicas PDFDocumento80 paginePropiedades Mecánicas PDFMijail Solis Diaz100% (1)
- PortafolioDocumento15 paginePortafolioMarcos BarillasNessuna valutazione finora
- Determinación Del Patron de Mezclado en Un Tanque AgitadoDocumento6 pagineDeterminación Del Patron de Mezclado en Un Tanque AgitadoMonica RiveraNessuna valutazione finora
- 1 Conceptos Introductorios y Definiciones Fundamentos de Termodinamica Tecnica Moran ShapiroDocumento29 pagine1 Conceptos Introductorios y Definiciones Fundamentos de Termodinamica Tecnica Moran ShapirojwanNessuna valutazione finora
- Tarea 2: Transferencia de Oleaje: Ingenier Ia de CostasDocumento21 pagineTarea 2: Transferencia de Oleaje: Ingenier Ia de CostasFrancisco PintoNessuna valutazione finora
- Espinterometro ALTO VOLTAJEDocumento6 pagineEspinterometro ALTO VOLTAJEChurosLocosNessuna valutazione finora
- Informe AlternadorDocumento6 pagineInforme AlternadorRaul HinojozaNessuna valutazione finora