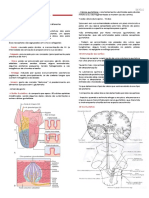
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Titulac - A - o Potenciometrica Da Glicina
Caricato da
Carla NogueiraDescrizione originale:
Titolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Titulac - A - o Potenciometrica Da Glicina
Caricato da
Carla NogueiraCopyright:
Formati disponibili
Data de Entrega:13/05/2013
Docente: Jos Armando Silva
Titulao Potenciomtrica da Glicina
Laboratrios de Qumica II
Grupo 4 Turno A:
Joana Matos Silva Mendes dos Reis
Ana Patrcia Ferreira Alves de Macedo
Susana Broeiro Bento
76307
74219
76199
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
ndice
1 - RESUMO
2 - PARTE EXPERIMENTAL
2.1 MTODO EXPERIMENTAL
2.2 APARELHAGEM
2.3 REAGENTES
3
3
3
3 - RESULTADOS
3.1CLCULO DOS VALORES DE PKAS
3.2 PONTOS DE EQUIVALNCIA
3.3 LOCALIZAO DAS ZONAS TAMPO
3.4 PONTO ISOELCTRICO
3.5 RESUMO DOS RESULTADOS
5
6
6
6
7
4 - DISCUSSO DOS RESULTADOS
5 - BIBLIOGRAFIA
10
6 - ANEXOS
11
6.1 CADERNO DE LABORATRIO
11
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
1 - Resumo
Neste trabalho, determinou-se o pKa de um aminocido, a glicina, atravs de uma titulao
potenciomtrica.
Foi traada a curva de titulao da glicina a partir da qual se obtiveram os dois valores de pKa
(pH no ponto de meia titulao), os pontos de equivalncia, os pontos de meia titulao e as
respectivas zonas tampo.
O primeiro ponto de meia titulao situou-se, aproximadamente, nos 3,61ml de base
adicionada, cujo pKa1 foi de 2,53, e o segundo nos 9,79 ml, ao que corresponde o valor 9,72 de
pKa2. A partir destes valores de pKa1 e de pKa2, calculou-se o ponto isoelctrico do
aminocido, tendo obtido um valor de 6,17.
O primeiro ponto de equivalncia situou-se aproximadamente nos 7,25ml e o segundo nos
13,50 ml. O pH foi respectivamente 6,31 e 11,03.
As zonas tampo do aminocido situaram-se entre os valores [2,14;2,97] e [9,27;10,21].
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
2 - Parte experimental
2.1 - Mtodo experimental
O trabalho experimental foi executado de acordo com o protocolo disponibilizado nas pginas 63 e 64
do Guia de Laboratrios de Qumica II 2012/2013.
2.2 - Aparelhagem
Para pesar o aminocido, recorreu-se a uma balana analtica AE260 Delta Range, da Mettler
Toledo, com erro de 0,0001 g. A fim de homogeneizar a soluo, utilizou-se um agitador
magntico/placa de aquecimento da marca Heidolph, e para medies do pH um medidor 744 pHMeter,
da Metrohm. Utilizou-se ainda material de vidro recorrente de laboratrio.
2.3 Reagentes
Para calibrar o pH utilizou-se uma soluo de pH 4,00 +/- 0,02 (25Co) da Panreac, e uma de pH
7,00 +/- 0,02 (25Co) da mesma marca.
O aminocido utilizado foi a glicina, da Merck, com massa molar de 75,07 gmol-1. Foram utilizadas
solues de nitrato de potssio (0,2M), cido clordrico (0,1M), da Flukar, e hidrxido de sdio (0,1 M),
da Merck.
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
3 - Resultados
Para dar incio actividade experimental, foram pesados 0,0459g de Glicina, e
dissolvidos em 25,00mL de Nitrato de Potssio (0,20M). Foi medido o valor de pH da soluo
preparada, registando-se um valor de 5,40.
Primeiramente, procedeu-se titulao da soluo com HCl (0,1M), at ao pH de 2,03,
tendo sido gastos 7,7ml de titulante. Posteriormente, fez-se a titulao da soluo com NaOH
(0,1M), at se atingir o pH de 11,83, tendo sido gastos 16,00ml. Neste ponto, foram feitas
medies de pH para os diferentes volumes de NaOH adicionados.
Atravs dos resultados obtidos na aula experimental foi elaborada a seguinte tabela, que
contm as variaes de volume de NaOH adicionado (V), as variaes de pH entre cada adio (pH), e
o quociente entre a variao de pH e a variao de volume de NaOH (pH/V).
Temperatura (oC)
VNaOH (mL)
pH
18
18,2
18,3
18,4
18,4
18,5
18,5
18,5
18,6
18,6
18,7
18,7
18,9
18,9
18,9
19,0
19,0
19,1
19,1
19,1
19,2
19,2
19,3
19,3
19,3
19,4
19,4
19,5
19,5
19,5
0.00
1.00
2.00
3.00
3.50
4.00
4.50
5.00
5.50
6.00
6.50
7.00
7.50
8.00
8.50
9.00
9.50
10.00
10.50
11.10
11.50
12.00
12.50
13.00
13.50
14.00
14.50
15.00
15.50
16.00
2.03
2.14
2.27
2.42
2.51
2.6
2.71
2.83
2.97
3.15
3.42
4.05
8.56
9.03
9.27
9.46
9.64
9.78
9.91
10.14
10.21
10.36
10.54
10.76
11.03
11.32
11.49
11.63
11.75
11.83
Tabela 1 Valores experimentalmente obtidos de
temperatura, pH e VNaOH
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
Utilizando os dados experimentais, foi traada a curva de titulao da glicina, apresentada no
Grfico 1.
Curva de Titulao da Glicina
14
12
zonas tampo
10
pKa2
pH
8
6
1ponto de
equivalncia
4
2
pKa1
0
0,00
2,00
4,00
6,00
8,00
10,00
12,00
14,00
16,00
18,00
VNaOH (mL)
Grfico 1 - Curva de titulao potenciomtrica da Glicina e respectivos pontos
3.1 Clculo dos valores de pKas
Atravs da interpretao do grfico acima, pode-se concluir que os valores de pKa1 e pKa2 so 2,53
e 9,72, respectivamente. Os volumes da NaOH gastos, para atingir as zonas onde o poder tampo
mximo, foram, aproximadamente, 3,61ml e 9,79ml, respectivamente. Os valores de pKa correspondem
aos pontos de meia titulao.
Clculo do erro experimental:
( )
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
pKs tericos
pKs experimentais
(%) erro
2,36
0,03
2,53
7,20%
9,57
0,04
9,72
1,57%
Tabela 2 - Erro experimental obtido, tendo por valor base valores publicados com fora
inica de 0,1M
3.2 - Pontos de Equivalncia
Os pontos de equivalncia correspondem ao ponto em que a reaco se d segundo a
proporo estequiomtrica da equao. Mais uma vez, pela anlise do grfico 1, possvel concluir que
o valor de pH do primeiro ponto de equivalncia 6,31, correspondendo a um volume de base de
7,25ml, e de 11,03 para o segundo ponto de equivalncia, cujo volume correspondente de base
13,5ml.
3.3 - Localizao das zonas Tampo
Entende-se por soluo tampo uma soluo que resiste a pequenas variaes de pH, dentro de
certos limites, tanto por adio de H3O+/OH- como por variao da concentrao da soluo.
A glicina exerce maior poder tampo nas proximidades dos pontos de meia-titulao. Sendo
assim, este aminocido exerce maior poder tampo quando o pH varia entre [2,14;2,97] e
[9,27;10,21].
3.4 - Ponto Isoelctrico
O ponto isoelctrico de um aminocido corresponde ao valor de pH para o qual o nmero de
cargas negativas e cargas positivas se iguala. Este ponto determinado pela magnitude das duas
constantes de dissociao (pKa1 e pKa2) e , aproximadamente, igual mdia aritmtica destes 2 valores.
6
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
Dados:
Figura 1 Parmetros de pKa
determinados
O volume gasto de titulante para atingir o ponto isoelctrico foi, aproximadamente, 5,87ml.
3.5 Resumo dos Resultados
VNaOH (mL)
pH
1 Ponto de Meia-Titulao (pKa1)
3,61
2,53
2 Ponto de Meia-Titulao (pKa2)
9,79
9.72
1 Ponto de Equivalncia
7,25
6,31
2 Ponto de Equivalncia
13,5
11,03
2,14-2,97
Zonas Tampo
9,27-10,21
Tabela 2 Tabela resumo dos valores clculados
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
4 - Discusso dos Resultados
Neste trabalho, recorreu-se ao mtodo da titulao potenciomtrica com o intuito de estudar as
propriedades cido-base de um aminocido, neste caso, a glicina. Uma titulao potenciomtrica
consiste na medio da variao de pH do titulado, medida que se adicionam pequenos volumes de
titulante, de modo a traar a curva de titulao pH vs. Volume de titulante adicionado.
Sendo a glicina um aminocido diprtico, tem tendncia a perder dois protes, o que, numa
reaco cido-base, ir corresponder a dois pontos de equivalncia, dois valores de pKa e a trs
patamares, observveis na curva de titulao.
Figura 2 Protonao da glicina
Para o acerto do pH da soluo de aminocido (pHinicial=5,40), foram adicionados 7,50 mL de HCl,
at a soluo atingir um valor de pH prximo de 2,00 (pHobtido=2,03), de modo a protonar
completamente o aminocido, dando assim incio titulao com a base (NaOH).
Aps a execuo do trabalho experimental, e recorrendo folha de clculo fornecida, pde-se
retirar os valores de pKa1 e pKa2, sendo estes, respectivamente, 2,53 e 9,72. Tais valores correspondem
aos pontos de meia titulao.
Os valores publicados para pKa1 e pKa2 so, respectivamente, 2,36 e 9,57. O que representa um
erro de experimental de 7,20% e 1,57%. Esta percentagem de erro pode ser justificada, uma vez que os
valores de pKa dependem da temperatura e da fora inica mdia do trabalho. Os valores publicados
so para uma temperatura de 25C e para uma fora inica de 0,1M, no entanto, a fora inica mdia
neste trabalho foi de 0,1266 e a temperatura no foi de todo constante.
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
Calculou-se o ponto isoelctrico, sendo que o mesmo dado pela mdia aritmtica de pKa1 e
pKa2. O valor obtido foi de 6,17 face a 5,97, calculado atravs da mdia aritmtica dos pKas tabelados,
obtendo-se um erro experimental de 3,35%.
Como j mencionado, a titulao da glicina apresenta dois pontos de equivalncia distintos. O
primeiro corresponde ao pH de 6,31 e 7,25ml de base adicionados, enquanto o segundo diz respeito a
um pH de 11,03 e um volume de 13,5ml de NaOH.
Assim, possvel concluir que o valor de pH do primeiro ponto de equivalncia muito prximo
do ponto isoelctrico calculado experimentalmente (6,17), mas no coincide com o mesmo. Esta
diferena deve-se ao facto de no se tratar de uma titulao cido-base. No entanto, seria de esperar
que dada a situao deste trabalho experimental, o valor do pH do ponto de equivalncia fosse
ligeiramente menor que o ponto isoelctrico, o que no se verifica.
A glicina exerce poder tampo para valores de pH prximos de pKa, sendo o poder tampo
mximo quando pH=pKa. As zonas de pH onde esta exerce maior poder tampo so entre [2,14;2,97] e
[9,27;10,21].
Idealmente, o volume de NaOH adicionado seria igual em ambas as zonas tampo, uma vez que
a concentrao de HCl seria a mesma que a da glicina. Como esta situao no verificada, conclui-se
que existe um excesso de HCl, o que aumenta a acidez da soluo, contribuindo para o erro
experimental.
A zona inicial e final da curva de titulao no podem ser consideradas como zonas
tampo pois no representam um equilbrio entre duas espcies, mas sim um excesso de uma
ou outra espcie.
Nestas zonas o valor de pH depende directamente da concentrao da espcie em
excesso, por outras palavras, o pH da soluo varia, consideravelmente, com a diluio da
mesma e a soluo no um tampo.
Os erros do trabalho podem ser variados, passando pela m calibrao de elctrodo
combinado de pH, erros de paralaxe na medio dos volumes e erros nos valores calculados,
em resultado de certas aproximaes.
O mtodo usado neste trabalho para a determinao dos valores poderia ser mais
precisa. Outro mtodo possvel de tratar os resultados seria o clculo da primeira derivada da
curva de titulao, que pelos seus mximos, nos forneceria os valores dos pka, e da segunda
derivada, pela qual obteramos os pontos de equivalncia, traduzidos pelos pontos de inflexo.
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
5 - Bibliografia
[1] - Conceio A, Delgado R, Diogo H, Duarte T, Fernandes A, Armando Silva J, Lopes J. N,
Piedade M. M, Guia de Laboratrio de Qumica II, AEIST, Lisboa 2012/2013;
10
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
6 Anexos
6.1 Caderno de Laboratrio
11
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
12
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
13
Titulao Potenciomtrica de um Aminocido
Laboratrios de Quimca II
14
Potrebbero piacerti anche
- Acido AscorbicoDocumento6 pagineAcido AscorbicoMarleneFernandes100% (1)
- Determine A Quantidade de FerroDocumento2 pagineDetermine A Quantidade de FerroMarcio Roberto0% (1)
- Determinação Da Cinética de Biotransformação Do Guaiacol Pela Enzima Peroxidase Contida No Rabanete (Raphanus Sativus L.) Por Meio Da Técnica Espectrofotométrica PDFDocumento19 pagineDeterminação Da Cinética de Biotransformação Do Guaiacol Pela Enzima Peroxidase Contida No Rabanete (Raphanus Sativus L.) Por Meio Da Técnica Espectrofotométrica PDFAndre da Luz100% (1)
- Lista de Exercícios 3Documento2 pagineLista de Exercícios 3MatheusLopes100% (1)
- Relatorio - Ácidos e BasesDocumento6 pagineRelatorio - Ácidos e BasesJoão Pedro VasconcelosNessuna valutazione finora
- Calor Médio de SoluçãoDocumento5 pagineCalor Médio de Soluçãocibeli_mayNessuna valutazione finora
- Relatório #3 - Teor de AmôniaDocumento3 pagineRelatório #3 - Teor de AmôniaKurtz100% (1)
- Ponto de Fusão de Compostos Orgânicos (Alfa Naftol e Acido Benzóico)Documento13 paginePonto de Fusão de Compostos Orgânicos (Alfa Naftol e Acido Benzóico)Ricardo LimaNessuna valutazione finora
- Relatório Permanganimetria I e IIDocumento8 pagineRelatório Permanganimetria I e IIMarcos LimaNessuna valutazione finora
- Estudo RenalDocumento3 pagineEstudo RenalBruna Navarro0% (1)
- Entendendo e Demonstrando A Sustentabilidade Ambiental Na Geracao de EnergiaDocumento8 pagineEntendendo e Demonstrando A Sustentabilidade Ambiental Na Geracao de EnergiaCarlos - ShopmasonNessuna valutazione finora
- Relatório Coeficiente de DilataçãoDocumento5 pagineRelatório Coeficiente de DilataçãoThalita PradoNessuna valutazione finora
- Relatório Da GlicinaDocumento4 pagineRelatório Da GlicinaJessyca F Medeiros100% (1)
- Elementos de Eletronica Digital - Idoeta e CapuanoDocumento4 pagineElementos de Eletronica Digital - Idoeta e CapuanoMatheusNessuna valutazione finora
- Relatório 5 - Índice de IodoDocumento5 pagineRelatório 5 - Índice de IodoMilena SantosNessuna valutazione finora
- P.I.O AnilinaDocumento29 pagineP.I.O AnilinaThaynara MotaNessuna valutazione finora
- Lista de Exercícios-EuzébioDocumento17 pagineLista de Exercícios-EuzébioIsisTNessuna valutazione finora
- Relatório PH Quimica Analitica QualitativaDocumento16 pagineRelatório PH Quimica Analitica QualitativaKaren GrauthNessuna valutazione finora
- Lista 1 Tratamento de ÁguaDocumento5 pagineLista 1 Tratamento de ÁguaAndres CastañoNessuna valutazione finora
- Apostila QUI606 Quimica Analitica IDocumento64 pagineApostila QUI606 Quimica Analitica IJuliana CamposNessuna valutazione finora
- Relatório Do Laboratório Virtual de FísicaDocumento5 pagineRelatório Do Laboratório Virtual de FísicaEdson Luiz Ferreira Santos0% (1)
- Inter Relações MetabólicasDocumento21 pagineInter Relações MetabólicasNhaueleque JúniorNessuna valutazione finora
- Lista 2 - Granulometria PlasticidadeDocumento1 paginaLista 2 - Granulometria PlasticidadeWendell Mendes100% (1)
- Iii - Replicação PDFDocumento12 pagineIii - Replicação PDFSandra NascimentoNessuna valutazione finora
- Relatorio - Extração DNA Cebola - CompletoDocumento10 pagineRelatorio - Extração DNA Cebola - CompletoPaulinhaa MesquitaNessuna valutazione finora
- Sintese FinalDocumento14 pagineSintese FinalLuiz PenidoNessuna valutazione finora
- Relatório 3 2º BimestreDocumento6 pagineRelatório 3 2º BimestreMonica MacedoNessuna valutazione finora
- DETERMINAÇÃO DA ORDEM DE REAÇÃO ENTRE O TIOSSULFATO DE SÓDIO E ÁCIDO CLORÍDRICO - Reagentes em ExecessoDocumento28 pagineDETERMINAÇÃO DA ORDEM DE REAÇÃO ENTRE O TIOSSULFATO DE SÓDIO E ÁCIDO CLORÍDRICO - Reagentes em ExecessoLeonardo Andrade100% (8)
- Método de Mohr (Relatório)Documento3 pagineMétodo de Mohr (Relatório)Claudio AugustoNessuna valutazione finora
- RELATORIO 4 FQ - Velocidade Da Reação de Decomposição Do H2O2 Catalisada Por Fe3+ - Avaliação TermoquímicaDocumento14 pagineRELATORIO 4 FQ - Velocidade Da Reação de Decomposição Do H2O2 Catalisada Por Fe3+ - Avaliação TermoquímicaSérgio GuimarãesNessuna valutazione finora
- Determinação de Constantes Físicas de Compostos OrgânicosDocumento12 pagineDeterminação de Constantes Físicas de Compostos OrgânicosSabrina Mara100% (1)
- Bula Amilase - ANALISADocumento2 pagineBula Amilase - ANALISAPaulo LauarNessuna valutazione finora
- L1 GASES CALOR TRAB PRIMEIRA LEI V14 VFDocumento8 pagineL1 GASES CALOR TRAB PRIMEIRA LEI V14 VFMayara AlmeidaNessuna valutazione finora
- Relatório - Determinação Do Teor Vitamina CDocumento8 pagineRelatório - Determinação Do Teor Vitamina CAnna Bia100% (1)
- 05 HeterociclicosDocumento37 pagine05 HeterociclicosAmanda Medeiros100% (1)
- Relatório 2Documento14 pagineRelatório 2Tiago MB2112100% (2)
- Sintese Da DibenzalacetonaDocumento9 pagineSintese Da DibenzalacetonaTakakramNessuna valutazione finora
- Aplicação Dos Vetores No Estudo Da Polaridade de MoléculasDocumento4 pagineAplicação Dos Vetores No Estudo Da Polaridade de MoléculasRogerio AndradeNessuna valutazione finora
- Extração de Cafeína (QUI99010-B)Documento4 pagineExtração de Cafeína (QUI99010-B)Tati FloresNessuna valutazione finora
- Livros de Processos Químicos - Balanço de Massa e Balanço de EnergiaDocumento62 pagineLivros de Processos Químicos - Balanço de Massa e Balanço de EnergiafabianaNessuna valutazione finora
- Relatório Experimento 1, 2 e 3Documento12 pagineRelatório Experimento 1, 2 e 3IsmaelNessuna valutazione finora
- Exercicios Resolvidos Capitulo 8 SolomonsDocumento11 pagineExercicios Resolvidos Capitulo 8 SolomonsdefatimapedroNessuna valutazione finora
- REO1 - Vidrarias, Medidas de Volume e Tratamento de DadosDocumento6 pagineREO1 - Vidrarias, Medidas de Volume e Tratamento de DadosANA KAROLINA DE JESUS TEODORONessuna valutazione finora
- Relatorio1 DNS AçucaresDocumento39 pagineRelatorio1 DNS Açucaresminialce100% (1)
- Reatores Químicos em Leito Fluidizado: modelagem e simulaçãoDa EverandReatores Químicos em Leito Fluidizado: modelagem e simulaçãoNessuna valutazione finora
- CondutimetriaDocumento7 pagineCondutimetriaWagner ProchnowNessuna valutazione finora
- Caderno de QuimicaDocumento25 pagineCaderno de QuimicaUelder Jeferson SantosNessuna valutazione finora
- Lista1-Fisica 2Documento3 pagineLista1-Fisica 2Lucas LimaNessuna valutazione finora
- 1 Lista - Com RespostasDocumento7 pagine1 Lista - Com RespostasNikolas Augusto0% (1)
- Relatório Aula 01Documento5 pagineRelatório Aula 01Matheus PaivaNessuna valutazione finora
- Relatório de Práticas de Laboratório de Química Orgânica - Universidade Federal Do Pampa - UNIPAMPADocumento60 pagineRelatório de Práticas de Laboratório de Química Orgânica - Universidade Federal Do Pampa - UNIPAMPALorena VianaNessuna valutazione finora
- 566Documento64 pagine566Marcello MendesNessuna valutazione finora
- Água de Lavagem de Conchas de SorveteDocumento7 pagineÁgua de Lavagem de Conchas de SorveteProf. Magoo FortunaNessuna valutazione finora
- Experimento 4 Equilbrio Quimico RTE2021Documento5 pagineExperimento 4 Equilbrio Quimico RTE2021Leticia BrazNessuna valutazione finora
- 2 - Balanço de MassasDocumento83 pagine2 - Balanço de MassasWilson DavaNessuna valutazione finora
- Relatório Diazoaminobenzeno 3 PDFDocumento11 pagineRelatório Diazoaminobenzeno 3 PDFDaniela PduaNessuna valutazione finora
- Questoes de Sites - Engenheiro de ProcessamentoDocumento14 pagineQuestoes de Sites - Engenheiro de ProcessamentosqagamaNessuna valutazione finora
- Substâncias húmicas aquáticas: Interações com espécies metálicasDa EverandSubstâncias húmicas aquáticas: Interações com espécies metálicasNessuna valutazione finora
- Guia para aulas práticas de biotecnologia de enzimas e fermentaçãoDa EverandGuia para aulas práticas de biotecnologia de enzimas e fermentaçãoNessuna valutazione finora
- RELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaDocumento12 pagineRELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaRaphael Brigagão100% (1)
- TrabalhoAutonomo - Aula3Documento2 pagineTrabalhoAutonomo - Aula3Carla NogueiraNessuna valutazione finora
- Aula 12 - Trabalho Autonomo 1 PDFDocumento2 pagineAula 12 - Trabalho Autonomo 1 PDFCarla NogueiraNessuna valutazione finora
- Aula 8 - Trabalho AutonomoDocumento2 pagineAula 8 - Trabalho AutonomoCarla NogueiraNessuna valutazione finora
- Aula 8 - Classe Abstrata ExerciciosDocumento8 pagineAula 8 - Classe Abstrata ExerciciosCarla NogueiraNessuna valutazione finora
- Aula 9 - Resolucao Do Trabalho AutonomoDocumento11 pagineAula 9 - Resolucao Do Trabalho AutonomoCarla NogueiraNessuna valutazione finora
- Aula 5 - Resolucao Do Trabalho Autonomo e Exercicios de VectoresDocumento6 pagineAula 5 - Resolucao Do Trabalho Autonomo e Exercicios de VectoresCarla NogueiraNessuna valutazione finora
- Aula 8 - Classe Abstrata ExerciciosDocumento8 pagineAula 8 - Classe Abstrata ExerciciosCarla NogueiraNessuna valutazione finora
- Resumos de Histologia IDocumento81 pagineResumos de Histologia ICarla Nogueira0% (1)
- FUNÇÕES INORGÂNICAS ExerciciosDocumento20 pagineFUNÇÕES INORGÂNICAS ExerciciosLuan David J. Batista100% (1)
- Terapêutica Medicamentosa em OdontologiaDocumento26 pagineTerapêutica Medicamentosa em OdontologiaTiago de Carvalho67% (3)
- Esocial QuimicosDocumento3 pagineEsocial QuimicosRodrigo PicoliNessuna valutazione finora
- Cat Ebara DL BrasilDocumento70 pagineCat Ebara DL BrasilSotomayor Reinaldo0% (1)
- Aquecedor Solar Com Forro de PVCDocumento34 pagineAquecedor Solar Com Forro de PVCscriptonNessuna valutazione finora
- Cromo DuroDocumento18 pagineCromo DuroPriscila PereiraNessuna valutazione finora
- La de VidroDocumento2 pagineLa de Vidrophcademartori6059100% (1)
- Química Geral e Inorgânica 2022Documento37 pagineQuímica Geral e Inorgânica 2022Maycon ContildesNessuna valutazione finora
- Treinamento de PPEOBDocumento11 pagineTreinamento de PPEOBCariosvaldo AlvesNessuna valutazione finora
- Gustação + OlfatoDocumento3 pagineGustação + Olfatoluisa campanharoNessuna valutazione finora
- 118 Caderno 3 Série 2022 2 QuíDocumento7 pagine118 Caderno 3 Série 2022 2 QuíWilliam AlvesNessuna valutazione finora
- E.M Moludo A - 3 Elementos ElásticosDocumento17 pagineE.M Moludo A - 3 Elementos ElásticosElenaPeñarandaNessuna valutazione finora
- Ficha de Trabalho Quimica 10ºanoDocumento4 pagineFicha de Trabalho Quimica 10ºanoc2mfNessuna valutazione finora
- Avaliação Adelino 2ano IIbimDocumento1 paginaAvaliação Adelino 2ano IIbimJanser WanderleyNessuna valutazione finora
- Pigmentos HistoquimicaDocumento13 paginePigmentos HistoquimicaolhoverdeNessuna valutazione finora
- 3363 Ficha de EmergênciaDocumento1 pagina3363 Ficha de EmergênciajoseNessuna valutazione finora
- As FormaçΣes Ferríferas do Greenstone Belt Morro do Ferro no Sudoeste do Estado de Minas GeraisDocumento15 pagineAs FormaçΣes Ferríferas do Greenstone Belt Morro do Ferro no Sudoeste do Estado de Minas GeraisHenio SantanaNessuna valutazione finora
- Lâmina - Kinetin LDocumento2 pagineLâmina - Kinetin LIsteuria CristinaNessuna valutazione finora
- Aula 1 - BioenergéticaDocumento30 pagineAula 1 - BioenergéticaJosé Augusto CeronNessuna valutazione finora
- Quadros Paineis Instalacoes EletricasDocumento57 pagineQuadros Paineis Instalacoes EletricasHamilton SoaresNessuna valutazione finora
- ABC Dos AcidosDocumento14 pagineABC Dos AcidosThatiana RibeiroNessuna valutazione finora
- 2 - Secreção GástricaDocumento4 pagine2 - Secreção GástricaJoana FelipeNessuna valutazione finora
- Prova Aerodinâmica GabaritoDocumento2 pagineProva Aerodinâmica GabaritoRenan Cleber CorredatoNessuna valutazione finora
- Contração em Polímeros V1.0Documento7 pagineContração em Polímeros V1.0RanielNessuna valutazione finora
- RmaDocumento61 pagineRmaDaniel BritoNessuna valutazione finora
- Pop HematologiaDocumento15 paginePop Hematologiabioenio100% (3)
- Arvore de Natal PetrobrasDocumento12 pagineArvore de Natal PetrobrasJack DreisNessuna valutazione finora
- Guia RELACRE 9 Carta Controle PDFDocumento56 pagineGuia RELACRE 9 Carta Controle PDFCorinne MartinNessuna valutazione finora
- Aula Ecossistemas AquáticosDocumento60 pagineAula Ecossistemas AquáticosCaroline BezerraNessuna valutazione finora