Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Reporte P9 Charles Ok
Caricato da
Luis Alberto Andres BaltazarTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Reporte P9 Charles Ok
Caricato da
Luis Alberto Andres BaltazarCopyright:
Formati disponibili
UNIVERSIDAD NACIONAL
AUTNOMA DE MXICO
FACULTAD DE INGENIERA
DIVISIN DE CIENCIAS BSICAS
LABORATORIO DE TERMODINMICA
PROFESORA: I.Q. VIANEY FRANCO GARCA
SEMESTRE 2015-1
PRCTICA No. 9
NOMBRE DE LA PRCTICA:
LEY DE CHARLES
GRUPO: 9
BRIGADA #1
INTEGRANTES:
ESCAMILLA SALAZAR MARA JOSEFINA
HERNNDEZ BUSTAMANTE RUBN
LEN DE LA FUENTE DIEGO DAVID
TREJO SNCHEZ SARAH
CIUDAD UNIVERISTARIA A 21 DE OCTUBRE DE 2014.
PRCTICA 9: LEY DE CHARLES
1. OBJETIVOS
Comprobar experimentalmente la Ley de Charles.
Obtener el modelo matemtico que relaciona las variables temperatura y
volumen, as como el grfico volumen - temperatura (V-T).
Inferir experimentalmente la temperatura correspondiente al cero absoluto.
2. DESCRIPCIN DEL PROCESO EXPERIMENTAL
El equipo consta de una ampolleta con dos
termmetros de bulbo de mercurio y otro de gas a
presin constante en su interior.
Se desmonta la ampolleta y se llena de agua hasta
aproximadamente la mitad, para volver a colocarla
con los termmetros en su interior, de modo que el
nivel de agua sobrepase el la gota de mercurio por
aproximadamente 5 cm.
Tomar los datos iniciales de temperatura, y despus prender y colocar el mechero Bunsen
por debajo de la ampolleta. Registrar en una tabla las temperaturas cada vez que stas
(registrada por el termmetro de mercurio colocado a mayor distancia del mechero)
incrementen su temperatura 5 C , y el volumen del tercero, hasta aproximadamente 92.
Con los datos en la tabla, graficar V-T y por el mtodo de mnimos cuadrados obtener la
pendiente y la ordenada al origen, con esta ecuacin obtener el valor del cero absoluto
3. REDACCIN PERSONALIZADA DE LAS ACTIVIDADES EXPERIMENTALES
COMPLEMENTADAS POR ESQUEMAS O DIBUJOS.
Se nos proporcion el equipo montado, por lo que
debimos desmontar con mucho cuidado la ampolleta
para llenarla con agua; siguiendo las instrucciones de
nuestra maestra llenamos aproximadamente la mitad
de la ampolleta, para que al volverla a colocar no
desbordara el agua. Con un vaso de precipitado
nivelamos el agua 5 cm por encima de la gota de
mercurio del termmetro de gas.
Revisamos que al bombear aire no se derramara agua,
esto para mantener lo ms homognea posible la
temperatura, y hacer las mediciones ms precisas.
Revisamos que la graduaciones de los termmetros
fueran visibles, tuvimos que mover uno de ellos pues su
escala se encontraba oculta.
Ya con todas las escalas a la vista tomamos las
temperaturas iniciales y designamos un termmetro a
cada miembro del equipo y otro para bombear aire al
sistema, esto con el fin de que la temperatura no
variara considerablemente. Para poder encender el
mechero bunsen primero tuvimos que abrir dos llaves
de paso de la tubera de gas, que en laboratorio es de
color amarillo, despus conectamos el mechero a la toma de gas en nuestra mesa,
abrimos la llave y lo encendimos, con la vlvula de paso de aire ajustamos la flama hasta
que fuera pequea y de un color azul, esto para no daar la ampolleta.
Escogimos como termmetro patrn uno de los de bulbo de mercurio, y cada vez que se
incrementaba 5 C la temperatura, tombamos el dato, y la dictbamos al compaero
designado.
Al final, ya con los datos y el dimetro interior, calculamos el volumen del aire capturado
en el termmetro de gas. Con la temperatura y el volumen realizamos una regresin lineal
para encontrar la ecuacin que ms se ajustara a nuestros datos. Debido a la relacin
entre la temperatura de un gas y su volumen a presin constante, calculamos el valor del
cero absoluto; al final obtuvimos un porcentaje de error menor a 5%.
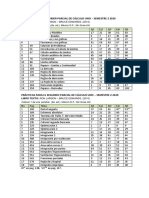
4. TABLAS DE DATOS EXPERIMENTALES
EVENTO T1 [C] T2 [C] [m]
1 22 22 0.17
2 27 28 0.171
3 32 34.5 0.175
4 37 40 0.177
5 42 44.5 0.18
6 47 48 0.183
7 52 54.5 0.186
8 57 59 0.189
9 62 64 0.193
10 67 69 0.195
11 72 74 0.2
12 77 79 0.202
13 82 84.5 0.204
14 87 88.5 0.208
15 92 94 0.211
0
2E-08
4E-08
6E-08
8E-08
0.0000001
1.2E-07
1.4E-07
0 20 40 60 80 100
V
[
m
3
]
T [C]
V-T
5. ALGORITMO DE CLCULOS PARA LLEGAR A LOS RESULTADOS SOLICITADOS, DONDE
SE INCLUYAN LAS OPERACIONES REALIZADAS CON LAS ECUACIONES Y ANLISIS DE
UNIDADES.
Para calcular la temperatura promedio utilizamos la siguiente expresin:
Para calcular el volumen de la columna de gas multiplicamos el valor del rea trasversal de
la columna por la altura de la columna del gas:
(
)
Nuestro modelo matemtico fue planteado de la siguiente manera:
Para calcular el valor de nuestra pendiente y de nuestra ordenada al origen utilizamos una
regresin lineal.
Para obtener el valor de la temperatura correspondiente al cero absoluto, consideramos
que y despejando del modelo matemtico obtuvimos:
Para calcular el error absoluto y el error porcentual utilizamos las siguientes expresiones:
|
|
|
|
6. TABLA DE RESULTADOS
EVENTO Tpromedio [C] V [
]
1 22 9.69x10
-08
2 27.5 9.747 x10
-08
3 33.25 9.975 x10
-08
4 38.5 1.0089x10
-07
5 43.25 1.026 x10
-07
6 47.5 1.0431 x10
-07
7 53.25 1.0602 x10
-07
8 58 1.0773 x10
-07
9 63 1.1001 x10
-07
10 68 1.1115 x10
-07
11 73 1.14 x10
-07
12 78 1.1514 x10
-07
13 83.25 1.1628 x10
-07
14 87.75 1.1799 x10
-07
15 93 1.2027 x10
-07
0.00E+00
2.00E-08
4.00E-08
6.00E-08
8.00E-08
1.00E-07
1.20E-07
1.40E-07
0 20 40 60 80 100
V
[
m
3
]
T [C]
V-T
) [
] (
7. ANLISIS DE RESULTADOS
El objetivo de esta prctica era comprobar experimentalmente la ley de charles, la cual
nos dice que en un proceso isotrmico el volumen de un gas es directamente proporcional
a su temperatura, por ende el cociente de los volmenes entre las temperaturas debera
ser en teora el mismo, es decir, una constante. En nuestro experimento eso no se cumpli
ya que la temperatura que se meda con los termmetros involucraba a la temperatura
del agua y del aire, las cuales tienen capacidades calorficas distintas. Adems nuestro
proceso no puede ser considerado un proceso cuasiesttico ya que estuvimos
manipulando al sistema durante todo el experimento.
Lo que si pudimos comprobar es que, visualizando los valores y la grfica del proceso, el
volumen es directamente proporcional a la temperatura pues entre ms aumentaba la
temperatura, el volumen tambin aumentaba con lo que podemos concluir que la Ley de
Charles s es vlida.
De igual manera, utilizando el modelo matemtico que obtuvimos a partir de nuestros
datos, calculamos el valor del cero absoluto de temperatura en grados Celsius. Obtuvimos
un valor muy cercano al valor terico (-273.15C), con un error porcentual del 4.946%,
este error se lo adjudicamos al hecho de que al manipular el sistema durante el proceso
ocasiona que sus variables se vean alteradas y no reflejen el comportamiento ideal del
proceso. Otra posible justificacin de haber obtenido dicho error es el hecho de que
durante la realizacin del experimento se nos apag el mechero inesperadamente lo que
quiz ocasion un ligero desfase en nuestras medidas.
8. CONCLUSIONES
Concluimos que la prctica fue de suma importancia para el aprendizaje ms propio de la
termodinmica y para el mayor enriquecimiento de la teora adquirida en el saln de
clases. Es interesante tambin ver la instrumentacin y poder manipularla, porque
igualmente nos lleva a visualizar las cosas de forma ms tangible.
Al final la prctica cumpli su propsito que era el hacernos visible la relacin
proporcional entre el volumen y la temperatura, y haber hecho tambin el intento de
calcular esta proporcionalidad nos hizo darnos cuenta de que no era solamente agua lo
que involucraba nuestro proceso, de modo que nos percatamos que nuestro proceso no
era cuasiesttico, y al final obtuvimos un cero absoluto con un error porcentual menor
al 5% .
Potrebbero piacerti anche
- Cuadernillo de Preguntas Saber 11 Ciencias NaturalesDocumento20 pagineCuadernillo de Preguntas Saber 11 Ciencias NaturalesNicanor VelasquezNessuna valutazione finora
- Contaminación atmosféricaPRESENTACIONDocumento22 pagineContaminación atmosféricaPRESENTACIONLeo AguilarNessuna valutazione finora
- Practica N 4Documento12 paginePractica N 4Milton Marquez Arancibia100% (1)
- Cómo Leer Los MapasDocumento31 pagineCómo Leer Los MapasLuis Segundo Chuello ChirinosNessuna valutazione finora
- Yandex, Navegador de RusiaDocumento5 pagineYandex, Navegador de RusiaLuis Alberto Andres BaltazarNessuna valutazione finora
- Campana de Gauss en ExcelDocumento7 pagineCampana de Gauss en ExcelLuis Alberto Andres BaltazarNessuna valutazione finora
- Ejemplo de Acuse de ReciboDocumento3 pagineEjemplo de Acuse de ReciboLuis Alberto Andres BaltazarNessuna valutazione finora
- Ley Del Mínimo EsfuerzoDocumento3 pagineLey Del Mínimo EsfuerzoLuis Alberto Andres BaltazarNessuna valutazione finora
- ¿Cuáles Son Las Propiedades Mecánicas de Los Sólidos - PDFDocumento3 pagine¿Cuáles Son Las Propiedades Mecánicas de Los Sólidos - PDFLuis Alberto Andres BaltazarNessuna valutazione finora
- Banda de Música - Wikipedia, La Enciclopedia Libre PDFDocumento4 pagineBanda de Música - Wikipedia, La Enciclopedia Libre PDFLuis Alberto Andres Baltazar100% (1)
- Inductancia MutuaDocumento4 pagineInductancia MutuaMelvin Brown100% (3)
- Practica Ley de Boyle Mariotte y Constante Particular Del AireDocumento11 paginePractica Ley de Boyle Mariotte y Constante Particular Del AireLuis Alberto Andres Baltazar50% (2)
- Previos2013 2Documento13 paginePrevios2013 2Vane MorquechoNessuna valutazione finora
- Tarea1 Electronica DigitalDocumento15 pagineTarea1 Electronica DigitaljavierNessuna valutazione finora
- Ejercicios IndustrialDocumento5 pagineEjercicios Industrialrent markNessuna valutazione finora
- Monografía de La OndaDocumento14 pagineMonografía de La OndaKevin Bruselas AuzaNessuna valutazione finora
- Elemento de Aritmética y Álgebra - Teoría de ConjuntosDocumento25 pagineElemento de Aritmética y Álgebra - Teoría de ConjuntosAngel Gustavo JuarezNessuna valutazione finora
- 2do Medio Contenido y Ejercitación Raices y RacionalizaciónDocumento4 pagine2do Medio Contenido y Ejercitación Raices y RacionalizaciónLeo BelloniNessuna valutazione finora
- Folleto de Ejercicios PDFDocumento16 pagineFolleto de Ejercicios PDFwakrer fsNessuna valutazione finora
- Documento Semana 4 (1) TEJIDO PLANODocumento12 pagineDocumento Semana 4 (1) TEJIDO PLANOHenry Javier GoyesNessuna valutazione finora
- Robots Educativos Expertos William Camilo - UnapecDocumento104 pagineRobots Educativos Expertos William Camilo - UnapecWilliam Rafael CamiloNessuna valutazione finora
- SilogismoDocumento11 pagineSilogismoCesar PalenciaNessuna valutazione finora
- 05 Ángulos Geometria Tercero de SecundariaDocumento11 pagine05 Ángulos Geometria Tercero de SecundariaElvis Mayk Aliaga Hinostroza100% (1)
- DECILES-PERCENTILES SLNDocumento3 pagineDECILES-PERCENTILES SLNOlga Patricia EcheverryNessuna valutazione finora
- Dibujar Un Cubo en Perspectiva OblicuaDocumento6 pagineDibujar Un Cubo en Perspectiva OblicuaSalvador ChilinNessuna valutazione finora
- Recuerda:: René Descartes (1596-1650)Documento38 pagineRecuerda:: René Descartes (1596-1650)Anthony V. MingaNessuna valutazione finora
- Sistemas Dinámicos y Campos Tracker - V5Documento25 pagineSistemas Dinámicos y Campos Tracker - V5alex morenoNessuna valutazione finora
- Geometría, Forma Y Orden Emergente en Arquitectura: Tesis DoctaDocumento256 pagineGeometría, Forma Y Orden Emergente en Arquitectura: Tesis DoctaCandela RodríguezNessuna valutazione finora
- Guía Semestral 2019-2 Mat IiiDocumento16 pagineGuía Semestral 2019-2 Mat IiiNallely GallardoNessuna valutazione finora
- Van TirDocumento6 pagineVan TirAurora Amarilla RamírezNessuna valutazione finora
- Software Fx-9860giiDocumento420 pagineSoftware Fx-9860giimandameloaNessuna valutazione finora
- Datos Identificadores Variables y ConstantesDocumento32 pagineDatos Identificadores Variables y ConstantesCristina Mayhuasca CrespoNessuna valutazione finora
- Prácticas Calculo Uno 1 2020Documento1 paginaPrácticas Calculo Uno 1 2020Diego Espinoza TorricoNessuna valutazione finora
- Regresion Lineal Simple .Documento22 pagineRegresion Lineal Simple .Mayela Torres ZarzosaNessuna valutazione finora
- Lista ConcurrenciaDocumento4 pagineLista ConcurrenciaErdwan MazariegoNessuna valutazione finora
- T MF R PDFDocumento8 pagineT MF R PDFAbraham BedranNessuna valutazione finora
- Difusión de Humedad en Estado ConstanteDocumento44 pagineDifusión de Humedad en Estado ConstanteDepino PalmaNessuna valutazione finora
- Problemas Complementarios PDFDocumento2 pagineProblemas Complementarios PDFMauricio AngaritaNessuna valutazione finora
- Índice Álgebra Tomo IDocumento1 paginaÍndice Álgebra Tomo IJoan FergusomNessuna valutazione finora