Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Técnica de Patch Clamping
Caricato da
Kenny676Titolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Técnica de Patch Clamping
Caricato da
Kenny676Copyright:
Formati disponibili
MTODO DE PATCH CLAMP
La introduccin de la tcnica de Patch clamp por Edwin Neher y Bert Sakamanna hizo posible el
estudio individual de canales ionicos en la membrana. Esta tcnica permitio resol ver la corriente
roducida por un solo canal y extendi su estudio a casi todo tipo de clula, sin importar sus
caractersticas geomtricas.
La tcnica de patch clamp se basa en la utilizacin de una pipeta de vidrio de borde muy liso con
una punta de entre 1 y 5 micrmetros de dimetro que forma un sello de muy alta resistencia con
la membrana aislando elctricamente el parche de membrana que se encuentra en la punta (la
pipeta se llena con una solucin que depende del estudio especfico o la tcnica de patch clamp
usada).
Diferentes modalidades de membrana.
Cuando la pipeta sella la membrana celular, constituye la modalidad sobre la celula (on-cell), o
cell attached [1], que es til para registrar corrientes unitarias de canales que dependen de
sustancias presentes en el citoplasma, como ATP, IP3, protenas G, etc. Est tcnica consiste en
acercar la punta de un electrodo de vidrio a la membrana celular y hacer un buen sello. En esta
configuracin se pretende registrar la corriente a travs de los canales situados dentro del
dimetro interno de la punta de la pipeta. Dependiendo del tamao de la pipeta y de la densidad de
canales en la mambrana unas veces habr un sol canal y tras veces varios. En realidad la tcnica de
patch-clamp se desarroll para hacer este tipo de registro y todas las dems modalidades partes
de esta posicin inicial.
Una vez hecho el sello, una succin corta pero brusca rompe el trozo de la membrana que est
debajo de la punta del electrodo, permitiendo as el acceso al interior celular. Eso permite registrar
la corriente inica que pasa a travs d toda la membrana y tambin fijar el voltaje de la misma al
valor deseado. Es el equivalente al registro intracelular y por lo tanto tambin permite estudiar el
potencial de reposo y los potenciales de accin. Esta es tal vez la modalidad ms ampliamente
utilizada en el estudio de las clulas endocrinas. Esta modalidad de clula entera (whole cell)
[2], permite registrar todos los canales de la membrana plasmtica.
A partir de esta modalidad de clula entera se puede pasar a la modalidad de membrana
invertida (outside out) [3], con la cara externa de la membrana orientada hacia el medio que
rodea la pipeta, tiene la ventaja sobre la clula, en que el voltaje transmembral se puede
controlar con precisin, as como las condiciones inica del medio en contacto con amas caras del
parche de membrana.
Una ltima modalidad para registrar canal unitario se logra partiendo de sobre la clula,
retirando gradualmente la pipeta hasta quedar con el parche orientado con el lado citoplasmtico
hacia el medio, esta configuracin de membrana orientada, o inside out [4], es til para ensayar
sustancias que actan sobre canales desde la parte interna.
1
3 4
2
Disposicin experimental bsica para medir el flujo de
corriente a travs de canales inico individuales en la
membrana plasmtica de una clula viva. El electrodo
parche, lleno con una solucin salina conductora de
corriente, se aplica con una succin leve, a la membrana
plasmtica. La punta de 0.5 m de dimetro cubre una
regin que contiene solo uno o algunos canales inicos. El
segundo electrodo se inserta a travs de la membrana en el
citosol. Un dispositivo de registro mide el flujo de corriente
solo a travs de canales de la porcin de membrana
plasmtica (parche).
Como conclusin y para finalizar, la tcnica de patch-clamp permite a los investigadores la
apertura, el cierre, la regulacin y la conductancia inica de un nico canal inico, en esta tcnica,
el movimiento de iones hacia adentro o hacia afuera a travs de una porcin pequea de
membrana se cuantifica a partir de la cantidad de corriente elctrica necesaria para mantener el
potencial de la membrana a un valor fijado (con grapas) y particular. Para preservar la
electroneutralidad y mantener constante el potencial de la membrana, la entrada de cada ion
positivo (p. ej., un ion de Na+) en una clula a travs de un calan en el parche de membrana es
balanceada por la adicin de un electro al citosol a travs de un microelectrodo insertado en el
citosol; un aparato electrnico mide el nmero de electrones (corriente) requerido para
contrabalancear la entrada de iones a travs de los canales de membrana. A la inversa, la salida d
cada ion positivo de la clula (p. ej., un ion de K+) es balanceada por la extraccin de un electrn
del citosol la tcnica del patch-clamp puede emplearse sobre clulas enteras o porciones de
membrana asiladas para medir los efectos de diferentes sustancias y concentraciones inicas
sobre el flujo de iones.
BILIOGRAFIA:
Curtis. Biologa, Helena Curtis, Adriana Schnek, Septima edicin, Editorial medica panamericana,
pag. 234, captulo 3.
Biologia Celular Y Molecular, Jimenez, Pag, 184-185, Parte II
Biologa celular y molecular, Lodish, Berk, Kaiser, 5ta edicin, Editorial medica panamericana, Pag.
265, Cap. 7
Endocrinologa, Vctor M. Arce, Pablo F. Catalina, Federico Mallo, Pag. 397
Paginas Consultadas:
http://hebb.mit.edu/courses/8.515/lecture1/sld026.htm
La figura muestra una fotomicrografa
en la que se aprecia la pipeta apoyada
sobre la membrana plasmtica de una
clula donde puede observarse un
canal inico.
FOSFATO DE PIRIDOXAL
Las transaminasas o aminotranferasas son enzimas que catalizan la trasferencia de un grupo -
amino desde un -aminocido a un -cetocido. En muchos casos el -cetocido es el -
cetoglutarato (KG), que se transforma en glutamato simultneamente a la formacin de -
cetocido del -aminocido dador del grupo -amino. De esta forma, mediante la formacin de
glutamato a partir de -cetoglutarato se elimina el grupo -amino de muchos aminocidos.
Entre las trasaminasas, una de las ms importantes es la aspartato transaminasa (AST); que
cataliza la trasferencia del grupo -amino del aspartato al -cetoglutarato:
Aspartato + -cetoglutarao Oxalacetato +Glutamato
Otra transaminasa importante es la alanina aminotranferasa (ALT), que cataliza la transferencia
del grupo -amino de la alanina al -cetoglutarato
Alanina + -cetoglutarato Piruvato + Glutamato
En general una reaccin de transaminacin sigue el siguiente esquema:
El mecanismo cataltico de la transaminasas incluye la formacin de bases de Schiff intermediaras
debido a la participacin del grupo prosttico de estas enzimas, el piridoxal fosfato (PLP). El
piridoxal fosfato procede de la vitamina B6 o piridoxina, y en el curso de la reaccin se transforma
en piridoxamina fosfato:
El PLP a travs de su grupo aldehdo est unido en forma de base de Schiff inicialmente a la
transaminasa a travs del grupo -amino de un Lys especifica del centro activo (aldimina interna).
En presencia de un aminocido, que es el sustrato del enzima, el grupo -amino del mismo
desplaza al -amino de la Lys, formndose una unin por base de Schiff con el aminocido
(aldimina externa), que permanece unida al enzima por enlaces no covalentes. Esta aldimina
externa, tras una desprotonacin, seguida de una reprotonacin y posterior hidrlisis, genera un
-cetocido y piridoxamina fosfato:
La segunda etapa de la reaccin es justo el proceso contrario al descrito. Un segundo -cetocido
reacciona con la piridoxamina fosfato unida a la transaminasa, liberndose un segundo
aminocido y regenerndose el complejo transaminasa-PLP:
-
+ E-PMP
+ E-PLP
La reaccin catalizada por las transaminasas es completamente reversible. El glutamato producido
en las reacciones de transaminacin puede sufrir una desaminacin oxidativa, catalizada por la
glutamato deshidrogenasa, formndose ion amonio (NH
4
+
):
Esta reaccin se produce en ambos sentidos. En la reaccin de degradacin, en la que se libera
amonio, se utiliza NAD+, mientras que en la sntesis participa NADP+. Lo ms probable es que in
vivo la reaccin se produzca en la direccin de produccin de amonio. La glutamato
deshidrogenasa, que en los vertebrados est constituida por seis subunidades idnticas, est
regulada alostricamente por ncleotidos purnicos. La degradacin del glutamato para forma
amonio se favorece por ADP y GDP, indicadores de una carga energtica celular baja, y por tanto
de una necesidad d obtener energa por oxidacin de aminocidos. Por el contrario, cuando la
carga energtica es alta, abundan ATP y GTP, estos actan como activadores alostricos para la
sntesis de glutamato.
Si se consideran conjuntamente las reacciones catalizadas por las transaminasas y por la
glutamato deshidrogenasa, se observa la produccin de amonio libre, que en la mayora de los
vertebrados terrestres se convierte en urea en el hgado, y es excretada por el rin.
Los -cetocidos resultantes de la transaminacin son degradados hasta intermediarios
metablicos, los cuales pueden utilizarse en la biosntesis de cidos grasos, cuerpos cetnicos y
glucosa.
Bibliografa:
Fundamentos de Bioqumica Meteabolica, Garrido, Tejon, Blanco, Editorial Tbar, Capitulo 14,
Paginas 165-168
INSTITUTO TECNOLGICO DE CELAYA
INGENIERA BIOQUMICA
Nombre de la materia: Bioqumica del nitrgeno
y regulacin gentica
Nombre del profesor: Ramn Gerardo Guevara
Gonzlez
Nombre del alumno: Diana Laura Santos Valente
Trabajo:
Degradacin de aminocidos
Mtodo de Patch Clamp
Fosfato de Piridoxal
Fecha: Lunes 1 de septiembre del 2014
Potrebbero piacerti anche
- Elementos Basicos de CitologiaDocumento12 pagineElementos Basicos de CitologiaKakb Estudios100% (1)
- Significado Psicoanalitico Tatuajes y PiercingsDocumento2 pagineSignificado Psicoanalitico Tatuajes y PiercingsDresan PezloNessuna valutazione finora
- Denticion PrenatalDocumento45 pagineDenticion PrenatalJosephDelgadoDelgado0% (2)
- Trauma de TóraxDocumento31 pagineTrauma de TóraxPamela Bahamondes Manosalva100% (1)
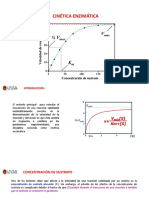
- Tema 8 - Cinetica Enzimatica Farmacia PDFDocumento12 pagineTema 8 - Cinetica Enzimatica Farmacia PDFMariciell Larissa Gonzales TiconaNessuna valutazione finora
- ECOEDocumento4 pagineECOEKarlos Asto Altamirano100% (3)
- 2022 Manual Manejo ClinicoDocumento221 pagine2022 Manual Manejo ClinicoPriscilla PaivaNessuna valutazione finora
- Tubo digestivo IIDocumento9 pagineTubo digestivo IIRegina Cortés100% (1)
- PH PracticaDocumento9 paginePH PracticaeuclidesraulNessuna valutazione finora
- Aspiración de Secreciones Con Circuito Cerrado y Manejo de Dispositivos en Via AereaDocumento42 pagineAspiración de Secreciones Con Circuito Cerrado y Manejo de Dispositivos en Via Aerearepre6467% (3)
- Counselling Con Adolescentes Mejor Con La FamiliaDocumento122 pagineCounselling Con Adolescentes Mejor Con La Familiajeraldinegaray100% (1)
- AntihemorrágicosDocumento21 pagineAntihemorrágicoskprh311100% (7)
- Fármacos cardiológicos: inotrópicos, cronotrópicos, dromotrópicos y batmotrópicosDocumento2 pagineFármacos cardiológicos: inotrópicos, cronotrópicos, dromotrópicos y batmotrópicosalexander puma sacsahuillca100% (2)
- Técnica Patch ClampDocumento3 pagineTécnica Patch ClampAlejandroHidalgoNavaNessuna valutazione finora
- Neurociencias Clase I Neuronas Circuitos Neuronales y ConductaDocumento19 pagineNeurociencias Clase I Neuronas Circuitos Neuronales y ConductaMacarena CepedaNessuna valutazione finora
- Resumen Neurobiología FINALDocumento98 pagineResumen Neurobiología FINALCynthia ScottiNessuna valutazione finora
- Permeabilidad de La Membrana CelularDocumento5 paginePermeabilidad de La Membrana CelularCamila ContrerasNessuna valutazione finora
- Presentacion 6 Cinetica EnzimaticaDocumento46 paginePresentacion 6 Cinetica EnzimaticaE Clinton LMNessuna valutazione finora
- Trabajo Potencia y Energia Aplicado A La SaludDocumento24 pagineTrabajo Potencia y Energia Aplicado A La Saludashli trujillo0% (1)
- Gradiente ElectroquímicoDocumento3 pagineGradiente ElectroquímicoGeralNessuna valutazione finora
- Metabolismo Intermediario y AnabolismoDocumento8 pagineMetabolismo Intermediario y AnabolismoAmyEBermudezQuero0% (1)
- La Célula AnimalDocumento4 pagineLa Célula AnimalSERGIO MENA PEREZ ESTUDIANTE ACTIVONessuna valutazione finora
- Gradiente electroquímico y fuerza protón-motrizDocumento4 pagineGradiente electroquímico y fuerza protón-motrizRenzzo B NamucheNessuna valutazione finora
- Informe de Aminoácidos - Grupo 9Documento9 pagineInforme de Aminoácidos - Grupo 9Jonathan Andres Ortiz ForeroNessuna valutazione finora
- Ejercicio 1 EnzimologiaDocumento15 pagineEjercicio 1 EnzimologiaAndrea ChavarroNessuna valutazione finora
- Fuerza Iónica y CoeficienteDocumento12 pagineFuerza Iónica y CoeficienteMaria Angelica Oviedo TorresNessuna valutazione finora
- Fermentacion 3Documento10 pagineFermentacion 3rocioNessuna valutazione finora
- Informe EquilibrioDocumento13 pagineInforme EquilibrioEstefany Duran LondoñoNessuna valutazione finora
- Contracción Del Musculo Liso - FisiologíaDocumento5 pagineContracción Del Musculo Liso - FisiologíaDara DosNessuna valutazione finora
- Aspectos Biologicos de Gracilaria ChilensisDocumento5 pagineAspectos Biologicos de Gracilaria Chilensisemilymr3Nessuna valutazione finora
- Taller Señalización CelularDocumento5 pagineTaller Señalización CelularROXY FERNANDA RODRÍGUEZ TORRESNessuna valutazione finora
- Examen 3 MicrobiologiaDocumento41 pagineExamen 3 Microbiologiaapi-3806615100% (1)
- Purificación y caracterización de una lectina de habas mediante cromatografía y ensayos de actividad hemaglutinanteDocumento8 paginePurificación y caracterización de una lectina de habas mediante cromatografía y ensayos de actividad hemaglutinanteCesarNessuna valutazione finora
- Fundamentos de La TermodinamicaDocumento6 pagineFundamentos de La TermodinamicaAriane A Martinez RNessuna valutazione finora
- Informe 3 - Actividad EnzimáticaDocumento12 pagineInforme 3 - Actividad EnzimáticaAndrea SalinasNessuna valutazione finora
- Enzimas ResumenDocumento8 pagineEnzimas ResumenJuán Gabriel Gallego LópezNessuna valutazione finora
- GlucosaDocumento5 pagineGlucosalupemargaritaNessuna valutazione finora
- Pro ProteinasDocumento1 paginaPro ProteinasSosimo BenitezNessuna valutazione finora
- Niveles organización SN aprendizaje AplysiaDocumento3 pagineNiveles organización SN aprendizaje AplysiaAndreBelenNessuna valutazione finora
- Practica 3 Corregida Utp Glucolisis AnaerobiaDocumento6 paginePractica 3 Corregida Utp Glucolisis AnaerobiaJessica Valentina Zarama BuriticaNessuna valutazione finora
- La Molécula IntermediariaDocumento3 pagineLa Molécula IntermediariaGarcia Jonnattan0% (1)
- Metabolismo de CarboidratosDocumento23 pagineMetabolismo de CarboidratosVerónica VelásquezNessuna valutazione finora
- EnzimasDocumento23 pagineEnzimasMaruby MontonerNessuna valutazione finora
- Fisica BioelectricidadDocumento18 pagineFisica BioelectricidadKaren Ramirez100% (1)
- Autoevaluación 2.1 - Respiración Celular Biología UesDocumento3 pagineAutoevaluación 2.1 - Respiración Celular Biología UesMayra Marroquin50% (2)
- La EntalpíaDocumento6 pagineLa EntalpíaStefaniaNessuna valutazione finora
- Factores Que Inhiben La MitosisDocumento3 pagineFactores Que Inhiben La MitosisDavis AvilbarNessuna valutazione finora
- Mecanismos de Regulación EnzimáticaDocumento2 pagineMecanismos de Regulación EnzimáticaRobert Isaias Mendoza CardenasNessuna valutazione finora
- Guia 5. Actividad Enzimática UreasaDocumento8 pagineGuia 5. Actividad Enzimática UreasaAnderson Murcia PolaniaNessuna valutazione finora
- Tema 4. Tejido Parenquimático y MecánicoDocumento24 pagineTema 4. Tejido Parenquimático y MecánicoChristopher SilvaNessuna valutazione finora
- Transpiracion 06 PDFDocumento9 pagineTranspiracion 06 PDFJeanKeinerWyLopezNessuna valutazione finora
- Reporte p.4 FisioDocumento13 pagineReporte p.4 FisioSeccion 1, Reyes Sánchez Zuleima GuadalupeNessuna valutazione finora
- OriginalDocumento42 pagineOriginalCarlenis RamosNessuna valutazione finora
- Tema 2 - PROTEÍNASDocumento39 pagineTema 2 - PROTEÍNASJose Esteban De Haro MartinezNessuna valutazione finora
- Blanco. Cap 3. ProteinasDocumento36 pagineBlanco. Cap 3. ProteinasAldo CruzNessuna valutazione finora
- Cambios térmicos de un sistema: primeras leyes de la termodinámicaDocumento14 pagineCambios térmicos de un sistema: primeras leyes de la termodinámicablink42j0% (1)
- Tarea Escrita - Cruzamiento PruebaDocumento1 paginaTarea Escrita - Cruzamiento PruebaAna Victoria Ramírez IriarteNessuna valutazione finora
- Clase 4 - Regulación Actividad EnzimáticaDocumento7 pagineClase 4 - Regulación Actividad EnzimáticaanaNessuna valutazione finora
- Tabla Procesos MetabolicosDocumento10 pagineTabla Procesos MetabolicosValeria EnriquezNessuna valutazione finora
- Taller ProteínasDocumento5 pagineTaller ProteínasDiego RodriguezNessuna valutazione finora
- Fenómenos InterfacialesDocumento28 pagineFenómenos InterfacialesFernando100% (1)
- Manual FQF Practicas de LaboratorioDocumento78 pagineManual FQF Practicas de LaboratorioLuis Huante de PerafanNessuna valutazione finora
- Termogenesis y ObesidadDocumento12 pagineTermogenesis y ObesidadGerald ToroNessuna valutazione finora
- Sistema Nervioso de Los MamíferosDocumento5 pagineSistema Nervioso de Los MamíferosEliana PérezNessuna valutazione finora
- Señalización celular: tipos de señales y receptores enDocumento22 pagineSeñalización celular: tipos de señales y receptores enAndrésNessuna valutazione finora
- TEMA 47 Elongación Ácidos GrasosDocumento3 pagineTEMA 47 Elongación Ácidos GrasosAkimita88% (8)
- Potencial de Difusion y Potencial de LesionDocumento13 paginePotencial de Difusion y Potencial de LesionLatika CzNessuna valutazione finora
- Citoesqueleto-ActinaMicrotúbulosFilamentosDocumento46 pagineCitoesqueleto-ActinaMicrotúbulosFilamentosLeslie Zavaleta Bazan0% (1)
- Practica # 1de Botánica: Células VegetalesDocumento4 paginePractica # 1de Botánica: Células VegetalesBorreSugar100% (2)
- Patch ClampDocumento6 paginePatch ClampDaniela MonroyNessuna valutazione finora
- Complejo Del Poro NuclearDocumento11 pagineComplejo Del Poro NuclearElvisRojas972010Nessuna valutazione finora
- Quistes odontogénicos: clasificación, características y tratamientoDocumento7 pagineQuistes odontogénicos: clasificación, características y tratamientoGabyAvillasanteNessuna valutazione finora
- Disfunciones Del Aparato LocomotorDocumento7 pagineDisfunciones Del Aparato LocomotorCarlos CardonaNessuna valutazione finora
- Evaluacion Recuperatoria Piel AnimalDocumento2 pagineEvaluacion Recuperatoria Piel AnimalLina Luz Perez MedranoNessuna valutazione finora
- Enfermedades-Respiratorias Medicina 3Documento37 pagineEnfermedades-Respiratorias Medicina 3Ann' KateeNessuna valutazione finora
- Auscultación AngheloDocumento30 pagineAuscultación AngheloAnghelo Figueroa BustamanteNessuna valutazione finora
- Nutricion para DeportistasDocumento64 pagineNutricion para DeportistasValeria Duque GomezNessuna valutazione finora
- Alimentos de Origen Anima1Documento2 pagineAlimentos de Origen Anima1Jhonatan Vilela TinedoNessuna valutazione finora
- Taller de MusculosDocumento12 pagineTaller de MusculoslinaNessuna valutazione finora
- Sistema Respiratorio AvesDocumento1 paginaSistema Respiratorio Aves- r e d s u n -Nessuna valutazione finora
- Mary Bella AlavDocumento3 pagineMary Bella AlavoscarNessuna valutazione finora
- Apoptosis - Dra. Rina ZumaetaDocumento18 pagineApoptosis - Dra. Rina ZumaetaJuan VasquezNessuna valutazione finora
- La Fisiología Del AdultoDocumento3 pagineLa Fisiología Del AdultoMayhuiri FredNessuna valutazione finora
- 2° S.Nervioso 4 AnatomiaDocumento1 pagina2° S.Nervioso 4 Anatomiafabian alejandro santana leivaNessuna valutazione finora
- Informe 1Documento6 pagineInforme 1maugarage01Nessuna valutazione finora
- Transfusiones Sanguíneas EnfermeríaDocumento68 pagineTransfusiones Sanguíneas EnfermeríaJohnCardona50% (2)
- PPR Informwe FinalDocumento68 paginePPR Informwe FinalWilly Cabana PizarroNessuna valutazione finora
- Guía Mamíferos 2023Documento11 pagineGuía Mamíferos 2023leapopNessuna valutazione finora
- Diferenciacion Celular BiologiaDocumento12 pagineDiferenciacion Celular BiologiaMegevi GeldresNessuna valutazione finora
- 211 EBAU2020-JULIO-BIOLOGIA Examen y CriteriosDocumento6 pagine211 EBAU2020-JULIO-BIOLOGIA Examen y CriteriosSergio PootNessuna valutazione finora