Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
O modelo atômico de Rutherford e a descoberta do núcleo atômico
Caricato da
fabianammbarbosaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
O modelo atômico de Rutherford e a descoberta do núcleo atômico
Caricato da
fabianammbarbosaCopyright:
Formati disponibili
1) Por que Rutherford concluiu que a carga positiva deve estar concentrada em
um ncleo muito denso do dentro do tomo
Partculas pesadas e positivas conhecidas como partculas alfa foram aceleradas
contra uma finssima lmina de ouro. O fato, que a grande maioria das partculas alfa
havia atravessado a lmina sem desvios, como era esperado que ocorresse com todas.
Mas, cerca de uma em cada 20 000 partculas tinham sido ricocheteadas. Rutherford ento
retomou a ideia do fsico japons H. Nagaoka, que dizia que um tomo poderia ser
composto por um pequeno ncleo carregado positivamente e rodeado por uma regio
comparativamente maior, contendo eltrons. Por esse modelo, o tomo teria um centro
denso e positivo; os eltrons orbitariam ao seu redor. Assim, de acordo com Rutherford, o
tomo de ouro no macio, nele h grandes espaos vazios, por onde passaram, sem
apresentar praticamente nenhum desvio, as partculas alfa. Foi observado tambm que
algumas partculas alfa foram rebatidas pela fina folha de ouro porque se chocaram com
regies do tomo de ouro mais pesadas que elas e de carga tambm positiva o
ricocheteio teria ocorrido tambm por repulso eltrica. Rutherford concluiu ento, que a
carga positiva do tomo no estava distribuda por todo o tomo, como acreditava
Thomsom, mas concentrada em uma regio central, um ncleo macio e responsvel pela
quase totalidade da massa do tomo, e milhares de vezes menor que a regio que o cerca,
a eletrosfera.
2) Ambas com distncia de 1,6x10
-7
a) Qual tem maior frequncia: A onda da esquerda(a) possui maior comprimento, ou seja,
maior distncia entre os picos. Quanto maior o comprimento da onda menor ser sua
frequncia. Sendo assim, a onda da esquerda (a) tem frequncia menor e a da direita (b)
possui frequncia maior.
b) Se uma representa a luz visvel e a outra representa infravermelho qual uma e qual
outra: O espectro eletromagntico indica que a radiao infravermelho, tem comprimento
de onda mais longo que a luz visvel. Logo, a onda da direita(b) seria a de radiao
infravermelho.
c) Qual o comprimento de onda A e B
=C/
I) a=
II) b=
d) Qual a frequncia da onda A e B
= C/
I) a=
II)b
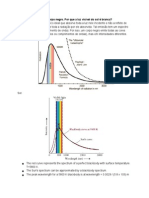
3) Por que um corpo negro quando aquecido no emite radiao contnua. Como o
efeito fotoeltrico pode explicar a questo do corpo negro Um Corpo Negro (Um
corpo que absorve toda a radiao que nele incide: nenhuma luz o atravessa nem
refletida), Planck considerou a existncia, na superfcie do Corpo Negro, de cargas
eltricas oscilantes que emitem uma energia radiante no de modo contnuo, mas sim em
pores descontnuas, teoricamente so partculas que transportam cada uma, uma
quantidade de energia 'E' bem definida. Essas partculas so chamadas de Ftons. A
energia 'E' de cada Fton chamada de Quntum (ou Quanta). O Quantum 'E' da
energia radiante da frequncia 'f' dado por: E =h.f, em que 'h' a constante de Planck (h
= 6,63.10^-34 J.s)
No efeito fotoeltrico, segundo a proposta de Einstein, vrios ftons podem
transferir toda a energia que tm para um eltron do metal, livrando-o da sua ligao com
ele. Esses eltrons compem a chamada corrente fotoeltrica com estas caractersticas
experimentalmente observadas. Com esta proposta Einstein "quantizou" a onda
eletromagntica, de uma forma mais geral do que j havia sido feito por Planck.
4) O que um espectro de linhas. Em que se difere do contnuo. Do ponto de vista
da estrutura atmica qual a importncia do espectro de linhas.
Os espectros de linhas so-nos dado por todas as substncias que se encontram
no estado gasoso atmico (mas no molecular). Neste caso, a luz irradiada pelos tomos
que, praticamente, no interatuam. Os tomos isolados de um dado elemento qumico
irradiam ondas de comprimentos rigorosamente determinados, diferido do espectro
contnuo que possuem todos os comprimentos de onda. Os valores encontrados no
espectro de linhas servem para saber qual tomo estamos observando, como uma
impresso digital.
5) Descreva o modelo atmico de Bohr. Por que sua teoria foi abandonada. Que
evidncia inicial indicava que a teoria de Bohr poderia estar correta? Niels Bohr criou
um modelo atmico no qual os eltrons ligados ao ncleo s poderiam se apresentar em
determinados estados quantizados de energia. Segundo o modelo de Bohr, os eltrons de
um tomo, submetidos ao da fora atrativa de Coulomb exercida pelo ncleo, movem-
se em torno dele em rbitas semelhantes s dos planetas em torno do Sol, mas sem emitir
radiaes, como acreditava Maxwell. Alm disso, existem duas condies limitativas:
Um eltron no pode percorrer em torno do ncleo uma rbita qualquer, mas
apenas determinadas rbitas. Quando o eltron se encontra numa dessas rbitas, o
tomo apresenta uma energia bem definida; - Em cada rbita, podem se mover no
mximo dois eltrons (princpio da excluso).
Embora atrativa em muitos aspectos, a teoria de Bohr inadequada para explicar
satisfatoriamente o espectro de alguns elementos polieletrnicos alm do hidrognio, alm
de no explicar como os eltrons sofrem difrao, pois, segundo Einstein a luz pode se
comportar como partcula , e segundo Broglie partculas podem se comportar como onda.
O conceito de quantizao de energia eletrnica de Bohr ainda considerado
essencialmente correto embora suas ideias sobre orbitais no o sejam.
6) O que significa estado fundamental de um tomo
Um tomo diz-se no estado fundamental quando a sua distribuio eletrnica
caracterizada pelo fato de os seus eltrons ocuparem os menores valores possveis de
energia (obviamente dentro da gama de estados possveis definidos pelos nveis e
subnveis permitidos). Tal regra , por vezes, referida como princpio da energia mnima.
Se sua energia aumenta, ele passa a um de seus vrios estados excitados, que
correspondem a nveis de energia mais elevados.
7) Qual a principal diferena entre uma orbita e um orbital de Bohr? De que maneira
o principio de Heisenberg est envolvido nesta comparao.Enquanto rbita indica
uma trajetria regular do eltron em torno do ncleo, orbital indica uma regio do espao
onde h grande probabilidade de encontrarmos um eltron. O eltron no modelo de
Rutherford-Bohr era uma partcula, enquanto a mecnica quntica define o eltron pelo
princpio da dualidade onda-partcula. Ou seja, ele pode ser tanto uma coisa quanto a
outra. O Princpio da Incerteza de Heisenberg afirma que alm de o eltron no ser apenas
uma partcula, seu comportamento no obedece ao determinismo da fsica clssica. Assim,
no possvel precisar simultaneamente a velocidade e a posio de um eltron. Seu
estudo s pode ser feito por uma abordagem probabilstica. Por este motivo, buscou-se,
ento, trabalhar com a provvel regio onde possvel encontr-lo. Essa regio ficou
conhecida como nuvens eletrnica ou orbital.
8) A partir de quais estudos se deu incio a mecnica quntica. Qual a contribuio
da equao se Schrondinger para explicar essa questo No sculo XIX a fsica
clssica no explicava a catstrofe ultravioleta. Qualquer corpo negro a temperatura
diferente de zero emitiria radiao ultravioleta intensa. Ento atravs dos estudos do
chamado efeito fotoeltrico, que trata da emisso de eltron por um metal que recebe
radiao luminosa; a radiao emitida por tomos de hidrognio, conhecida como
radiao espectral do hidrognio que continha algumas poucas frequncias bem
definidas, e a distribuio da quantidade de radiao de diferentes frequncias emitida por
um corpo em equilbrio trmico, chamada de radiao de corpo negro, deram-se incio
aos estudos da mecnica quntica. Erwin Schrdinger baseado no Princpio da Incerteza
de Heisenberg e no Princpio da Dualidade da matria de Louis de Broglie. Buscou, ento,
trabalhar com a provvel regio onde possvel encontrar um eltron. Aplicando a
equao de Schrdinger ao tomo de hidrognio, obtm-se diversas solues possveis.
Cada soluo possvel da equao de onda denominada orbital, que a regio onde
mais provvel encontrar um eltron. Quando a equao resolvida para uma partcula que
est confinada a uma regio pequena do espao ou est ligada a um centro atrativo, igual
um eltron em um tomo, solues aceitveis podem ser obtidas somente para
determinadas energias. Falamos de energia como sendo quantizada, significando que est
confinada a valores discretos.
.
Potrebbero piacerti anche
- Os Primeiros Modelos AtômicosDocumento5 pagineOs Primeiros Modelos AtômicosEraclitoSL100% (3)
- Modelo atômico de Bohr e quantização da energiaDocumento26 pagineModelo atômico de Bohr e quantização da energiaSem futuro animeNessuna valutazione finora
- Modelo de DemócritoDocumento49 pagineModelo de DemócritoMichele Leite100% (1)
- ATOMÍSTICADocumento52 pagineATOMÍSTICARaquel DiasNessuna valutazione finora
- Sebenta Quimica Geral FfulDocumento60 pagineSebenta Quimica Geral FfulFrancisco CarvalhoNessuna valutazione finora
- Química Geral: Modelos Atómicos e Números QuânticosDocumento60 pagineQuímica Geral: Modelos Atómicos e Números QuânticosBwiiaNessuna valutazione finora
- A Física do século XX e as duas pequenas nuvensDocumento30 pagineA Física do século XX e as duas pequenas nuvenstjmigoto@hotmail.comNessuna valutazione finora
- Modelo atômico de Bohr na prova de Química GeralDocumento10 pagineModelo atômico de Bohr na prova de Química GeralMaria Eduarda CoelhoNessuna valutazione finora
- Lista - Teoria AtômicaDocumento7 pagineLista - Teoria Atômicagiovana alvesNessuna valutazione finora
- Evolução dos Modelos AtômicosDocumento11 pagineEvolução dos Modelos AtômicosJosé Augusto Dos SantosNessuna valutazione finora
- Ttiv 1 1Documento20 pagineTtiv 1 1Mário RondinhoNessuna valutazione finora
- Fisica Sec XXDocumento30 pagineFisica Sec XXLuiz Gabriel Brésio De LimaNessuna valutazione finora
- Fundamentos Do Modelo Atômico AtualDocumento4 pagineFundamentos Do Modelo Atômico AtualClaudio BariquelloNessuna valutazione finora
- Evolução dos Modelos AtômicosDocumento18 pagineEvolução dos Modelos AtômicosThiago SantosNessuna valutazione finora
- Modelos Atômicos e Estrutura Da MatériaDocumento53 pagineModelos Atômicos e Estrutura Da MatériaCamila Paiva100% (1)
- Estrutura Atômica 1Documento2 pagineEstrutura Atômica 1Lúcia Silva PradoNessuna valutazione finora
- Quântica - Lista 1Documento3 pagineQuântica - Lista 1Kelly Oliveira de SouzaNessuna valutazione finora
- Física PPT - Século XXDocumento30 pagineFísica PPT - Século XXFísica PPT100% (2)
- Evolução dos Modelos AtômicosDocumento2 pagineEvolução dos Modelos AtômicosYuri AlvesNessuna valutazione finora
- Apostila 2º SemanaDocumento3 pagineApostila 2º SemanaJoseph DastóriaNessuna valutazione finora
- Modelos atômicos de Dalton, Thomson, Rutherford e BohrDocumento2 pagineModelos atômicos de Dalton, Thomson, Rutherford e BohrCatharina PariceNessuna valutazione finora
- Aula 4Documento22 pagineAula 4ronneiafonsoNessuna valutazione finora
- Mátéria 3ºano - 3ºbimestreDocumento9 pagineMátéria 3ºano - 3ºbimestreTalita RizzoNessuna valutazione finora
- Estrutura Atômica PDFDocumento2 pagineEstrutura Atômica PDFcajungarcia50% (2)
- Estrutura Atômica e DistribuiçãoDocumento2 pagineEstrutura Atômica e Distribuiçãoluluzinha_rj100% (2)
- Livro 1Documento21 pagineLivro 1Quézia Soares de PaulaNessuna valutazione finora
- Modelos Del ÁtomoDocumento35 pagineModelos Del ÁtomoMango lavoNessuna valutazione finora
- Exercícios de Mecânica Quântica sobre Átomos de HidrogênioDocumento7 pagineExercícios de Mecânica Quântica sobre Átomos de Hidrogêniodario frota0% (1)
- Capítulo 1 FANDocumento12 pagineCapítulo 1 FANmeujael28Nessuna valutazione finora
- VOD Química Evolução Dos Modelos Atômicos 2024Documento16 pagineVOD Química Evolução Dos Modelos Atômicos 2024Ana Beatriz EliasNessuna valutazione finora
- ESQUEMADocumento15 pagineESQUEMAZeferino ReisNessuna valutazione finora
- Relatório Transição Eletrônica e CoresDocumento4 pagineRelatório Transição Eletrônica e CoresFelippe NevesNessuna valutazione finora
- INTRODUÇÃO À FÍSICA MODERNADocumento36 pagineINTRODUÇÃO À FÍSICA MODERNAMarcos Vinicius Dos SantosNessuna valutazione finora
- Lista 2Documento5 pagineLista 2Nicolas TovaniNessuna valutazione finora
- Química Geral I - Estrutura EletrônicaDocumento65 pagineQuímica Geral I - Estrutura EletrônicaMarina AlvesNessuna valutazione finora
- QMC5138 - Aula 01Documento38 pagineQMC5138 - Aula 01Vinicius Marcos FigueiredoNessuna valutazione finora
- Quimica Geral - ResumoDocumento5 pagineQuimica Geral - ResumoAndrew GamaNessuna valutazione finora
- Corpo negro, efeito fotoelétrico e quantização da energiaDocumento8 pagineCorpo negro, efeito fotoelétrico e quantização da energiaroger_meloNessuna valutazione finora
- Trabalho Química Geral - Evolução Dos Modelos AtômicosDocumento11 pagineTrabalho Química Geral - Evolução Dos Modelos AtômicosCarlos FerreiraNessuna valutazione finora
- Resumo de Química Geral IDocumento20 pagineResumo de Química Geral IAna Paula Do NascimentoNessuna valutazione finora
- 1 Série Química TRILHA Semana14Documento1 pagina1 Série Química TRILHA Semana14Juvenal S. PereiraNessuna valutazione finora
- História dos Modelos Atômicos desde a Antiguidade até o Modelo QuânticoDocumento16 pagineHistória dos Modelos Atômicos desde a Antiguidade até o Modelo QuânticoFilipe VenceslauNessuna valutazione finora
- Evolução dos Modelos AtómicosDocumento8 pagineEvolução dos Modelos AtómicosAntonio ErinaldoNessuna valutazione finora
- Aula 1 - Teoria Atômica - 2Documento26 pagineAula 1 - Teoria Atômica - 2Luis Gustavo FariaNessuna valutazione finora
- Modelos AtômicosDocumento76 pagineModelos AtômicosBreno Monteiro Dos Santos100% (1)
- Química Geral - FFULDocumento60 pagineQuímica Geral - FFULJoana Catarina AndradeNessuna valutazione finora
- Átomos: descobertas históricasDocumento51 pagineÁtomos: descobertas históricasClaudio SergioNessuna valutazione finora
- Química: Prof DR Silvia Vaz Guerra NistaDocumento69 pagineQuímica: Prof DR Silvia Vaz Guerra NistaJean CarlosNessuna valutazione finora
- Modelos Atomicos 1 AnoDocumento23 pagineModelos Atomicos 1 AnoAndré PortugalNessuna valutazione finora
- Evolução Dos Modelos AtômicosDocumento41 pagineEvolução Dos Modelos Atômicosthalescristiano756Nessuna valutazione finora
- O que explica as cores dos sóisDocumento38 pagineO que explica as cores dos sóisAnna Paulap PereiraNessuna valutazione finora
- 4 - Lista 2 - Teoria Atômica PDFDocumento2 pagine4 - Lista 2 - Teoria Atômica PDFBeatriz BragaNessuna valutazione finora
- A estrutura do átomo: partículas subatômicasDocumento31 pagineA estrutura do átomo: partículas subatômicasraphael12stringsNessuna valutazione finora
- Modelo atômico de BohrDocumento7 pagineModelo atômico de BohrRui Jorge AbreuNessuna valutazione finora
- Modelo atômico de Bohr e quantização da energiaDocumento5 pagineModelo atômico de Bohr e quantização da energiaJadison FernandesNessuna valutazione finora
- Classificação Dos Substantivos ResumoDocumento2 pagineClassificação Dos Substantivos ResumofabianammbarbosaNessuna valutazione finora
- Propiedades Do Gases Experimental.Documento35 paginePropiedades Do Gases Experimental.fabianammbarbosaNessuna valutazione finora
- Alice no país das maravilhasDocumento3 pagineAlice no país das maravilhasfabianammbarbosaNessuna valutazione finora
- Revisão substantivos e adjetivosDocumento14 pagineRevisão substantivos e adjetivosfabianammbarbosaNessuna valutazione finora
- Relatório Orgânica 2-Síntese Da Cicloexanona (Reparado)Documento10 pagineRelatório Orgânica 2-Síntese Da Cicloexanona (Reparado)fabianammbarbosaNessuna valutazione finora
- Resolução de exercícios matemáticos e problemas de proporçãoDocumento2 pagineResolução de exercícios matemáticos e problemas de proporçãofabianammbarbosaNessuna valutazione finora
- Ciencias Unidade 8Documento3 pagineCiencias Unidade 8fabianammbarbosaNessuna valutazione finora
- Equilíbrio QuímicoDocumento72 pagineEquilíbrio QuímicofabianammbarbosaNessuna valutazione finora
- Plano de Aula Estrutura AtômicaDocumento6 paginePlano de Aula Estrutura Atômicafabianammbarbosa100% (1)
- Determinação do Índice de Iodo por Wijs (WIJSDocumento1 paginaDeterminação do Índice de Iodo por Wijs (WIJSHildo HenriqueNessuna valutazione finora
- Prova de CienciasDocumento3 pagineProva de CienciasfabianammbarbosaNessuna valutazione finora
- Como elaborar projeto de pesquisaDocumento1 paginaComo elaborar projeto de pesquisafabianammbarbosaNessuna valutazione finora
- PortuguesDocumento3 paginePortuguesfabianammbarbosaNessuna valutazione finora
- Avaliação de Ciências - Recursos Naturais 5ºanoDocumento2 pagineAvaliação de Ciências - Recursos Naturais 5ºano485trtr100% (1)
- Prática Cinética.Documento8 paginePrática Cinética.fabianammbarbosaNessuna valutazione finora
- CN7 - Teste Fósseis1Documento4 pagineCN7 - Teste Fósseis1Ana Rita Rainho91% (34)
- Síntese Do AASDocumento4 pagineSíntese Do AASfabianammbarbosaNessuna valutazione finora
- Geography Test QuestionsDocumento2 pagineGeography Test Questionsfabianammbarbosa100% (2)
- A Primeira Lei da Termodinâmica emDocumento42 pagineA Primeira Lei da Termodinâmica emmojuja100% (1)
- Apostila Quimica Organica ExperimentalDocumento87 pagineApostila Quimica Organica ExperimentalfabianammbarbosaNessuna valutazione finora
- Insatisfação Escolar A Escola SobrecarregadaDocumento16 pagineInsatisfação Escolar A Escola SobrecarregadafabianammbarbosaNessuna valutazione finora
- Coloquio3 Separacao Cations GrupoIVDocumento2 pagineColoquio3 Separacao Cations GrupoIVfabianammbarbosaNessuna valutazione finora
- Resumo Castelan Cap2Documento22 pagineResumo Castelan Cap2fabianammbarbosa100% (1)
- Apostila Quimica Organica ExperimentalDocumento87 pagineApostila Quimica Organica ExperimentalfabianammbarbosaNessuna valutazione finora
- Haletos de Alquila Substituição e EliminaçãoDocumento60 pagineHaletos de Alquila Substituição e EliminaçãofabianammbarbosaNessuna valutazione finora
- Nomenclatura Dos Compostos OrgânicosDocumento11 pagineNomenclatura Dos Compostos OrgânicosrodrigobergamiNessuna valutazione finora
- Reactividade Alcenos vs BenzenoDocumento32 pagineReactividade Alcenos vs BenzenofabianammbarbosaNessuna valutazione finora
- 44Documento13 pagine44Fernanda Rocha VeigaNessuna valutazione finora
- Inorganica Grupo 1Documento9 pagineInorganica Grupo 1fabianammbarbosaNessuna valutazione finora
- OndasDocumento14 pagineOndasfabianammbarbosaNessuna valutazione finora
- 3EM Lista10Documento2 pagine3EM Lista10MÁRIO LIMANessuna valutazione finora
- Ensaios mecânicos de materiaisDocumento6 pagineEnsaios mecânicos de materiaisJoaoPedroGrassiAlbertiNessuna valutazione finora
- Importancia Fisiologica de Alguns Aminoacidos e Aminoacidos Nao Proteicos PDFDocumento26 pagineImportancia Fisiologica de Alguns Aminoacidos e Aminoacidos Nao Proteicos PDFFCiências100% (5)
- Fotossíntese C4 CAM C3Documento13 pagineFotossíntese C4 CAM C3Máicon KilppNessuna valutazione finora
- A Quimica Do Amor PDFDocumento7 pagineA Quimica Do Amor PDFJoão MartinezNessuna valutazione finora
- Correção da acidez do soloDocumento10 pagineCorreção da acidez do soloDébora AssunçãoNessuna valutazione finora
- Lista de Massa MolarDocumento1 paginaLista de Massa MolarEmerson RochaNessuna valutazione finora
- Relatório Succinato DesidrogenageDocumento11 pagineRelatório Succinato DesidrogenageBárbara Sprocati50% (2)
- FISPQ - Dipirona SódicaDocumento6 pagineFISPQ - Dipirona Sódicameioambiente.gabrielNessuna valutazione finora
- Termodinâmica - ExercíciosDocumento3 pagineTermodinâmica - ExercíciosJanainaCMNessuna valutazione finora
- Revisão de Literatura - Transferencia de Calor e MassaDocumento6 pagineRevisão de Literatura - Transferencia de Calor e MassaJailton MartinsNessuna valutazione finora
- ELETROQUÍMICADocumento18 pagineELETROQUÍMICAFrank GuidioneNessuna valutazione finora
- Projecto Estruturas Madeira - NegraoDocumento6 pagineProjecto Estruturas Madeira - NegraojoseNessuna valutazione finora
- 14.66.00064 Endurecedor Esmalte P.U. Fleet Color BRDocumento14 pagine14.66.00064 Endurecedor Esmalte P.U. Fleet Color BRPedro Campos0% (1)
- Organic Compound Identification Handbook TablesDocumento5 pagineOrganic Compound Identification Handbook TablesJosé SendimNessuna valutazione finora
- 2º Relatório Prático GnosiaDocumento5 pagine2º Relatório Prático GnosiaPlatelminto ParmesãoNessuna valutazione finora
- Relatório Laboratório - RESISTIVIDADEDocumento3 pagineRelatório Laboratório - RESISTIVIDADEARIANA100% (3)
- Análise da umidade e sólidos totais em alimentosDocumento145 pagineAnálise da umidade e sólidos totais em alimentosSamara CardosoNessuna valutazione finora
- Tintas Norma PetrobrasDocumento64 pagineTintas Norma PetrobrasGisele Cavalcante Dos ReisNessuna valutazione finora
- Resumos Biologia 10º AnoDocumento28 pagineResumos Biologia 10º Anosara paixãoNessuna valutazione finora
- Lista de Exercícios 1AVA PDFDocumento2 pagineLista de Exercícios 1AVA PDFJonatha SantosNessuna valutazione finora
- Klueberfluid C F 3 ULTRA-ptDocumento2 pagineKlueberfluid C F 3 ULTRA-ptantonioNessuna valutazione finora
- Exercícios calorimetriaDocumento4 pagineExercícios calorimetriamarceloNessuna valutazione finora
- Prova Cpa 2020-2Documento2 pagineProva Cpa 2020-2alexandreNessuna valutazione finora
- X349ifw1gr2qy74vvzm3 - LTCAT - Laudo Tecnico Das Condições Ambientais de Trabalho 2021Documento98 pagineX349ifw1gr2qy74vvzm3 - LTCAT - Laudo Tecnico Das Condições Ambientais de Trabalho 2021SAECON CONSENGNessuna valutazione finora
- Relatório Soldagem em Eletrodo RevestidoDocumento14 pagineRelatório Soldagem em Eletrodo RevestidoMaria Júlia XavierNessuna valutazione finora
- Artigo-MB e AB Filme Tampa e FundoDocumento13 pagineArtigo-MB e AB Filme Tampa e FundoELIELNessuna valutazione finora
- Emergências QuímicasDocumento17 pagineEmergências QuímicasMaicon BonilhaNessuna valutazione finora
- Slide Aula Metais - Engenharia Civil - Materiais de Construção IIDocumento220 pagineSlide Aula Metais - Engenharia Civil - Materiais de Construção IIRamom Vilela100% (1)
- Eletroerosão por penetraçãoDocumento33 pagineEletroerosão por penetraçãocaue gomesNessuna valutazione finora