Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Problemas de Calor y La Primera Ley de La Termodinámica
Caricato da
Joshua Carey0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
35 visualizzazioni6 pagineCopyright
© © All Rights Reserved
Formati disponibili
DOC, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOC, PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
35 visualizzazioni6 pagineProblemas de Calor y La Primera Ley de La Termodinámica
Caricato da
Joshua CareyCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOC, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 6
CALOR Y LA PRIMERA LEY DE LA TERMODINMICA
PROBLEMAS DE LA TERCERA UNIDAD
1 a) Una persona de 80 kg intenta bajar de peso subiendo una montaa para
quemar el equivalente a una gran rebanada de un rico pastel de chocolate
(700 Cal alimenticias) !" qu# altura debe subir$ b) %tra persona consume
energ&a a ra'(n de 1)0 * durante su trabajo+ !qu# cantidad de pan debe
ingerir para poder trabajar durante una hora$
(Calor de combusti(n del pan es 8000 cal,g) Considere que el -).dela energ&a
liberada del alimento se aprovecha como trabajo /til 01 a) 234 m+ b) 54) g
2 6e acuerdan del problema del 6alto del 7aja8 suponga ahora que el agua en
su parte superior tiene una temperatura de 1)9 C 6i toda su energ&a potencial
se emplea en calentar el agua que cae+ calcule la temperatura del agua en la
base del salto 01 si altura del salto se estima en -)m+ 1)059 C
3 6e utili'an - :cal para calentar 500 gr de una sustancia desconocida de 1)9 C
a 409 C Calcular el calor espec&;co de la sustancia 01 013
Cal,gr9C
4 Un tro'o de cadmio de )0 gr tiene una temperatura de -09 C 6i se agregan
400 cal al cadmio+ calcular su temperatura ;nal
) " un vaso aislante del calor (de plumavit) que contiene -00 cm3 de ca<# a la
temperatura de 2)9 C+ se le agregan 40 cm3 de leche que se encuentra a
temperatura ambiente Calcular la temperatura de equilibrio que alcan'a la
me'cla (6uponer calor espec&;co de los l&quidos igual al del agua = considere
un d&a de primavera)
6 "l desa=unar+ usted vierte )0 cm3 de leche re<rigerada en su tasa que
contiene 1)0 cm3 de ca<# reci#n preparado con agua hirviendo Calcular la
temperatura de equilibrio alcan'a esta apetitosa me'cla (>esprecie la
capacidad cal(rica de la ta'a) 01 7)9 C
7 6e en<r&a un bloque de 40 gr de hielo hasta ?)09 C 7uego se agrega a )00 gr
de agua en un calor&metro de 7) gr de cobre a una temperatura de -)9 C
Calcular la temperatura ;nal de la me'cla 6i no se <unde todo el hielo+
calcular cu@nto hielo queda
8 An un recipiente aislado se me'clan 1)0 g de hielo a 09 C = 500 g de agua a
189 C Calcular1 a) la temperatura ;nal del sistema+ b) la cantidad de hielo
queda cuando el sistema alcan'a el equilibrio 01 a) 09 C+
b) 144 g
2 Un recipiente de aluminio de 300g contiene -00g de agua a 109 C 6i se
vierten 100 g m@s de agua+ pero a 1009 C+ calcular la temperatura ;nal de
equilibrio del sistema 01 3459 C
10? Un calor&metro de )0 g de cobre contiene -)0 g de agua a -09 C Calcular
la cantidad de vapor que se debe condensar en el agua para que la
temperatura del agua llegue a )09 C 01 1-2 g
11? Un calor&metro de aluminio con una masa 100 gr contiene -)0 gr de agua
Ast@n en equilibrio t#rmico a 109 C 6e colocan dos bloques de metal en el
agua Uno es )0 gr de cobre a 809 C Al otro una muestra de masa de 70
gr a una temperatura de 1009 C Bodo el sistema se estabili'a a una
temperatura ;nal de -09 C >educir de qu# material se trata la muestra
12.? Un envase plumavit contiene -00 g de mercurio a 09 C 6e le agregan
)0 g de alcohol et&lico a )09 C = 100 g de agua a 1009 C a) Calcular la
temperatura ;nal de la me'cla b) calcular el calor ganado o perdido por el
mercurio+ alcohol = agua >esprecie la capacidad t#rmica del plumavit 01 a)
8449 C+ b) ))7 cal+ 228 cal+ 1)50 cal
13? Un cubo de hielo de -0 g a 09 C se calienta hasta que 1) g se han
convertido en agua a 1009 C = el resto en vapor Calcular el calor necesario
para este proceso 01 -1732 C
14.? Un tro'o de cobre de 1 kg = a -09 C se sumerge en un recipiente con
nitr(geno l&quido hirviendo a 77: Calcular la cantidad de nitr(geno que se
evapora hasta el momento en que el cobre alcan'a los 77: 6uponga que el
recipiente est@ aislado t#rmicamente 01 241 kg
1)? 7a temperatura en @reas costeras se ve inDuenciada considerablemente por
el gran calor espec&;co del agua Una ra'(n es que el calor liberado
cuando un metro c/bico de agua se en<r&a en 19 C aumentar@ la
temperatura de un volumen enormemente m@s grande de aire en 19 C
Calcule este volumen de aire Al calor espec&;co del aire es
aproEimadamente 1 kC,(kg 9C) Considere la densidad del aire igual a 1+-)
kg,m3 01 Faire G 3433 Fagua
16 Un estudiante inhala aire a --9 C = lo eEhala a 379 C Al volumen promedio
del aire en una respiraci(n es de -00 cm3 Hgnore la evaporaci(n del agua
en el aire = estime la cantidad de calor absorbido en un d&a por el aire
respirado por el estudiante 01 37) C por respiraci(n
17? Un calentador de agua <unciona por medio de potencia solar 6i el calor
solar tiene un @rea de 5 m- = la potencia entregada por la lu' solar es de
))0 *,m-+ !cu@l es el tiempo m&nimo en aumentar la temperatura de 1 m3
de agua de -09 C a 509 C$ Hndique la(s) suposici(n(es) hecha(s) 01 aproE
14 horas
18? Cuando un conductor <rena su auto+ la <ricci(n entre los tambores = las
balatas de los <renos convierten la energ&a cin#tica del auto en calor 6i un
auto de 1)00 kg que viaja a 30 m,s = se detiene+ !cu@nto aumenta la
temperatura en cada uno de los cuatro tambores de hierro de 8 kg de los
<renos$ (desprecie la p#rdida de energ&a hacia los alrededores) 01 4719 C
12? >os balas de plomo? c,u de )+0 g+ a -09C = movi#ndose a 400 m,schocan de
<rente 6uponiendo una colisi(n per<ectamente inel@stica = que no ha=
ninguna perdida de calor hacia la atm(s<era+ describa el estado ;nal del
sistema (las dos balas) 01 54)9 C
20? Un lago contiene cerca de )E1011 m3 de agua a) !Cu@nto calor se necesita
para elevar la temperatura de ese volumen de agua de 14) a 1))9 C$ b)
Calcule el tiempo que se requerir&a para calentar el lago+ entre esas
temperaturas+ si el calor lo suministra una central el#ctrica de 1000I* 01
b) aproE 55 aos
-1? Un mol de gas ideal se calienta lentamente de modo que pasa del estado
(Po, Vo) al estado (3Po, 3Vo) Aste cambio ocurre de tal manera que la
presi(n del gas es directamente proporcional al volumen a) >ibujar el
diagrama presi(n versus volumen b) Calcular el trabajo que reali'a el gas
en este proceso Hndicar si es positivo o negativo = comente el signi;cado
asociado al signo c) "nali'ar c(mo se relaciona la temperatura del gas con
su volumen durante este proceso 01 b) 4PoVo+ c) PoV2/n(PM)Vo+ donde (JI)
es el peso molecular del gas
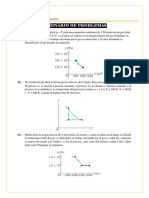
22? 7a ;gura 1313 representa la variaci(n del volumen = la presi(n de un gas
cuando se eEpande desde 1 m3 a 5 m3 a) Calcular el trabajo reali'ado por
el gas durante el proceso+ b) anali'ar lo qu# le ocurre a la temperatura
durante el proceso 01 1418- C
-3? Un gas est@ a una presi(n de 1) atm = a un volumen de 4 m3 Calcular el
trabajo reali'ado por el gas cuando1 a) se eEpande a una presi(n constante
hasta el doble de su volumen inicial = b) se comprime a presi(n constante
hasta un cuarto de su volumen inicial 01 a) 51E10) C+ b) ?45E10) C
24? Un gas ideal est@ encerrado en un cilindro que tiene un #mbolo m(vil en su
parte superior+ de masa 8 kg = @rea de ) cm-+ libre de moverse+
manteniendo la presi(n del gas constante Calcular el trabajo si la
temperatura de - moles de gas aumenta de -09 a 3009 C 01 4528 C
-)? Una muestra de gas ideal de un mol se lleva a trav#s de un proceso
termodin@mico c&clico+ como se muestra en la ;gura 1314 Al ciclo consta
de tres partes1 una eEpansi(n isot#rmica ab+ una compresi(n Hsob@rica bc =
un aumento de presi(n a volumen constante ca 6i B G 300 :+ Ja G ) atm+
Jb G Jc G 1 atm+ calcular el trabajo reali'ado por el gas durante el ciclo
26? Una muestra de gas ideal se eEpande al doble de su volumen inicial de 01
m3 en un proceso para el cual P = aV2+ con a = 2 atm/m6 a) Kosquejar un
gr@;co en un diagrama JF b) Calcular el trabajo reali'ado por el gas
durante la eEpansi(n
-7? Un gas ideal que se encuentra a 1 atm = 09 C+ se eEpande desde un
volumen de -) lt hasta 80 lt+ en un proceso en el cual P = 0.5a/V2 a)
Kosquejar un gr@;co en un diagrama JF Calcular1 b) la constante a en el 6H+
c) la temperatura = presi(n ;nal+ d) el trabajo reali'ado en la eEpansi(n 01
b) 1-55 Ja,m3+ c) presi(n1 533 Ja,F-+ d) 3437)C
28? Un mol de vapor de agua a 373: se en<r&a a -83 : Al calor entregad por el
vapor del agua que se en<r&a lo absorben 10 moles de un gas ideal+
haciendo que el gas se eEpanda a una temperatura constante de -73: 6i
el volumen ;nal del gas ideal es de -0 lt+ determine su volumen inicial 01
-2 litros
-2? Un mol de gas ideal reali'a 3000 C de trabajo mientras se eEpande
isot#rmicamente hasta una presi(n ;nal de 1 atm = un volumen de -)
litros Calcular1 a) su volumen inicial+ b) la temperatura del gas+ c) el cambio
de energ&a interna que eEperimenta+ indicando si aumenta o disminu=e+ d)
el calor absorbido o cedido 01 a) 75 lt+ b) 304 :+ c) 0 C+ d) 3000 C
30? Un gas ideal inicialmente a 300 : se eEpande en <orma isob@rica a una
presi(n de -) kJa 6i el volumen aumenta de 1 m3 a 3 m3 = se agregan
1-)00 C de calor al sistema+ calcular1 a) el cambio de energ&a interna+ b) su
temperatura ;nal 01 a) 7)00 C+ b) 200 :
31? 6e comprime un gas a presi(n constante de 08 atm de un volumen de 2 lt a
un volumen de - lt An el proceso se escapan del gas 400 C de energ&a
cal(rica Calcular1 a) el trabajo reali'ado por el gas+ b) el cambio de energ&a
interna del gas 01 a) ?)57 C+ b) 157 C
32? Un mol gas ideal monoat(mico se somete al ciclo "KC mostrado en la
;gura 131) 6i J" G 1) atm = BK G BC G 800 :+ a) identi;car las
caracter&sticas de cada proceso que compone el ciclo = dibujar el diagrama
JF que le corresponde+ indicando los valores de las variables de estado al
comien'o = ;nal de cada proceso b) Calcular para cada proceso el trabajo
hecho por el gas+ el calor absorbido o cedido+ el cambio de energ&a interna
del gas c) "veriguar para el ciclo completo qu# ocurre con U+ * = L 01 a)
F" G 154 lt G FK+ FC G 437 lt+ b) *"K G 0+ *KC G 5)04 C+ *C" G 4148)
C+ *B%B"7 G -3))7 C
33? Un gas se lleva a trav#s de un proceso c&clico como el de la ;gura
1315 a) Calcular el calor neto trans<erido al sistema durante el ciclo
completo b) 6i el ciclo se invierte+ !cu@l es el calor neto trans<erido por
ciclo$ 01 a) 5000 C+ b) ?5000 C
34? Un bloque de 1 kg de aluminio se calienta a presi(n atmos<#rica de modo
que su temperatura aumenta desde --9 C hasta 409 C Calcular1 a) el
trabajo reali'ado por el aluminio+ b) la energ&a t#rmica que se le entrega+ =
c) el cambio de su energ&a interna 01 a) 00)1 C+ b) 15-00 C+ c) 151222 C
3)? Un mol de gas ideal monoat(mico se somete al proceso c&clico "KC"
mostrado en la ;gura 1317 a) Calcular la energ&a t#rmica trans<erida al
sistema+ el trabajo hecho por el sistema = el cambio de energ&a interna
durante cada etapa del ciclo = para el ciclo completo b) 6i el ciclo se
invierte+ calcular cada una de dichas variables
36? Un mol de gas inicialmente a una presi(n de - atm = a un volumen de 03 lt+
tiene una energ&a interna de 21 C An su estado ;nal+ la presi(n es de 1)
atm+ el volumen de 08 lt = la energ&a interna de 18- C Jara los tres
caminos H"M+ HKM e HM de la ;gura 1318+ calcular a) el trabajo reali'ado por
el gas+ b) el calor neto trans<erido en el proceso 01 a) 75
C+ 101 C+ 885 C+ b) 157 C+ 12- C+ 180 C
37? Un mol de gas ideal monoat(mico se lleva por un proceso isot#rmico+ de 400
:+ al doble de su volumen original (;gura 1314) Calcular1 a) el trabajo que
reali'( el gas+ b) el calor que se le entreg( al gas+ c) la variaci(n de energ&a
interna del gas+ d) la ra'(n de presiones Pb/Pa 6uponga que ahora se reali'a
un proceso (de a a c) a volumen constante para reducir la presi(n inicial Pa a
Pb+ calcular los nuevos valores de trabajo+ calor = variaci(n de energ&a
interna
38? Calcular el cambio de energ&a interna de 3 moles de helio cuando su
temperatura aumenta en - : 01 7) C
32? 7a capacidad cal(rica de un gas monoat(mico a presi(n constante es 5-3
C,mol: Calcular1 a) el n/mero de moles del gas+ b) la capacidad cal(rica a
volumen constante+ c) la energ&a interna del gas a 3)0: 01 a) 3 moles+ b)
374 C,:+ c) 13100 C
40? Un mol de hidr(geno se calienta a presi(n constante de 0 a 1009 C calcular1
a) el calor trans<erido al gas+ b) el aumento de energ&a interna+ c) el trabajo
reali'ado por el gas
41? An un proceso a volumen constante+ se trans;eren -10C de calor a un mol de
un gas ideal monoat(mico inicialmente a -79 C Calcular1 a) el aumento de
energ&a interna+ b) el trabajo reali'ado por el gas+ c) la temperatura ;nal del
gas
42? >os moles de un gas ideal (NG14) se eEpanden adiab@ticamente desde una
presi(n de ) atm = un volumen de 1- lt a un volumen ;nal de 30 lt Calcular1
a) la presi(n ;nal del gas+ b) las temperaturas inicial = ;nal del gas 01 a) 14
atm+ b) 35)8 :+ -)51 :
43? Un gas ideal (NG14) se eEpande adiab@ticamente 6i la temperatura ;nal es
un tercio de la inicial+ determinar a) en que <actor cambia el volumen+ b) en
que <actor cambia la presi(n 01 a) 1)5+ b) 00-14
44? Un mol de gas ideal monoat(mico (NG14) inicialmente a -79 C = a la presi(n
de 1 atm se comprime adiab@ticamente a un cuarto de su volumen inicial
Calcular la presi(n = la temperatura ;nal del gas
4)? >urante el tiempo de compresi(n de un motor de bencina+ la presi(n
aumenta de 1 a -0 atm 6uponiendo que el proceso es adiab@tico = el gas
ideal+ con N G14 Calcular el volumen = la temperatura ;nal delgas 01 8)Fi+
-3Bi
46? Un globo sonda meteorol(gico eEpande su volumen al ascender en la
atm(s<era 6i la temperatura inicial del gas dentro del globo era de -79 C+
calcular su temperatura cuando el volumen se ha duplicado 01 --2 :
47? Calcular el trabajo que se requiere para comprimir a 1,10 de su volumen
inicial+ ) moles de aire a -09 C = 1 atm de presi(n por un proceso1 a)
isot#rmico+ b) adiab@tico c) Calcular las presiones ;nales en los dos casos
48? 3 moles de gas arg(n inicialmente a la temperatura de -09 C+ ocupan un
volumen de 10 lt Al gas eEperimenta una eEpansi(n a presi(n constante
hasta un volumen de -0 lt8 luego se eEpande en <orma adiab@tica hasta que
regresa a su temperatura inicial a) gra;car el proceso en un diagrama PV
Calcular1 b) la cantidad de calor que se le entrego al gas durante todo el
proceso+ c) el cambio total en la energ&a interna del gas d) el trabajo total
reali'ado durante el proceso+ e) el volumen ;nal del
Potrebbero piacerti anche
- EJERCICIOSDocumento13 pagineEJERCICIOSAbrahamNessuna valutazione finora
- Taller 3 Calor y Ondas 2015-1Documento4 pagineTaller 3 Calor y Ondas 2015-1Bondmads50% (2)
- Ejercicios de Taller Tercer CorteDocumento3 pagineEjercicios de Taller Tercer CorteMAIRA ALEJANDRA BARRIOS GAMEZNessuna valutazione finora
- Taller Numero 3Documento4 pagineTaller Numero 3Daniel DBNessuna valutazione finora
- Con Solid Ado de Problemas TermodinamicaDocumento7 pagineCon Solid Ado de Problemas TermodinamicaJesus Sergio Paico MartinezNessuna valutazione finora
- Problemas de termodinámica y calor (menos deDocumento6 pagineProblemas de termodinámica y calor (menos deAnonymous faRVVGN0% (2)
- TERMODINAMICADocumento2 pagineTERMODINAMICARosanaEstela0% (1)
- Primera ley de la termodinámica: problemas resueltosDocumento20 paginePrimera ley de la termodinámica: problemas resueltosKelvin TerronesNessuna valutazione finora
- 1ra Ley termodinámica: calor, trabajo y energíaDocumento5 pagine1ra Ley termodinámica: calor, trabajo y energíaJulio TiradoNessuna valutazione finora
- Termodinámica y gases idealesDocumento4 pagineTermodinámica y gases idealesVíctor Hugo Ossa OssaNessuna valutazione finora
- Ejercicios de calor y cambio de estadoDocumento6 pagineEjercicios de calor y cambio de estadoMAIRA ALEJANDRA BARRIOS GAMEZNessuna valutazione finora
- Tarea 2 FisicaDocumento14 pagineTarea 2 FisicaJallyl Sabat Martinez100% (1)
- Taller 2 (Primeraley y Gases Ideales)Documento3 pagineTaller 2 (Primeraley y Gases Ideales)Jessika Julieth Siachoque SuarezNessuna valutazione finora
- Ejercicios calorías temperaturaDocumento3 pagineEjercicios calorías temperaturaAndrés José Andrade BNessuna valutazione finora
- Calculo termodinámico de procesos de gases idealesDocumento5 pagineCalculo termodinámico de procesos de gases idealesmiguel miguez cotoNessuna valutazione finora
- Taller No 5 TermodinámicaDocumento3 pagineTaller No 5 TermodinámicaASDASDANessuna valutazione finora
- Física II Taller 4 gases idealesDocumento3 pagineFísica II Taller 4 gases idealesNelson MuñozNessuna valutazione finora
- Tarea 6Documento2 pagineTarea 6Antonio Velarde UyuniNessuna valutazione finora
- Termodinamica 2 C 15Documento8 pagineTermodinamica 2 C 15Giovani Butron BordaNessuna valutazione finora
- TAREA CAP 20 Tarea 2da Ley de La TermodinámicaDocumento5 pagineTAREA CAP 20 Tarea 2da Ley de La TermodinámicaDanielNessuna valutazione finora
- Actividad de Aprendizaje - N°07Documento4 pagineActividad de Aprendizaje - N°07JadeNessuna valutazione finora
- Practica TermodinámicaDocumento2 paginePractica TermodinámicaRoberto AvilaNessuna valutazione finora
- Taller Unificado de Calor Segundo SeguimientoDocumento10 pagineTaller Unificado de Calor Segundo SeguimientoKarenNessuna valutazione finora
- Guía Termodinámica ProblemasDocumento8 pagineGuía Termodinámica ProblemasyoshiwisNessuna valutazione finora
- Hoja de Problemas #04Documento4 pagineHoja de Problemas #04Paul Quiroz AliagaNessuna valutazione finora
- Procesos TermodinámicosDocumento4 pagineProcesos TermodinámicosFernandoNessuna valutazione finora
- E Temperatura, Calor, Trans 1lt 2lt 17 2Documento6 pagineE Temperatura, Calor, Trans 1lt 2lt 17 2Luigie Leon0% (1)
- Enunciados Fisica IIDocumento17 pagineEnunciados Fisica IIlaguachapistola880% (1)
- SEP 6-7 - 1 y 2 LT 12559Documento13 pagineSEP 6-7 - 1 y 2 LT 12559Roberto RicraNessuna valutazione finora
- Taller de Termodinámica 2Documento9 pagineTaller de Termodinámica 2LiyibethNessuna valutazione finora
- Ejercicios de TermodinamicaDocumento6 pagineEjercicios de TermodinamicaJick MarceloNessuna valutazione finora
- Termodinámica gas idealDocumento3 pagineTermodinámica gas idealWilliam QuinchiaNessuna valutazione finora
- Taller 5Documento9 pagineTaller 5William Quinchia100% (1)
- S15-FG - Chinchay Garcia Eduin Omar.Documento8 pagineS15-FG - Chinchay Garcia Eduin Omar.Ch G Omąr100% (1)
- Ejercicios Intro TermodinamicaDocumento2 pagineEjercicios Intro TermodinamicaJohn AranzalesNessuna valutazione finora
- Taller 5 Termodinámica - 2021Documento3 pagineTaller 5 Termodinámica - 2021Vanessa PortillaNessuna valutazione finora
- TALLER 3 - IntersemestralDocumento2 pagineTALLER 3 - IntersemestralSebas DiazNessuna valutazione finora
- Serie 3Documento8 pagineSerie 3JoseNessuna valutazione finora
- Termodinámica: Práctica calificada sobre procesos y ciclos termodinámicos de gasesDocumento13 pagineTermodinámica: Práctica calificada sobre procesos y ciclos termodinámicos de gasesEsTefanii R'cNessuna valutazione finora
- Ejercicios de 1er PrincipioDocumento2 pagineEjercicios de 1er Principiopietroki40% (5)
- Práctica de Calor 1-2023Documento4 paginePráctica de Calor 1-2023Esteban GarciaNessuna valutazione finora
- Práctica de Física Fluidos y Termodinámica - (Temperatura y Calor y Primera Ley de La Termodinámica) - 2021-ADocumento2 paginePráctica de Física Fluidos y Termodinámica - (Temperatura y Calor y Primera Ley de La Termodinámica) - 2021-Acesar zapata zuñigaNessuna valutazione finora
- Taller Primera LeyDocumento4 pagineTaller Primera LeyScribdLibros11Nessuna valutazione finora
- Biofisica Del Transporte Corte 2Documento2 pagineBiofisica Del Transporte Corte 2Nataly BonillaNessuna valutazione finora
- Termodinamica Bryce 18 AgostoDocumento3 pagineTermodinamica Bryce 18 AgostoCarlos Alberto Colque GarciaNessuna valutazione finora
- HT - Primera Ley de La TermodinámicaDocumento5 pagineHT - Primera Ley de La TermodinámicaQuito NeiraNessuna valutazione finora
- Practica No 3 Calor Temperatura Termodinamica 1 - 2019Documento4 paginePractica No 3 Calor Temperatura Termodinamica 1 - 2019Wilver VasquezNessuna valutazione finora
- Taller de Termodinámica para el Parcial del 40Documento4 pagineTaller de Termodinámica para el Parcial del 40Jairo Mesa ChaparroNessuna valutazione finora
- 07-1 - Práctica Primer PpioDocumento3 pagine07-1 - Práctica Primer PpioEmilia TamantiniNessuna valutazione finora
- Serie 3Documento5 pagineSerie 3Deysi CamachoNessuna valutazione finora
- Calorimetria 1Documento4 pagineCalorimetria 1Aldair ArpasiNessuna valutazione finora
- Serie de Problemas #1 Termodinamica IIDocumento4 pagineSerie de Problemas #1 Termodinamica IIFrank C. Flores100% (1)
- Tarea Resuelta - Fisica IIDocumento11 pagineTarea Resuelta - Fisica IIROMERO CUBAS GERMAN SMITHNessuna valutazione finora
- Termodinámica primer ley ciclo gasDocumento4 pagineTermodinámica primer ley ciclo gasCaroll IsabelNessuna valutazione finora
- Problemas de La Primera Ley de La TermodinamicaDocumento17 pagineProblemas de La Primera Ley de La Termodinamicalucifers1115Nessuna valutazione finora
- Ingeniería química. Soluciones a los problemas del tomo IDa EverandIngeniería química. Soluciones a los problemas del tomo INessuna valutazione finora
- Problemas resueltos de Hidráulica de CanalesDa EverandProblemas resueltos de Hidráulica de CanalesValutazione: 4.5 su 5 stelle4.5/5 (7)
- El Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaDa EverandEl Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaNessuna valutazione finora
- s37 Primaria 5 Guia Dia 3 PDFDocumento6 pagines37 Primaria 5 Guia Dia 3 PDFIE Javier Perez de CuellarNessuna valutazione finora
- Semana 32Documento7 pagineSemana 32Joshua CareyNessuna valutazione finora
- Semana 32Documento7 pagineSemana 32Joshua CareyNessuna valutazione finora
- DiaposDocumento13 pagineDiaposJoanán Reyes ArandaNessuna valutazione finora
- Informe 01 - Pilares Del MantenimeintoDocumento6 pagineInforme 01 - Pilares Del MantenimeintoJoshua CareyNessuna valutazione finora
- Realidad NacionalDocumento4 pagineRealidad NacionalJoanán Reyes ArandaNessuna valutazione finora
- Olehidraulica 3Documento23 pagineOlehidraulica 3Joshua CareyNessuna valutazione finora
- Presentación RealidadDocumento17 paginePresentación RealidadJoshua CareyNessuna valutazione finora
- Trabajo Final - Diseño de Un Aerogenerador EólicoDocumento32 pagineTrabajo Final - Diseño de Un Aerogenerador EólicoJoshua CareyNessuna valutazione finora
- Ciclos de Potencia de Vapor y Combinados - 3 SemanaDocumento44 pagineCiclos de Potencia de Vapor y Combinados - 3 SemanaJoshua CareyNessuna valutazione finora
- Chamba CorfizDocumento2 pagineChamba CorfizBrajhan ChorresNessuna valutazione finora
- Constitucion EconomicaDocumento9 pagineConstitucion EconomicaJoanán Reyes ArandaNessuna valutazione finora
- Relaciones de Transmisión - 8 SemanaDocumento41 pagineRelaciones de Transmisión - 8 SemanaJoshua CareyNessuna valutazione finora
- Informe 08Documento26 pagineInforme 08Joshua CareyNessuna valutazione finora
- DiaposDocumento13 pagineDiaposJoanán Reyes ArandaNessuna valutazione finora
- Producción Del Cobre, Hierro y Plomo en PerúDocumento13 pagineProducción Del Cobre, Hierro y Plomo en PerúJoshua CareyNessuna valutazione finora
- Perfiles EstructuralesDocumento16 paginePerfiles EstructuralesEdison EugenioNessuna valutazione finora
- Metrologia y Control de CalidadDocumento13 pagineMetrologia y Control de CalidadJoshua Carey100% (2)
- Ciclos de Potencia de Vapor y Combinados - 3 SemanaDocumento44 pagineCiclos de Potencia de Vapor y Combinados - 3 SemanaJoshua CareyNessuna valutazione finora
- Ensayo Exceso Lado BDocumento5 pagineEnsayo Exceso Lado BJoshua CareyNessuna valutazione finora
- Práctica 01 - ProgramaciónDocumento2 paginePráctica 01 - ProgramaciónJoshua CareyNessuna valutazione finora
- Ensayo Exceso Lado BDocumento5 pagineEnsayo Exceso Lado BJoshua CareyNessuna valutazione finora
- Trabajo de Investigación - El SubdesarrolloDocumento19 pagineTrabajo de Investigación - El SubdesarrolloJoshua CareyNessuna valutazione finora
- SEMILOG 16cmx2modDocumento0 pagineSEMILOG 16cmx2modMarcial RuizNessuna valutazione finora
- Ley de Ohm - Práctica 4Documento2 pagineLey de Ohm - Práctica 4Joshua CareyNessuna valutazione finora
- Geometría Descriptiva - EjerciciosDocumento3 pagineGeometría Descriptiva - EjerciciosJoshua CareyNessuna valutazione finora
- Trabajo 1 - PaperDocumento10 pagineTrabajo 1 - PaperJoshua CareyNessuna valutazione finora
- Ley de Enfriamiento de Newton - Práctica 6Documento17 pagineLey de Enfriamiento de Newton - Práctica 6Joshua CareyNessuna valutazione finora
- Format OapaDocumento13 pagineFormat OapaJoshua CareyNessuna valutazione finora
- Problemas de Calor y La Primera Ley de La TermodinámicaDocumento6 pagineProblemas de Calor y La Primera Ley de La TermodinámicaJoshua CareyNessuna valutazione finora
- Taller Estadistica Descriptiva Medidas de DispersionDocumento6 pagineTaller Estadistica Descriptiva Medidas de DispersionDuvan BastidasNessuna valutazione finora
- Unidad 2 Lenguaje de InterfazDocumento16 pagineUnidad 2 Lenguaje de InterfazLuis Oscar Calderon100% (1)
- Unidad 07 - Magnitudes PorporcionalesDocumento9 pagineUnidad 07 - Magnitudes PorporcionalesYerlinRodriguez33% (3)
- Tema 5 - NÚMEROS DECIMALESDocumento9 pagineTema 5 - NÚMEROS DECIMALESvalencianita 21Nessuna valutazione finora
- 05 - Cuerpo Rígido - Fuerzas Equivalentes - PDFDocumento75 pagine05 - Cuerpo Rígido - Fuerzas Equivalentes - PDFJs csNessuna valutazione finora
- SEMINARIO 6 de NoviembreDocumento72 pagineSEMINARIO 6 de NoviembreNancyNessuna valutazione finora
- Cap2 - Razones Trigonométricas en El Triángulo RectánguloDocumento34 pagineCap2 - Razones Trigonométricas en El Triángulo Rectángulojrene2014Nessuna valutazione finora
- Analisis CombinatorioDocumento4 pagineAnalisis CombinatorioMariano HerediaNessuna valutazione finora
- In EcuacionesDocumento10 pagineIn EcuacionesIngrid AcostaNessuna valutazione finora
- PorcientoMatematicaDocumento5 paginePorcientoMatematicaMaestro MedNessuna valutazione finora
- Programa Analitico Inf120Documento5 paginePrograma Analitico Inf120Luis Felipe Chavez RomanNessuna valutazione finora
- Estudio de PeatonesDocumento45 pagineEstudio de PeatonesjohanNessuna valutazione finora
- Puente Con Cables TensoresDocumento15 paginePuente Con Cables TensoresMauricio Ordóñez DelgadoNessuna valutazione finora
- Actividad 1 MatematicasDocumento10 pagineActividad 1 MatematicasGustavo SilvaNessuna valutazione finora
- Estadística descriptiva medidas de dispersiónDocumento5 pagineEstadística descriptiva medidas de dispersiónnatalia andreaNessuna valutazione finora
- Construcción de líneas McCabe-Thiele para destilación fraccionadaDocumento35 pagineConstrucción de líneas McCabe-Thiele para destilación fraccionadaYEFERSON RAMIREZ OSCCONessuna valutazione finora
- Costos y Presupuestos en Obras Publicas Con S10Documento32 pagineCostos y Presupuestos en Obras Publicas Con S10Jössyy VillâfuêrtêNessuna valutazione finora
- Ingenieria MecanicaDocumento7 pagineIngenieria Mecanicamiguel mobNessuna valutazione finora
- Metodología de investigación científica UNCP: Teoría del conocimientoDocumento254 pagineMetodología de investigación científica UNCP: Teoría del conocimientomarco_locosNessuna valutazione finora
- Proyectos e Informes MinerosDocumento157 pagineProyectos e Informes MinerosAnonymous XTsbOs4oUWNessuna valutazione finora
- Glosario Mat7Documento3 pagineGlosario Mat7Ferrer Rico AdyazNessuna valutazione finora
- 9°-Act2-P2 Funcion LinealDocumento6 pagine9°-Act2-P2 Funcion LinealMario JimenezNessuna valutazione finora
- Matriz competencia actúa piensa matemáticamenteDocumento16 pagineMatriz competencia actúa piensa matemáticamenteLeoncio VegasNessuna valutazione finora
- Racionales a fracciones: Guía para expresar números decimales como fraccionesDocumento2 pagineRacionales a fracciones: Guía para expresar números decimales como fraccionesnnnnkarinaNessuna valutazione finora
- Calculo de Cilindros y Valvula NeumaticasDocumento11 pagineCalculo de Cilindros y Valvula NeumaticasDiego Diego100% (1)
- Influencia Matematica en El Metodo Cartesiano - OdtDocumento3 pagineInfluencia Matematica en El Metodo Cartesiano - OdtLuis Alisandra Senabre0% (1)
- Interpretación de Problemas Matemáticos IDocumento20 pagineInterpretación de Problemas Matemáticos Ijrzuleta100% (1)
- Practica 1 - Fundamentos de ControlDocumento22 paginePractica 1 - Fundamentos de ControlNúñez Esparza Jesús ArturoNessuna valutazione finora
- Control 2Documento5 pagineControl 2Sebastian Alonso0% (1)