Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
PH Sangre
Caricato da
Jonathan ZapetaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
PH Sangre
Caricato da
Jonathan ZapetaCopyright:
Formati disponibili
PH SANGRE
El pH de la sangre humana debe ser ligeramente alcalino ( 7.35 7.45 ). Por debajo o por
arriba de este rango comienzan los problemas o las enermedades. !n pH de 7." es neutral.
!n pH por debajo de 7." es acido. !n pH por encima de 7." es alcalino.
!n pH acido puede resultar de una dieta acidiicante# estr$s emocional# to%ic o&erload#
and'or immune reactions or an( process )ue pri&e de o%igeno a las celulas ( de otros
nutrientes. El organismo tratara de compensar el pH acido usando minerales alcalinos. *i la
dieta no contiene suicientes minerales para compensar# se puede presentar una
concentraci+n acida en la c$lula.
PH ORINA
!n cambio en los &alores de pH de la orina puede indicar una enermedad. En una persona
sana el pH de la orina con un &alor de ,#" (rango normal de 4#5 a -#")# es ligeramente .cido.
!n &alor de pH m.s alto (superior a -) con presencia simult.nea de nitrito# )ue
normalmente no est. presente en la orina# indica una inecci+n bacteriana de las &/as
urinaria deri&adas. Pero la dieta tambi$n tiene inluencia sobre el &alor del Ph. Por ejemplo#
el pH de la orina suele aumentar ligeramente despu$s de las comidas# especialmente con la
nutrici+n &egetariana. 0os trastornos metab+licos tambi$n pueden conducir a un ma(or
&alor del pH de la orina. !n &alor m.s bajo del pH bajo se produce en los alimentos donde
predomina la carne# en el a(uno ( por la noche. 1aras &eces tiene causas patol+gicas# pero
puede ser tambi$n un s/ntoma de gota.
PH CLORO
En las aguas con un pH alto# la ma(or parte de este .cido (cloro acti&o) se con&ierte en 2on
hipoclorito (3l45)# una orma de cloro con mu( bajo poder desinectante.
Estas dos ormas de cloro se encuentran en el agua en e)uilibrio# aun)ue $ste depende de
los &alores de pH.
Cloro Total6
0a suma de cloro libre ( el cloro combinado da como resultado el cloro total. Puede ser
medido por 7P7.
3loro 8otal9 3loro 0ibre:3loro 3ombinado
PH AGUA JABONOSA
E0 pH del agua potable es neutro# entre , ( 7.
El del jab+n es b.sico# entonces si le agregas jabon# el pH ser. ma(or ( tender. a ser
basico.
El pH depende de la cantidad de jabon )ue le agregues# por tal moti&o no puedo darte un
pH apro%imado.
PH DEL VINAGRE
El pH t/picamente &a de " a ;4 en disoluci+n acuosa# siendo .cidas las disoluciones con pH
menores a 7 (el &alor del e%ponente de la concentraci+n es ma(or# por )ue ha( m.s
protones en la disoluci+n) # ( b.sicas las )ue tienen pH ma(ores a 7. El pH 9 7 indica la
neutralidad de la disoluci+n (donde el disol&ente es agua). *e considera )ue p es un
operador logar/tmico sobre la concentraci+n de una soluci+n6 p 9 log<...= # tambi$n se
deine el p4H# )ue mide la concentraci+n de iones 4H>.
Puesto )ue el agua est. disociada en una pe)ue?a e%tensi+n en iones 4H ( H34:#
PH DE LA SALIBA
El pH de la saliva es apro%imadamente entre ,#5 ( 7 ( est. compuesta de agua ( de iones
como el sodio# el cloro o el potasio# ( enzimas )ue a(udan a la degradaci+n inicial de los
alimentos# cicatrizaci+n# protecci+n contra inecciones bacterianas e incluso unciones
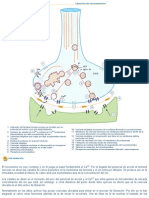
gustati&as. *on di&ersos los actores )ue pueden alterar la acide o alcali!idad del cuerpo#
lo cual# adem.s de pruebas de orina# se puede determinar a tra&$s de una prueba de pH de
la saliva mediante tiras reacti&as# con la inalidad de contar con &alores adecuados para el
diagn+stico de enermedades o &alores del organismo. 7e acuerdo con especialistas de la
Cl"!ica Odo!tol#$ica de la Pal%a e! Espa&a# entre las enermedades )ue a(uda a
determinar el pH de la saliva# por los est.ndares de acidez ( alcalinidad# se encuentran las
caries' e!(er%edad periodo!tal# gingi&itis# dia)etes# hipertensi+n# anemia ( osteoporosis.
PH LI*ON
El lim+n a pesar de lo )ue parezca por su sabor .cido# tiene un eecto alcalinizante en
nuestro organismo# de hecho es uno de los alimentos con ma(or poder alcalino. Esto
signiica )ue aumenta el pH de la sangre# )ue por desgracia suele estar acidiicado. 0a
acidosis de la sangre es mu( peligrosa (a )ue conlle&a la aparici+n de multitud de
enermedades# entre ellas las m.s gra&es como el c.ncer (una de las causas del c.ncer es la
alta de o%/geno ( la acidez del pH). 0a ma(or/a de los habitantes de los pa/ses
supuestamente desarrollados surimos acidosis# (a sea por el estr$s# la contaminaci+n# el
d$icit de o%/geno (contaminaci+n ambiental# tabaco# problemas respiratorios...)# una mala
alimentaci+n rica en carnes ( grasas ( pobre en alimentos &egetales# crudos ( rescos# un
e%ceso de medicaci+n# etc. 1egular el pH de nuestra sangre (el pH +ptimo es de 7#3#
ligeramente alcalino) resulta &ital# (a )ue marcar. la dierencia entre la salud ( la
enermedad. 1ecordemos )ue un pH .cido# por debajo del 7#; producir. el coma inmediato.
PH ACIDO CLORHIDRICO
El +cido clor,"drico# +cido %-ri+tico# esp"rit- de sal# +cido %ari!o# +cido de sal o
toda&/a ocasionalmente llamado# +cido ,idrocl#rico (por su e%tracci+n a partir de sal
marina en @m$rica)# a$-a (-erte o sal(-%+! (en Espa?a)# es una disoluci+n acuosa del gas
clor-ro de ,idr#$e!o (H3l). Es mu( corrosi&o ( .cido. *e emplea comAnmente como
reacti&o )u/mico ( se trata de un .cido uerte )ue se disocia completamente en disoluci+n
acuosa. !na disoluci+n concentrada de .cido clorh/drico tiene un pH inerior a ;B una
disoluci+n de H3l "#; C da un pH de ; (3on 4" m0 es suiciente para matar a un ser
humano# en un litro de agua. @l disminuir el pH pro&oca la muerte de toda la microbiota
gastrointestinal# adem.s de la destrucci+n de los tejidos gastrointestinales).
PH CAL
El +%ido de calcio (3a4) obtenido en la calcinaci+n de la caliza reacciona inmediatamente
con el agua# transorm.ndose en hidr+%ido de calcio (3a(4H)D). Este en+meno se conoce
como hidrataci+n o apagado de la cal &i&a (3a4).
En el apagado se libera una gran cantidad de calor segAn la siguiente reacci+n6
3a4 : HD4 E 3a(4H)D : calor
El apagado de la cal &i&a puede hacerse de tres ormas6
Apagado con poco agua6 se llama hidrataci+n seca ( se hace con la cantidad
este)uiom$trica de agua. El producto obtenido es un pol&o seco.
PH HIDRO.IDO
Fa4H 5555555G Fa : 4H5
H3l 55555555555G H: : 3l5
3omo &ez se disocian ;6;# o sea )ue se produce ; mol de H: e 4H5 con cada sustancia.
pH 9 5log<H3l= para el H3l
pH 9 ;4:log<Fa4H= para el Fa4H
PH AGUA GASEOSA
7ependiendo de la gaseosas este podr. ser .cido como en el caso de las bebidas cola como
consecuencia de la presencia de .cidos. 1ecordar )ue la cola m.s conocida tiene pH 3 ( por
ende saca el +%ido.
En otros casos el pH ser. ligeramente alcalino como el de la bebida )ue se llama Harriba de
sieteHB en jugos de naranja para diluir tambi$n el pH es alcalinoB en la ma(or/a de las &eces
se debe por el agregado de hidr+%ido de sodio en una concentraci+n tal )ue no da?a la
HsaludH humana o bien por el uso de soluciones eguladoras de pH.
El agua mineral es un caso particular por )ue depende de su uente de origen ( casi siempre
esta en &alores cercanos a pH9- ( es como consecuencia de las sales disueltas.
Potrebbero piacerti anche
- Formato de Evaluacion de PRMsDocumento4 pagineFormato de Evaluacion de PRMsmariaNessuna valutazione finora
- Intervención Fonoaudiológica en Pacientes Adultos Con Déficit Intelectual.Documento6 pagineIntervención Fonoaudiológica en Pacientes Adultos Con Déficit Intelectual.Sofía MardonesNessuna valutazione finora
- Clase 11-Necesidades de Eliminacion Urinaria IntestinalDocumento33 pagineClase 11-Necesidades de Eliminacion Urinaria IntestinalAddel Yupanqui Miranda100% (2)
- 30 Herramientas de ElectricidadDocumento10 pagine30 Herramientas de ElectricidadJosue Ortiz taveras100% (1)
- Antecedentes Del Conflicto QuellavecoDocumento9 pagineAntecedentes Del Conflicto QuellavecoHardy Contreras VillegasNessuna valutazione finora
- Test III Psico GerminativoDocumento3 pagineTest III Psico GerminativoNUA GINER100% (2)
- Fase 2 Analizar y Describir El Sistema Logistico.Documento9 pagineFase 2 Analizar y Describir El Sistema Logistico.Norelis Ortega GarciaNessuna valutazione finora
- Complejo SnareDocumento2 pagineComplejo SnareJavier Eduardo Aravena VelasquezNessuna valutazione finora
- Parcialito TPC02 - 1er Cuatrimestre 2023 - Revisión Del IntentoDocumento3 pagineParcialito TPC02 - 1er Cuatrimestre 2023 - Revisión Del IntentoVictor RodriguesNessuna valutazione finora
- Mioterapia Funcional-Resp - BucalDocumento5 pagineMioterapia Funcional-Resp - BucalMaría-Paz Acevedo DiazNessuna valutazione finora
- Caso Clínico en Atención PrimariaDocumento27 pagineCaso Clínico en Atención PrimariaKey Collantes VegaNessuna valutazione finora
- Nom 177 Bioeq FinalDocumento41 pagineNom 177 Bioeq FinalDarla SanchezNessuna valutazione finora
- Workingpaperyucabioeconomia Canalestrujillo Mayo21Documento30 pagineWorkingpaperyucabioeconomia Canalestrujillo Mayo21MANUEL alvarezNessuna valutazione finora
- Revisar: Genes de Resistencia A Antibióticos en Aguas ResidualesDocumento9 pagineRevisar: Genes de Resistencia A Antibióticos en Aguas ResidualesKEVIN DANIEL LLANOS VARGASNessuna valutazione finora
- Práctica 1 SMRCDocumento8 paginePráctica 1 SMRCaprobamos todosNessuna valutazione finora
- f16.Mo18.Pp Formato Iniciativa Comunitaria v4Documento20 paginef16.Mo18.Pp Formato Iniciativa Comunitaria v4Diego MuñozNessuna valutazione finora
- Articulo Lean Six Sigma - En.esDocumento15 pagineArticulo Lean Six Sigma - En.esAnonymous B4uxLk12GXNessuna valutazione finora
- Requisitos para Abrir Una GasolineraDocumento19 pagineRequisitos para Abrir Una GasolineraElmer Jesus Flores Mamani100% (2)
- FÁRMACOSDocumento31 pagineFÁRMACOSCamila Fernanda Velásquez WistubaNessuna valutazione finora
- Clara Ines Vosmediano Taller 1Documento5 pagineClara Ines Vosmediano Taller 1Cecilia CollazosNessuna valutazione finora
- 4-Formula Minima - MolecularDocumento25 pagine4-Formula Minima - MoleculardrlucioNessuna valutazione finora
- Gravitational Torsion Balance Manual AP 8215A EsDocumento22 pagineGravitational Torsion Balance Manual AP 8215A EsCube Head VNessuna valutazione finora
- Los Platos Tipicos Del Ecuador Mas Reclamados PorDocumento10 pagineLos Platos Tipicos Del Ecuador Mas Reclamados Pordayana velasquezNessuna valutazione finora
- Claus Ulas Seguro M TyDocumento92 pagineClaus Ulas Seguro M TyMisa DiazNessuna valutazione finora
- Caso Problema VaniaDocumento3 pagineCaso Problema Vaniaapi-520577254Nessuna valutazione finora
- 2.18 Trabajo en AlturaDocumento15 pagine2.18 Trabajo en AlturaSIG PROMAPNessuna valutazione finora
- Informe 2 - Cultivo S. Cerevisiae - DextrosaDocumento10 pagineInforme 2 - Cultivo S. Cerevisiae - Dextrosajosue hernandezNessuna valutazione finora
- Preguntas Practicas Tema 2Documento59 paginePreguntas Practicas Tema 2Saioa ArranzNessuna valutazione finora
- Resumen Ejecutivo Del Proyecto 'CONSTRUCCIÓN DEL SISTEMA DE AGUA POTABLE DE LA COMUNIDAD CERRO VERDE, PARROQUIA CIANO, CANTÓN PUYANGO"Documento101 pagineResumen Ejecutivo Del Proyecto 'CONSTRUCCIÓN DEL SISTEMA DE AGUA POTABLE DE LA COMUNIDAD CERRO VERDE, PARROQUIA CIANO, CANTÓN PUYANGO"Gobierno Provincial de Loja0% (1)
- Lista Libros PrekinderDocumento2 pagineLista Libros PrekinderJoselyn ArancibiaNessuna valutazione finora