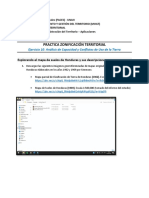
Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Inserto HI
Caricato da
Emilsa EsturbanCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Inserto HI
Caricato da
Emilsa EsturbanCopyright:
Formati disponibili
870300000 / 00 Pg.
1 de 4
SIGNIFICACION CLINICA
La enfermedad de Chagas es una infeccin parasitaria produ-
cida por el Trypanosoma cruzi. El diagnstico de laboratorio
depende del estadio en el cual se encuentre la enfermedad.
Durante la fase aguda, el diagnstico se efecta directamen-
te mediante la comprobacin de los parsitos en sangre o por
mtodos inmunolgicos que detecten anticuerpos especfi-
cos.
Durante la fase crnica, se pueden usar mtodos inmunolgi-
cos como la reaccin de aglutinacin de ltex, hemaglutina-
cin, aglutinacin directa, inmunofluorescencia y ltimamen-
te ELISA.
FUNDAMENTOS DEL METODO
La hemaglutinacin indirecta (HAI), tambin llamada hema-
glutinacin reversa pasiva, se basa en la propiedad que tie-
nen los anticuerpos (que en este caso son anti-T. cruzi) de
producir aglutinacin especfica en presencia de glbulos ro-
jos sensibilizados con los correspondientes antgenos.
En el suero existen anticuerpos inespecficos (heterfilos) que
son capaces de aglutinar glbulos rojos de distintas espe-
cies. Su presencia se investiga enfrentando el suero con GR
no sensibilizados. Los anticuerpos interferentes se eliminan
mediante tratamiento con 2-mercaptoetanol.
REACTIVOS PROVISTOS
Reconstituyente HAI: solucin fisiolgica tamponada a pH 7.
Antgeno HAI: liofilizado de glbulos rojos de carnero sensi-
bilizados con antgenos citoplasmticos de T. cruzi.
GR no sensibilizados: suspensin al 1% de eritrocitos de
carnero no sensibilizados, para control de heterofilia.
Buffer HAI: solucin fisiolgica tamponada con fosfatos a pH
7,5, con colorante inerte.
Solucin Proteica: solucin de albmina bovina al 10%.
2-Mercaptoetanol: ampolla con 2-mercaptoetanol (2-ME).
Control Positivo: suero inactivado conteniendo anticuerpos
contra Tripanosoma cruzi.
Control Negativo: suero no reactivo, inactivado.
REACTIVOS NO PROVISTOS
Solucin fisiolgica.
INSTRUCCIONES PARA SU USO
Antgeno HAI: preparar con 6,1 ml de Reconstituyente HAI.
Esperar una hora antes de usar mezclando cada 20 minutos
para permitir una correcta rehidratacin del reactivo. Cada vez
que se emplee, homogeneizar mediante agitacin evitando la
formacin de espuma.
Chagatest
Prueba de hemaglutinacin indirecta para la deteccin
de anticuerpos contra el Trypanosoma cruzi
HAI
GR no sensibilizados: homogeneizar mediante agitacin
antes de usar, evitando la formacin de espuma.
Diluyente de Sueros HAI: agregar 0,2 ml de Solucin Pro-
teica cada 10 ml de Buffer HAI. Mezclar, rotular y fechar.
2-Mercaptoetanol: una vez abierta la ampolla, trasvasar el
contenido al frasco vaco provisto, el que se deber tapar in-
mediatamente despus de usar.
2-Mercaptoetanol al 1%: con el 2-ME provisto, preparar una
dilucin 1/100 con solucin fisiolgica en cantidad suficiente
de acuerdo al nmero de pocillos que se utilicen. Ejemplo:
para 96 pocillos: 25 ul de 2-ME en 2,5 ml de solucin fisiol-
gica.
Controles Positivo y Negativo: listos para usar.
PRECAUCIONES
- Los Reactivos Provistos son para uso diagnstico "in vitro".
- Las muestras deben manipularse como si fueran capaces
de transmitir la infeccin.
- Los sueros controles han sido examinados para antgeno de
superficie de hepatitis B (HBsAg) y virus de inmunodeficien-
cia humana (HIV) encontrndose no reactivos. Sin embargo
deben emplearse como si se tratara de material infectivo.
- Todos los materiales empleados en el ensayo deben ser
destruidos a fin de asegurar la inactivacin de agentes pat-
genos. El mtodo recomendado por este procedimiento es
autoclavar durante 1 hora a 121
o
C. Los lquidos de desecho
pueden ser desinfectados con hipoclorito de sodio (concen-
tracin final 5%) durante por lo menos 60 minutos.
- No intercambiar reactivos de distintos equipos y lotes.
ESTABILIDAD E INSTRUCCIONES DE
ALMACENAMIENTO
Reactivos Provistos: son estables en refrigerador (2-10
o
C)
hasta la fecha de vencimiento indicada en la caja. No congelar.
Diluyente de Sueros HAI: es estable en refrigerador (2-10
o
C)
5 das a partir de la fecha de su preparacin.
2-Mercaptoetanol al 1%: usar inmediatamente despus de
preparado.
Antgeno HAI: una vez reconstituido es estable durante 2
meses conservado en refrigerador (2-10
o
C). No congelar.
INDICIOS DE INESTABILIDAD O DETERIORO DE LOS
REACTIVOS
- Cuando todas las diluciones de sueros son reactivas, pue-
de ser indicio de autoaglutinacin del Antgeno HAI. Verifi-
car destinando un pocillo de la policubeta para mezclar
Antgeno HAI y Diluyente de Sueros HAI, sin la Muestra.
Si an en este caso se observa aglutinacin, el reactivo
C
870300000 / 00 Pg. 2 de 4
estar deteriorado. Desechar.
- La ausencia de reactividad en todas las diluciones de sue-
ros, puede ser indicio de deterioro de los reactivos. Proce-
sar Muestra con positividad conocida.
MUESTRA
Suero
a) Recoleccin: el paciente debe estar preferentemente en
ayunas. Obtener suero de la manera usual. No usar plasma.
b) Aditivos: no se requieren. No agregar conservadores.
c) Sustancias interferentes conocidas: hemlisis o hiperli-
pemia (con quilomicronemia) producen resultados errneos.
d) Estabilidad e instrucciones de almacenamiento: el sue-
ro debe ser preferentemente fresco. En caso de no procesar-
se en el momento, puede conservarse en el refrigerador (2-
10
o
C) durante no ms de 72 hs contadas a partir del momento
de la extraccin. Para perodos ms prolongados de conserva-
cin, congelar (a -20
o
C), evitando reiterar tal procedimiento.
Los sueros envejecidos tienden a gelificarse al contacto con
el 2-ME, provocando resultados falsos positivos.
MATERIAL REQUERIDO
1- Provisto
- 1 frasco vaco (para trasvasar el 2-ME de la ampolla)
- 5 policubetas con 96 pocillos de fondo en U
- Accesorios
2- No provisto
- microdilutores (25 ul) o micropipetas automticas (25 ul)
- microgoteros (25 ul)
- tubos de ensayo y material volumtrico adecuado
- cinta adhesiva
- papel de filtro
RECOMENDACIONES PREVIAS
Microdilutores
- Acondicionamiento previo: antes de usar los microdilutores,
sumergirlos en un recipiente con agua destilada y apoyar-
los sobre papel de filtro para asegurar una correcta toma de
la muestra.
- Lavado: antes de tomar una nueva muestra con los microdi-
lutores, descargar el volumen residual sobre papel de filtro.
Luego pasarlos sucesivamente por dos recipientes con agua
destilada y apoyarlos sobre papel de filtro.
Policubeta
Para eliminar la carga electrosttica es necesario pasar un
trapo hmedo por la base de la misma.
PROCEDIMIENTO
Seleccionar una policubeta con pocillos sin usar de fondo
en U.
I- TITULACION SIN 2-ME
1- Con microgotero de 25 ul, colocar una gota de Dilu-
yente de Sueros HAI en todos los pocillos a usar de la
policubeta.
2- Tomar una alcuota de cada suero a ensayar con mi-
crodilutores de 25 ul (uno para cada muestra). Colocar
cada microdilutor en el primer pocillo y rotarlo por lo
menos 10 veces para asegurar una correcta dilucin de
la muestra.
3- Realizar diluciones seriadas a partir del primer poci-
llo (dilucin 1/2), pasando los microdilutores al pocillo
siguiente (dilucin 1/4) y as sucesivamente hasta la
dilucin que se desea investigar (por ejemplo: 1/8, 1/16,
1/32), rotando en cada paso el microdilutor por lo me-
nos 10 veces para asegurar una correcta dilucin de la
muestra. Si se emplea una micropipeta automtica de
25 ul para la toma y/o dilucin de la muestra, homoge-
neizar por carga y descarga. Transferir 25 ul de pocillo a
pocillo hasta la dilucin que se desee investigar. Des-
cartar los ltimos 25 ul.
4- Colocar en los pocillos conteniendo las diluciones 1/2
y 1/4, una gota (25 ul) de GR no sensibilizados para con-
trol de heterofilia.
5- En el resto de los pocillos, agregar una gota (25 ul)
de Antgeno HAI.
6- Mezclar aplicando suaves golpes en los laterales de
la policubeta.
7- Dejar en reposo, a resguardo de vibraciones, durante
90 minutos.
8- Leer a partir de los 90 minutos.
Se puede aumentar la nitidez de la apreciacin, leyen-
do sobre un espejo, iluminando la placa desde arriba e
interponiendo un papel blanco y traslcido entre la poli-
cubeta y la fuente de luz.
II- TITULACION CON 2-ME
1- Colocar una gota de suero en el primer pocillo em-
pleando goteros plsticos descartables, mantenindo-
los en posicin vertical (uno por cada suero).
2- Diluir al 1/2 agregando una gota de 2-Mercaptoetanol
al 1% a los mismos pocillos (utilizar un nico gotero
descartable).
3- Sellar estos pocillos con cinta adhesiva y mezclar apli-
cando suaves golpes en los laterales de la policubeta.
4- Incubar 30-60 minutos a 37
o
C o 90 minutos a tempe-
ratura ambiente.
5- Retirar la cinta adhesiva, pasar un trapo hmedo por
la base de la policubeta y, con microgotero de 25 ul,
colocar una gota de Diluyente de Sueros HAI en los
restantes pocillos a utilizar hasta la dilucin deseada.
6- Realizar los pasos 3 a 8 descriptos en la Titulacin I.
III- ABSORCION CON GLOBULOS ROJOS
NO SENSIBILIZADOS
En sueros que presenten heterofilia los anticuerpos he-
terfilos pueden adsorberse sobre GR no sensibiliza-
dos de la siguiente forma: en un tubo de hemlisis colo-
car 50 ul de GR no sensibilizados provistos + 50 ul de
suero en ensayo. Tapar para evitar la evaporacin. Dejar
la suspensin durante 30 minutos a 37
o
C agitando ex-
temporneamente. Luego centrifugar a 2000 rpm duran-
te 5 minutos. Del sobrenadante se toman 50 ul y se
emplea como dilucin 1/2, colocndola en el primer po-
cillo. Si se emplea en titulacin con 2-ME este pocillo
corresponde a dilucin 1/4.
870300000 / 00 Pg. 3 de 4
IMAGEN POSITIVA IMAGEN NEGATIVA
IMAGEN DUDOSA
VALORES DE REFERENCIA
Dentro de las tcnicas inmunolgicas, la HAI es considerada
un mtodo confiable para la determinacin de anticuerpos es-
pecficos. No obstante sus resultados, al igual que los de cual-
quier mtodo serolgico, slo constituyen un dato auxiliar para
el diagnstico. Es por esta razn que los informes deben ser
considerados en trminos de probabilidad. En este caso, ma-
yor o menor probabilidad de parasitosis por T. cruzi.
Cualquier resultado Reactivo debe ser verificado por otra tc-
nica. Recordar el criterio recomendado por el Instituto Fatala
Chaben, segn el cual el inmunodiagnstico de la infeccin
deber hacerse con un mnimo de dos de los siguientes m-
todos: inmunofluorescencia indirecta, hemaglutinacin indirec-
ta, ELISA, aglutinacin de partculas (ltex), debidamente va-
lidados por el Centro Nacional de Referencia.
Procedimiento de titulacin
Sueros con ttulos mayores o iguales a 1/16, se consideran
reactivos para anticuerpos anti-T. cruzi.
Cuando se observan resultados positivos (sueros reactivos) y
adems se presenta manto en los pocillos destinados a con-
trol de heterofilia (diluciones 1/2 y 1/4), debe realizarse otra
titulacin con los sueros correspondientes pero previamente
tratados con 2-ME o adsorbidos con GR no sensibilizados. El
propsito de estos tratamientos es eliminar la reaccin ines-
pecfica. En el primer caso el agente reductor (2-ME) elimina
la capacidad aglutinante de los anticuerpos heterfilos, mien-
tras que los GR no sensibilizados los elimina por adsorcin.
Tcnica de screening o descarte por 1 ttulo
En las condiciones del ensayo, sueros con ttulos mayores o
iguales a 1/12, se consideran reactivos para anticuerpos anti-
T.cruzi. La imagen que presenta un suero reactivo es de pel-
cula o manto en el fondo del pocillo.
CONTROL DE CALIDAD
Como punto de referencia de la reaccin, pueden procesarse
simultneamente un Control Positivo y un Control Negativo
utilizndolos de la misma manera que la muestra.
LIMITACIONES DEL PROCEDIMIENTO
Ver Sustancias interferentes conocidas en MUESTRA.
Otras causas de resultados errneos son:
- Falta de acondicionamiento de la policubeta y los microdilu-
tores (Ver RECOMENDACIONES PREVIAS).
- Policubetas rayadas por uso reiterado. No se aconseja reuti-
lizar pocillos.
- Falta de homogeneizacin de los reactivos antes de su uso.
- Deficiencias de mezclado.
INTERPRETACION DE LOS RESULTADOS
No reactivo: presencia de un sedimento en forma de botn
o pequeo anillo de bordes regulares.
Reactivo: formacin de una pelcula o manto que cubre el
50% o ms del fondo de los pocillos. Si no se usan microdi-
lutores, la imagen del manto puede ser ms pequea.
(1) Manto.
(2) Punto final (50%).
TECNICA SCREENING O DESCARTE POR 1 TITULO
PROCEDIMIENTO
1- Con microgotero de 25 ul, colocar una gota de Diluyen-
te de Sueros HAI en todos los pocillos a utilizar de la
policubeta (un pocillo por cada muestra).
2- Sumergir un ansa limpia (provista) en la muestra.
3- Colocar el ansa cargada en el pocillo que contiene el
Diluyente de Sueros HAI, rotando la misma para obtener
un buen mezclado y distribuir la gota sobre todo el fondo
del pocillo. Retirar el ansa y secarla con papel de filtro,
lavar en dos recipientes con agua destilada. Secar nueva-
mente con papel de filtro. Proceder de la misma manera
para cada nueva muestra.
4- Agregar con microgotero de 25 ul, una gota de Antge-
no HAI reconstituido y homogeneizado a cada pocillo.
5- Agitar la policubeta golpeando con los dedos en las
paredes laterales, durante 30 segundos por lo menos, para
asegurar un buen mezclado.
6- Dejar reposar, al resguardo de vibraciones durante 2
horas.
7- Efectuar la lectura. En caso de que la lectura de los
resultados se efecte en un plazo mayor de 2 horas, la
policubeta deber taparse con una cinta adhesiva trans-
parente para evitar evaporaciones.
INTERPRETACION DE LOS RESULTADOS
No reactivo: presencia de un sedimento en forma de botn.
Reactivo: formacin de una pelcula o manto en el fondo de
los pocillos. En caso de observar la presencia de un pequeo
anillo de bordes regulares, la muestra se considerar dudosa
y deber ser ensayada por otro mtodo.
(1) (2)
IMAGEN NEGATIVA
IMAGEN POSITIVA
870300000 / 00 Pg. 4 de 4
- Vibraciones accidentales durante el reposo necesario para
el desarrollo de la reaccin.
- Sueros envejecidos o congelados y descongelados repeti-
damente.
- Contaminaciones accidentales de los reactivos o del mate-
rial empleado en el ensayo.
- Exceso o defecto de Diluyente de Sueros HAI en los poci-
llos de la policubeta.
- Diluyente de Sueros HAI que tenga ms de 5 das de prepa-
racin.
- No respetar los tiempos y temperaturas de incubacin en el
tratamiento con 2-ME al 1%.
- 2-Mercaptoetanol al 1% no preparado en el momento.
PERFORMANCE
Trabajos experimentales realizados sobre muestras poblacio-
nales endmicas y no endmicas, mostraron que:
1) En poblaciones endmicas, empleando el mtodo de HAI,
el 98% de los ttulos menores a 1/8 y el 95% de los ttulos
mayores o iguales a 1/8 fueron confirmados por los mtodos
tomados como referencia.
2) En poblaciones no endmicas, el 100% de los individuos
sanos present ttulos menores a 1/8 determinados por HAI.
3) En el 100% de los individuos con serologa positiva confir-
mada por los mtodos tomados como referencia y con para-
sitosis demostrada por xenodiagnstico y/o hemocultivo, se
observaron ttulos mayores o iguales a 1/32 determinados con
Chagatest HAI.
PRESENTACION
- 96 determinaciones de 5 ttulos o 480 de un ttulo
(Cd. 1293205)
BIBLIOGRAFIA
- Mazza, S. - VI Congreso Nacional de Medicina (Crdoba),
pg. 155 (1938).
- Cerisola, J.A. - La Prensa Mdica Argentina 49/34:1761
(1962).
- Fontenla S., Moretti, E. y Gonzlez, G. - 50 Triduo de la
ABA, Huerta Grande (Crdoba), 1985.
- Basso, A. y col. - 50 Triduo de la ABA. Huerta Grande
(Crdoba), 1985.
- Lorenzo , L.; Capriotti, G.; Rojkn, F. - Rev. Arg. Transf. XVII/
1: 51, 1991.
- Ministerio de Salud y Accin Social, Instituto Nacional de
Parasitologa "Doctor Mario Fatala Chabn" - Normas para
el diagnstico de la infeccin chagsica - Resolucin minis-
terial 523/97, 1998.
2000 Rosario - Argentina
Wiener lab.
M Wiener Laboratorios S.A.I.C.
Riobamba 2944
2000 - Rosario - Argentina
http://www.wiener-lab.com.ar
Dir. Tc.: Viviana E. Ctola
Bioqumica
Producto Autorizado A.N.M.A.T.
Disp. N: 1280/88 3403/95-6862/01
h
C
Este producto cumple con los requerimientos previstos
por la Directiva Europea 98/79 CE de productos sanita-
rios para el diagnstico "in vitro"
P
Representante autorizado en la Comunidad Europea
V
Uso diagnstico "in vitro"
X
Contenido suficiente para <n> ensayos
H
Fecha de caducidad
l
Lmite de temperatura (conservar a)
No congelar
F
Riesgo biolgico
Volumen despus de la reconstitucin
Contenido Cont.
g Nmero de lote
M
Elaborado por:
Nocivo
Xn
Corrosivo / Castico
Irritante
Xi
i
Consultar instrucciones de uso
Calibrador Calibr.
Control b
b Control Positivo
c Control Negativo
Nmero de catlogo
Los siguientes smbolos se utilizan en todos los kits de
reactivos para diagnstico de Wiener lab.
?
EXPLICACION DE LOS SIMBOLOS
Antgeno HAI Buffer HAI
Antgeno HAI Buffer HAI
Reconstituy. HAI GR no sensib.
Reconstituyente HAI GR no sensibilizados
Sol. Proteica 2-ME
Solucin Proteica 2-Mercaptoetanol
Control + Control -
Control Positivo Control Negativo
UR110516
Potrebbero piacerti anche
- HIV Ag/Ac ELISA 4GDocumento6 pagineHIV Ag/Ac ELISA 4GdatitoxNessuna valutazione finora
- 6374 Chagatest Elisa SPDocumento3 pagine6374 Chagatest Elisa SPMaría José QuirozNessuna valutazione finora
- RPR CarbonDocumento2 pagineRPR CarbonEmily0% (1)
- AntiestreptolisinasDocumento9 pagineAntiestreptolisinasVictor Hugo Rueda RojasNessuna valutazione finora
- Entamoeba HistolyticaDocumento9 pagineEntamoeba HistolyticaOrlando CruzNessuna valutazione finora
- EgoDocumento17 pagineEgoCynthiaNessuna valutazione finora
- Evolución Histórica - Toxicología Parte IDocumento40 pagineEvolución Histórica - Toxicología Parte Ivalentina100% (2)
- A1C-2 EsDocumento7 pagineA1C-2 EsJose Carlos Parras CasasNessuna valutazione finora
- MacrodantinaDocumento8 pagineMacrodantinaangelicaNessuna valutazione finora
- Citoquimico Liq. PleuralDocumento1 paginaCitoquimico Liq. PleuralRuth Alejandra Chacon CuadroNessuna valutazione finora
- Farmacología respiratoriaDocumento13 pagineFarmacología respiratoriaWilliam César GómezNessuna valutazione finora
- BANCO DE PREGUNTAS (1) (1) Analisis ClinicoDocumento9 pagineBANCO DE PREGUNTAS (1) (1) Analisis Clinicocelia Gutiérrez Mamani100% (1)
- CCM-003-PR Preparación de Medios de CultivoDocumento16 pagineCCM-003-PR Preparación de Medios de CultivopaolaNessuna valutazione finora
- Chagatest Elisa LisadoDocumento7 pagineChagatest Elisa LisadoGerman YaibonaNessuna valutazione finora
- Determinacion de UreaDocumento4 pagineDeterminacion de UreaGerson Saúl Pumapillo RojasNessuna valutazione finora
- Bilirrubina total y directa: método, valores de referenciaDocumento1 paginaBilirrubina total y directa: método, valores de referenciaLina Marcela Meza AcostaNessuna valutazione finora
- Emulsiones farmacéuticas: Cálculo HLB mezclas emulgentesDocumento2 pagineEmulsiones farmacéuticas: Cálculo HLB mezclas emulgentesrobertNessuna valutazione finora
- 1 WidalDocumento2 pagine1 WidalHans YoveraNessuna valutazione finora
- Tecno FarmaDocumento4 pagineTecno FarmaGilberto AguilaNessuna valutazione finora
- Determinación de albúmina en sueroDocumento1 paginaDeterminación de albúmina en sueroVeronica SantanderNessuna valutazione finora
- Guia Rapida Panel MEDocumento2 pagineGuia Rapida Panel MErolan.olivaresNessuna valutazione finora
- MicrobiologiaDocumento5 pagineMicrobiologiaபலோமா கசபோனாNessuna valutazione finora
- LicapsDocumento14 pagineLicapsborisNessuna valutazione finora
- Clase 1. Fase Pre Analítica HemocultivosDocumento42 pagineClase 1. Fase Pre Analítica HemocultivosRobert Caballero BardalesNessuna valutazione finora
- Introducción al laboratorio de microbiologíaDocumento12 pagineIntroducción al laboratorio de microbiologíaEl GeorgeNessuna valutazione finora
- Citologia de Moco FecalDocumento3 pagineCitologia de Moco FecalEli HinojosaNessuna valutazione finora
- RrPOE - unieTAR.005.Antibiograma Por Disco Difusión (Kirby-Bauer)Documento12 pagineRrPOE - unieTAR.005.Antibiograma Por Disco Difusión (Kirby-Bauer)Diego CushicóndorNessuna valutazione finora
- INSERTO Tiempo - Trombina - SPDocumento9 pagineINSERTO Tiempo - Trombina - SPSantiago Sarria VarelaNessuna valutazione finora
- Bilirrubina Total AA WienerDocumento12 pagineBilirrubina Total AA WienerBioquimiNessuna valutazione finora
- Helicobacter pylori Ab prueba rápidaDocumento2 pagineHelicobacter pylori Ab prueba rápidaKatia BalderasNessuna valutazione finora
- Rotavirus: test inmunocromatográfico simple y rápidoDocumento13 pagineRotavirus: test inmunocromatográfico simple y rápidoBiomedical Cia LtdaNessuna valutazione finora
- CK NAC Liquiform 117 EspDocumento6 pagineCK NAC Liquiform 117 EspRosa Marcela PontonNessuna valutazione finora
- AlbúminaDocumento2 pagineAlbúminaUkeNessuna valutazione finora
- Sangre OcultaDocumento4 pagineSangre OcultaLisseth RumancelaNessuna valutazione finora
- Cultivo Agar Mueller HintonDocumento3 pagineCultivo Agar Mueller HintonAlberto Misme LucanaNessuna valutazione finora
- Metformina Glibenclamida EstudioDocumento19 pagineMetformina Glibenclamida EstudiotatianaNessuna valutazione finora
- IFU ASO Latex MonlabtestDocumento2 pagineIFU ASO Latex MonlabtestBady MagneNessuna valutazione finora
- Tecnicas InmunohematologicasDocumento28 pagineTecnicas InmunohematologicasAlberto Palomino HuarhuaNessuna valutazione finora
- 6357 Uremia SPDocumento3 pagine6357 Uremia SPDaniela Magalí SotoNessuna valutazione finora
- Listados de Precios San Miguel 2023Documento7 pagineListados de Precios San Miguel 2023Elias AranivaNessuna valutazione finora
- Urea Uv Cinetica Aa SPDocumento3 pagineUrea Uv Cinetica Aa SPWilliam Apaza MamaniNessuna valutazione finora
- Formulario de Balanza PDFDocumento8 pagineFormulario de Balanza PDFLuden Javier Dávila AcuñaNessuna valutazione finora
- Manual de plaquetoaféresis: selección del donante y procedimientoDocumento36 pagineManual de plaquetoaféresis: selección del donante y procedimientoPatricia MolinaNessuna valutazione finora
- Azul de Metileno InsertoDocumento3 pagineAzul de Metileno InsertoJaqueline JohanaNessuna valutazione finora
- PT Inserto Biochemical Enterprise TraducidoDocumento5 paginePT Inserto Biochemical Enterprise TraducidoQf Jhon DonadoNessuna valutazione finora
- Medición glucosa suero plasma líquido cefalorraquídeoDocumento1 paginaMedición glucosa suero plasma líquido cefalorraquídeolisandridNessuna valutazione finora
- Inserto Boditech Tn-IDocumento6 pagineInserto Boditech Tn-IEdward AC KenwayNessuna valutazione finora
- Proteinas Totales Aa SPDocumento3 pagineProteinas Totales Aa SPAngie ToalaNessuna valutazione finora
- Virus ARN de Importancia ClínicaDocumento27 pagineVirus ARN de Importancia ClínicaLauraMartínez100% (2)
- CA Arsenazo Liquiform 95 EspDocumento6 pagineCA Arsenazo Liquiform 95 Espelsa ramirezNessuna valutazione finora
- Practica 1Documento14 paginePractica 1hippy_cheNessuna valutazione finora
- Flujo de trabajo pre-analítico del uroanálisisDocumento3 pagineFlujo de trabajo pre-analítico del uroanálisisAndy Zambrano100% (1)
- Glicerolado para grietasDocumento6 pagineGlicerolado para grietasLuiz MiguelNessuna valutazione finora
- RPR-CARBON: Determinación cualitativa y semicuantitativa de reaginas plasmáticasDocumento4 pagineRPR-CARBON: Determinación cualitativa y semicuantitativa de reaginas plasmáticasAndrea CardeñaNessuna valutazione finora
- Inserto Hai Toxo PolychacoDocumento6 pagineInserto Hai Toxo PolychacoKarla Montaño JaldinNessuna valutazione finora
- Toxotest Hai SPDocumento4 pagineToxotest Hai SPveronica1570Nessuna valutazione finora
- Inserto HAI CHAGAS POLYCHACODocumento5 pagineInserto HAI CHAGAS POLYCHACOARIEL MAM,ANINessuna valutazione finora
- 9477 Chagatest Elisa Recombinante v4 0 SPDocumento4 pagine9477 Chagatest Elisa Recombinante v4 0 SPEmilsa EsturbanNessuna valutazione finora
- Hiv 1y2 Elisa 3a Generacion SPDocumento5 pagineHiv 1y2 Elisa 3a Generacion SPdatitoxNessuna valutazione finora
- Chagatest Elisa Recombinante v3 0 SPDocumento4 pagineChagatest Elisa Recombinante v3 0 SPJUAN PABLO CAREAGA MONTECINOSNessuna valutazione finora
- Pintura Asfáltica P - Circulares TecnicasDocumento2 paginePintura Asfáltica P - Circulares TecnicasEmilsa EsturbanNessuna valutazione finora
- Resultados Pratica 1 y 5 SistemasDocumento1 paginaResultados Pratica 1 y 5 SistemasEmilsa EsturbanNessuna valutazione finora
- 2 Anticorrosivo Secado RapidoDocumento1 pagina2 Anticorrosivo Secado RapidoEmilsa EsturbanNessuna valutazione finora
- Catalog Spanish Chem Pro Line Dec 2013Documento12 pagineCatalog Spanish Chem Pro Line Dec 2013Emilsa EsturbanNessuna valutazione finora
- OracionesDocumento2 pagineOracionesEmilsa EsturbanNessuna valutazione finora
- 9477 Chagatest Elisa Recombinante v4 0 SPDocumento6 pagine9477 Chagatest Elisa Recombinante v4 0 SPEmilsa EsturbanNessuna valutazione finora
- Manual OSHA 29 CFR 1910 Industria GeneralDocumento217 pagineManual OSHA 29 CFR 1910 Industria GeneralKaede Rukawa89% (9)
- 01-Industria General - 44.29Documento7 pagine01-Industria General - 44.29Emilsa EsturbanNessuna valutazione finora
- Chagatest Elisa Lisado SPDocumento6 pagineChagatest Elisa Lisado SPEmilsa EsturbanNessuna valutazione finora
- 9477 Chagatest Elisa Recombinante v4 0 SPDocumento6 pagine9477 Chagatest Elisa Recombinante v4 0 SPEmilsa EsturbanNessuna valutazione finora
- 9477 Chagatest Elisa Recombinante v4 0 SPDocumento4 pagine9477 Chagatest Elisa Recombinante v4 0 SPEmilsa EsturbanNessuna valutazione finora
- Análisis instrumentalDocumento9 pagineAnálisis instrumentalEmilsa Esturban80% (5)
- Manual Enfermedades ChagasDocumento104 pagineManual Enfermedades ChagasnayidNessuna valutazione finora
- Manual - Laboratorio de Microbiologia de Suceptibilidad A Los Nos y de BacteriasdDocumento410 pagineManual - Laboratorio de Microbiologia de Suceptibilidad A Los Nos y de Bacteriasdquimico clinico 2795% (39)
- Mi familia y yo serviremos al SeñorDocumento1 paginaMi familia y yo serviremos al SeñorEmilsa Esturban0% (2)
- Efecto FotoelectricoDocumento5 pagineEfecto FotoelectricoEmilsa EsturbanNessuna valutazione finora
- CuanticaDocumento19 pagineCuanticaEmilsa EsturbanNessuna valutazione finora
- Croma Color Antes Artificiales TesisDocumento52 pagineCroma Color Antes Artificiales TesisEmilsa EsturbanNessuna valutazione finora
- Efecto FotoelectricoDocumento5 pagineEfecto FotoelectricoEmilsa EsturbanNessuna valutazione finora
- Cuadernillo Matematicas 1º BasicoDocumento30 pagineCuadernillo Matematicas 1º BasicoGrace Rescatada Para Adorar100% (1)
- TuberculosisDocumento15 pagineTuberculosisEmilsa EsturbanNessuna valutazione finora
- Cómo Escribir Un Artículo CientíficoDocumento20 pagineCómo Escribir Un Artículo CientíficoJhoan Giraldo QuirozNessuna valutazione finora
- Valvula de Sobre Presion Comen 80T 1010719Documento7 pagineValvula de Sobre Presion Comen 80T 1010719Christian ChdNessuna valutazione finora
- Ficha Tecnica Mant Eq Ind 2021Documento29 pagineFicha Tecnica Mant Eq Ind 2021ALKZ PerezNessuna valutazione finora
- Conócete y ámate en 30 díasDocumento4 pagineConócete y ámate en 30 díasCarolina Rojas FonsecaNessuna valutazione finora
- PANZACCHI Zina FernándezDocumento121 paginePANZACCHI Zina FernándezGabriela SosaNessuna valutazione finora
- Camasca Cabrera Edgar JoshuaDocumento1 paginaCamasca Cabrera Edgar JoshuaJoshua CamascaNessuna valutazione finora
- Viaje A La Luna (Información)Documento15 pagineViaje A La Luna (Información)3M1N3MNessuna valutazione finora
- 10 - Capacidad de Uso y Conflicto de Uso de La TierraDocumento27 pagine10 - Capacidad de Uso y Conflicto de Uso de La Tierra96400202Nessuna valutazione finora
- GUIA EcopsosDocumento8 pagineGUIA EcopsosDescanso LeonNessuna valutazione finora
- Administración de La Producción (Glosario)Documento5 pagineAdministración de La Producción (Glosario)maria angelica alvarez meloNessuna valutazione finora
- Gestión de Pavimentos - Carlos MoránDocumento53 pagineGestión de Pavimentos - Carlos Moránnorbertopercara100% (1)
- Boom LatinoamericanoDocumento4 pagineBoom LatinoamericanoChaeyoung ParkNessuna valutazione finora
- La filosofía de Peter M. Senge y su Quinta DisciplinaDocumento23 pagineLa filosofía de Peter M. Senge y su Quinta DisciplinaCristinaGutiérrezDeSanchez100% (1)
- Análisis de La Película de Lutero PDFDocumento3 pagineAnálisis de La Película de Lutero PDFRonyHuamaniTincoNessuna valutazione finora
- Manual Curso RedesDocumento215 pagineManual Curso RedesOtro CorreoNessuna valutazione finora
- Informe Rendicion Cuenta 1651267606843.97Documento23 pagineInforme Rendicion Cuenta 1651267606843.97Javier MendozaNessuna valutazione finora
- Copia de Boquitas 2020Documento11 pagineCopia de Boquitas 2020Sergio Luis KomNessuna valutazione finora
- Plantillas de MarketingDocumento7 paginePlantillas de MarketingLourdes Rios HuatangariNessuna valutazione finora
- Domingo 19 de Diciembre de 2021 ¿Quién Soy para Que La Madre de Mi Señor Venga A VermeDocumento3 pagineDomingo 19 de Diciembre de 2021 ¿Quién Soy para Que La Madre de Mi Señor Venga A VermeJosé Antonio Morales EscobarNessuna valutazione finora
- Medicina Preventiva Actividad 5Documento8 pagineMedicina Preventiva Actividad 5Juan David GonzalezNessuna valutazione finora
- Empalmadora FSM-60S-españolDocumento132 pagineEmpalmadora FSM-60S-españolyedaro67% (3)
- ModelosDocumento7 pagineModeloscartaNessuna valutazione finora
- La GlobalizacionDocumento5 pagineLa GlobalizacionMartin GuamanNessuna valutazione finora
- LÓGICA22-23-T2-Tema V InferenciaDocumento18 pagineLÓGICA22-23-T2-Tema V InferenciaAlexander GonzalezNessuna valutazione finora
- Mantenimiento-SistemaCombustibleDocumento16 pagineMantenimiento-SistemaCombustibleLeonardo LopezNessuna valutazione finora
- La Armadura de ElohimDocumento10 pagineLa Armadura de ElohimAntezanaFernando50% (2)
- Roadmap Cultura PI13 v2.0Documento5 pagineRoadmap Cultura PI13 v2.0Karen Saavedra RevattaNessuna valutazione finora
- En Busqueda de La FelicidadDocumento7 pagineEn Busqueda de La FelicidadVanessa DagandNessuna valutazione finora
- Cómo proteger tu información en InternetDocumento5 pagineCómo proteger tu información en InternetASAHEL GABRIEL GALAN LOPEZNessuna valutazione finora
- C.V Josue Soto ZapanaDocumento9 pagineC.V Josue Soto ZapanaAnonymous NFfl9UNessuna valutazione finora