Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Informe 1. Estandarizacion Soluciones
Caricato da
Luciano Lizarazo100%(1)Il 100% ha trovato utile questo documento (1 voto)
1K visualizzazioni8 pagineCopyright
© © All Rights Reserved
Formati disponibili
DOCX, PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
100%(1)Il 100% ha trovato utile questo documento (1 voto)
1K visualizzazioni8 pagineInforme 1. Estandarizacion Soluciones
Caricato da
Luciano LizarazoCopyright:
© All Rights Reserved
Formati disponibili
Scarica in formato DOCX, PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 8
UNIDADES TECNOLGICAS DE SANTANDER
INFORME DE LABORATORIO DE AGUAS
IDENTIFICACIN
TITULO DEL EXPERIMENTO Estandarizacin de Soluciones
GRUPO: A142 DOCENTE: Claudia Hernndez Galvn
AUTOR (ES)
Luciano Lizarazo Len Cd. 1095932709
Humberto Jos Manrique Guarn Cd.1098769287
RESUMEN
A partir de esta prctica, se logro conocer la concentracin real de un acido y una base el
HCL y el NaOH, en el caso del NaOH se utilizo como sustancia patrn el Ftalato acido de
potasio, utilizando el mtodo de titulacin se obtuvo como resultado una concentracin de
la base de 0.22N y 0.16N de acido, con un factor de correccin para el NaOH de 1.11
CLCULOS Y RESULTADOS.
Para la realizacin de esta prctica se trabajo con dos sustancias, el HCL y el NaOH
Estandarizacin solucin de NaOH:
Se preparo la solucin de NaOH con una normalidad terica de 0.20N en 100mL, se utilizo
el Ftalato acido de potasio como sustancia patrn con una masa de 0.4368g y un peso
molecular de 204.23 g/mol, y como indicador la fenolftalena.
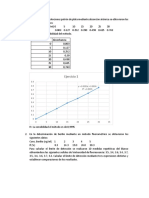
Se calcularon los ml tericos de NaOH que deberan usarse mediante la frmula:
mL tericos NaOH= mg de Ftalato pesado/ pe Ftalato = 436.8mg Ftalato/ 204.23g Ftalato
N Terica 0.20N
mL tericos NaOH= 10.69mL
Experimentalmente se utilizaron 9.6 mL de NaOH para la titulacin por lo tanto se
debe usar un factor de correccin.
Factor correccin= mL NaOH Tericos/ mL NaOH experimentales= 10.69ml/9.6ml
Factor correccin= 1.11
Una vez obtenido el factor de correccin se puede determinar la concentracin real
del NaOH
N real = N terica x factor de correccin
N real NaOH= 0.22N
Estandarizacin solucin de HCL
Se preparo la solucin de HCL con una normalidad terica de 0.18N en 50mL, en el
erlenmeyer se tienen 10 ml de HCL de concentracin desconocida junto con 20 mL de
agua destilada y 3 gotas de fenolftalena.
Se tiene la bureta con solucin de NaOH y la concentracin tomada anteriormente que fue
de 0.22N, se efecta el mtodo de titulacin dejando caer gota a gota la base sobre el
acido, hasta obtener una coloracin rosa plida
Se toma nota de los mL de NaOH utilizados hasta titular que fue de 7.2 mL y se
procede a conocer la concentracin de HCL diluida a partir de la ley de las
diluciones
V x C = V' x C'
C= V' x C' / V
C= 7.2mL x 0.22N / 10mL = 0.16N
obteniendo una concentracin de HCL mas diluida de 0.16N
ANLISIS DE RESULTADOS.
Conocer la concentracin real de una sustancia es de suma importancia para la realizacin
de cualquier actividad qumica, pues las sustancias no son el 100% puras y dependiendo
la cantidad de soluto se pueden obtener soluciones ms o menos concentradas, se sabe
que a medida que se aumente la cantidad de soluto la solucin ser ms concentrada pues
son directamente proporcionales.
Para conocer la concentracin de las soluciones se utilizo la titulacin por mtodo
volumtrico.
Por qu se debe obtener un color rosa plido en la titulacin ?
Se sabe que la normalidad es til porque podemos conocer a partir de ella la cantidad de
equivalente gramos de sustancia, un equivalente de un acido neutraliza completa y
precisamente un equivalente de una base , ya que un mol H+ reaccionara con un mol de
OH- , por lo tanto a partir de acido se puede conocer la cantidad exacta de base que se
necesita o viceversa hasta obtener una tonalidad rosa plida que expresa el equilibrio que
existe entre el acido y la base utilizadas, la fenolftalena nos indicara el color rosa plido
puesto que esta es incolora en medio acido y al irle agregando base se llegara a una pH de
8.2 que vira a rosa plido que debe persistir agitando adecuadamente.
La concentracin obtenida de NaOH fue de 0.22N, si se compara con la teorica que
fue de 0.20N, se puede decir que se uso mayor cantidad de soluto.
La concentracin obtenida de HCL fue de 0.16N, se si compara con la terica que
fue de 0.18N, se puede decir que se obtuvo una solucin ms diluida debido a la
cantidad de base utilizada
CONCLUSIONES.
1. A medida que se utilize mas soluto mayor ser el grado de
concentracin de la solucin pues son directamente proporcionales
2. Se obtuvo una concentracin real de NaOH de 0.22N mayor a la
terica de 0.20N
3. Se obtuvo una concentracin real de HCL de 0.16N menor a la terica
de 0.18N, esto se da para mantener el equilibrio en la reaccin.
4. La fenolftalena en medio acido es incolora, al agregarle la cantidad de
base ideal esta tomara una tonalidad rosa plida que nos indica el
equilibrio (pH 8.2) existente entre el acido y la base usada.
REFERENCIAS BIBLIOGRFICAS
ROMERO, Jairo. Calidad del Agua. Mc Graw Hill, segunda edicin, pgs. 23 y 24.
Universidad Tecnolgica Nacional (UTN), Volumetra de neutralizacin, (.DOC), citado el
24 de febrero de 2013, disponible en la web:
http://www.frsf.utn.edu.ar/matero/visitante/bajar_tp.php?id_catedra=169&id_trabajo=416
G. WILLIAM DAUB, WILLIAM S. SEESE, Qumica (Hispan), Pearson Education, Pag. 415,
citado el 24 de febrero de 2014, libro disponible en la web:
http://books.google.com.co/books?id=Zkkyt8GVnbQC&pg=PA415&lpg=PA415&dq=color+r
osa+titulacion&source=bl&ots=1Z4gOht5GW&sig=ZQhgMxa0fH-
QmJaSt2Ggo_NbbWI&hl=es&sa=X&ei=bYELU8rDO8m5kQeg6oCgBg&ved=0CF0Q6AEw
Cg#v=onepage&q=color%20rosa%20titulacion&f=false
ANEXOS
UNIDADES TECNOLGICAS DE SANTANDER
DEPARTAMENTO DE CIENCIAS BSICAS
PRE INFORME DE LABORATORIO DE BIOLOGIA
IDENTIFICACIN
NOMBRE DE LA PRCTICA:
FECHA:
INTEGRANTES
NOMBRE:
CDIGO:
NOMBRE: CDIGO:
NOMBRE: CDIGO:
PROGRAMA: GRUPO: DOCENTE:
RESULTADOS DE APRENDIZAJE
MARCO TERICO
MATERIALES Y/O REACTIVOS
FICHA DE SEGURIDAD
PROCEDIMIENTO
REFERENCIAS BIBLIOGRFICAS
UNIDADES TECNOLGICAS DE SANTANDER
HOJA DE TRABAJO DE LABORATORIO DE BIOLOGIA
I. IDENTIFICACIN
NOMBRE DE LA PRCTICA:
FECHA:
INTEGRANTES
NOMBRE:
CDIGO:
NOMBRE: CDIGO:
NOMBRE: CDIGO:
PROGRAMA: GRUPO: DOCENTE:
TABLAS DE DATOS (RESULTADOS) Y/O OBSERVACIONES
Potrebbero piacerti anche
- Estandarización de Soluciones Básicas. Estandarización de Una Solución de NaOH 0,1N y Determinación de Ácido Acético en Vinagre.Documento15 pagineEstandarización de Soluciones Básicas. Estandarización de Una Solución de NaOH 0,1N y Determinación de Ácido Acético en Vinagre.Junior ObregónNessuna valutazione finora
- Matematica para Contadores 1Documento36 pagineMatematica para Contadores 1Milagros Cbjl100% (5)
- Andon 2Documento21 pagineAndon 2Ariel Lopez Calderon100% (1)
- Historia y Elaboración Del WhiskyDocumento6 pagineHistoria y Elaboración Del WhiskyVladimir PerezNessuna valutazione finora
- 30 Preguntas para ReflexionarDocumento3 pagine30 Preguntas para ReflexionarWILLO NFSNessuna valutazione finora
- Informe Parcial Dirección Comercial 1 - Sealed Air CorporationDocumento3 pagineInforme Parcial Dirección Comercial 1 - Sealed Air CorporationLorena SaavedraNessuna valutazione finora
- Resumen Modelos Contable TeoriaDocumento24 pagineResumen Modelos Contable Teorialaura88% (26)
- Aguadito de ChoroDocumento78 pagineAguadito de ChoroLuis Alberto Villaseca CajasNessuna valutazione finora
- EQUILIBRIO QUÍMICO Quimica 101Documento51 pagineEQUILIBRIO QUÍMICO Quimica 101Emerson Wilgen Apaza LopezNessuna valutazione finora
- Iam211 Sem 2-2020 Laboratorio # 8 Estandarizacion de Soluciones Formadoras de PrecipitadoDocumento12 pagineIam211 Sem 2-2020 Laboratorio # 8 Estandarizacion de Soluciones Formadoras de PrecipitadoYenny ViscarraNessuna valutazione finora
- Ácido Fosfórico - Coca Cola InformeDocumento21 pagineÁcido Fosfórico - Coca Cola InformeigrajalesNessuna valutazione finora
- PROBLEMA de Hidrolisis y NeutralizacionDocumento9 paginePROBLEMA de Hidrolisis y NeutralizacionDAVY MARK ANCHIRAICO SOTONessuna valutazione finora
- Informe 2Documento11 pagineInforme 2Arian Romualdo SotoNessuna valutazione finora
- Informe - Valoración Acido Cítrico en Bebida ComercialDocumento14 pagineInforme - Valoración Acido Cítrico en Bebida ComercialAlexander Omar Capcha RiosNessuna valutazione finora
- Informe de Laboratorio QuimicaDocumento6 pagineInforme de Laboratorio QuimicavaleriaNessuna valutazione finora
- Diapositivas Avance de Proyecto Laboratorio Quimica Organica IIDocumento6 pagineDiapositivas Avance de Proyecto Laboratorio Quimica Organica IIPriscila LuceroNessuna valutazione finora
- 2da Practica Balance de Materia Qmc-100 Upea I-2021Documento8 pagine2da Practica Balance de Materia Qmc-100 Upea I-2021Joel MaldonadoNessuna valutazione finora
- Practica #3 - Los ReactivosDocumento12 paginePractica #3 - Los ReactivosSean OconnerNessuna valutazione finora
- Práctica #05 Acidez y PHDocumento13 paginePráctica #05 Acidez y PHLuis AngelNessuna valutazione finora
- PHDocumento30 paginePHKarenPatrocinio100% (1)
- Jugo de CañaDocumento2 pagineJugo de CañaCésar Tesén Bardales0% (1)
- Guia 3 Equilibrio QuimicoDocumento7 pagineGuia 3 Equilibrio QuimicoPamela VarelaNessuna valutazione finora
- Informe de Mediciones de Masa y Volumen.Documento11 pagineInforme de Mediciones de Masa y Volumen.Heiman Ochoa0% (1)
- Informe Laboratorio 4Documento6 pagineInforme Laboratorio 4Alejandro Delgado PerafanNessuna valutazione finora
- POLARIMETRIADocumento6 paginePOLARIMETRIAgerson polentinoNessuna valutazione finora
- Aldehído-Cetona - 2,4-DNFH - NH2OH - Nitroprusiato NaDocumento21 pagineAldehído-Cetona - 2,4-DNFH - NH2OH - Nitroprusiato NaBrenda MurilloNessuna valutazione finora
- Lab#3 Tension SuperficialDocumento6 pagineLab#3 Tension SuperficialYarirene Medina HerreraNessuna valutazione finora
- Informe Crioscopia. ListoDocumento6 pagineInforme Crioscopia. Listokaren cubidesNessuna valutazione finora
- Practica 2 Determinacion de PH y Acidez (PRIMEROS)Documento5 paginePractica 2 Determinacion de PH y Acidez (PRIMEROS)IngenieriaAlimentosNessuna valutazione finora
- Caracteristicas de Las Reacciones de DiazotacionDocumento1 paginaCaracteristicas de Las Reacciones de DiazotacionBrenda Sottile100% (1)
- Gravedad APIDocumento4 pagineGravedad APICristian VallejoNessuna valutazione finora
- Reporte 2Documento5 pagineReporte 2LUIS ANGEL JUAN FRANCISCONessuna valutazione finora
- DiscusiónDocumento2 pagineDiscusiónDylan Nuñez0% (1)
- Informe de Lab 2Documento6 pagineInforme de Lab 2unk93100% (1)
- Informe Velocidad de H2o2Documento20 pagineInforme Velocidad de H2o2ALEJANDRA LUCERO MEJ�A CRUZNessuna valutazione finora
- Presentacion Volumetria de Formacion de Complejos 1 PDFDocumento29 paginePresentacion Volumetria de Formacion de Complejos 1 PDFArielNessuna valutazione finora
- Primer Examen Parcial Area Química Fecha 27-03-2010 PDFDocumento4 paginePrimer Examen Parcial Area Química Fecha 27-03-2010 PDFJohns ContrerasNessuna valutazione finora
- Práctica 3 Calibración de Material VolumétricoDocumento6 paginePráctica 3 Calibración de Material VolumétricoRody Andres ArquezNessuna valutazione finora
- Cuestionario de QuimicaDocumento20 pagineCuestionario de QuimicaNeil Edwin Alarcón RoseroNessuna valutazione finora
- Freire Melany Práctica 9 Calorimetría QG2 P1 19-19Documento18 pagineFreire Melany Práctica 9 Calorimetría QG2 P1 19-19Melany Freire100% (1)
- Informe Determinacion de Dureza Del AguaDocumento5 pagineInforme Determinacion de Dureza Del AguaIvanAconchaNessuna valutazione finora
- Determinación de Cu en Cerveza Por EAADocumento14 pagineDeterminación de Cu en Cerveza Por EAAPedro Zúñiga PauroNessuna valutazione finora
- Labo 1 Calibración Del Equipo de AADocumento13 pagineLabo 1 Calibración Del Equipo de AAFiorela Rivas100% (1)
- Practica 5 Propiedades Coligativas 1Documento7 paginePractica 5 Propiedades Coligativas 1ampavase88% (8)
- Resumen Química Analítica 1Documento152 pagineResumen Química Analítica 1Jose Pedro ReyNessuna valutazione finora
- Informe 4Documento5 pagineInforme 4Nilú MoriNessuna valutazione finora
- Viscosidad de StockDocumento10 pagineViscosidad de StockEdward SaavedraNessuna valutazione finora
- Informe de Lab. Equilibrio IonicoDocumento3 pagineInforme de Lab. Equilibrio IonicojoseNessuna valutazione finora
- Preinforme Practica 1 Recoleccion de GasesDocumento5 paginePreinforme Practica 1 Recoleccion de GasesVanesaMontaña100% (1)
- 13 Determinacion de Acidez en Alimentos de HortalizasDocumento4 pagine13 Determinacion de Acidez en Alimentos de HortalizasVioLeta RebouLenNessuna valutazione finora
- Informe #5 Alcoholes y FenolesDocumento10 pagineInforme #5 Alcoholes y Fenoleshuver roa100% (1)
- Pre Informe Nº13 Qmc-1200''b'' Grupo 8Documento13 paginePre Informe Nº13 Qmc-1200''b'' Grupo 8CONFECCIONES JHOMARANessuna valutazione finora
- Determinación Potenciométrica de Cloruro en Aguas Naturales para Labo 6Documento3 pagineDeterminación Potenciométrica de Cloruro en Aguas Naturales para Labo 6Cristhian GilioNessuna valutazione finora
- Aplicaciones Acido-BaseDocumento4 pagineAplicaciones Acido-BaseRosmeri DelgadoNessuna valutazione finora
- Hidroxido de AmonioDocumento3 pagineHidroxido de AmonioJuan Vicente Reyes LimaNessuna valutazione finora
- PRQ 3257 Primer ParcialDocumento1 paginaPRQ 3257 Primer ParcialJacquelineNessuna valutazione finora
- Informe de NitraciónDocumento6 pagineInforme de Nitraciónandres guerreroNessuna valutazione finora
- Taller para Entregar AnaliticaDocumento3 pagineTaller para Entregar AnaliticavalmerNessuna valutazione finora
- Potenciometria INFORME 1.Documento22 paginePotenciometria INFORME 1.AnaFabiolaBaptistaMatheus100% (3)
- Ejercicio 1y 2 de CurvasDocumento2 pagineEjercicio 1y 2 de CurvasNatasha VargasNessuna valutazione finora
- Practica 1Documento5 paginePractica 1alexa villa100% (2)
- Documento 1Documento9 pagineDocumento 1Lüis Santacruz VillaNessuna valutazione finora
- Titulación Acido-BaseDocumento7 pagineTitulación Acido-BaseFabian ArdilaNessuna valutazione finora
- Titulación ÁcidoDocumento8 pagineTitulación ÁcidoLUISA MARIA BERDUGO MATEUSNessuna valutazione finora
- Punto de EquivalenciaDocumento5 paginePunto de EquivalenciaMarlon Andrey Villamizar LizcanoNessuna valutazione finora
- Informe de Experimento. Titulación Ácido-BaseDocumento7 pagineInforme de Experimento. Titulación Ácido-BaseCarolina Cruz100% (1)
- Informe Carga Especifica Del ElectronDocumento5 pagineInforme Carga Especifica Del ElectronLuciano LizarazoNessuna valutazione finora
- Resumenes de La Exposiciones de EcologiaDocumento11 pagineResumenes de La Exposiciones de EcologiaLuciano LizarazoNessuna valutazione finora
- Aguas CrudasDocumento9 pagineAguas CrudasLuciano LizarazoNessuna valutazione finora
- Solucion Actividad 2Documento3 pagineSolucion Actividad 2Luciano LizarazoNessuna valutazione finora
- Pre Informe Practica 3 Lab - Quimica InorganicaDocumento4 paginePre Informe Practica 3 Lab - Quimica InorganicaLuciano Lizarazo0% (1)
- HuesosDocumento2 pagineHuesosLuciano LizarazoNessuna valutazione finora
- Tilapia Plan de NegocioDocumento7 pagineTilapia Plan de NegocioYessica Onofre FloresNessuna valutazione finora
- Economía Cuadro de Los Principales Paradigmas Económicos. Fase 1.Documento3 pagineEconomía Cuadro de Los Principales Paradigmas Económicos. Fase 1.Hilda MANessuna valutazione finora
- Universidad Tecnológica Del Perú. MonografiaDocumento11 pagineUniversidad Tecnológica Del Perú. MonografiaAndrés LupoNessuna valutazione finora
- HISTOGROVsDocumento12 pagineHISTOGROVsGarcia G H LowargcfNessuna valutazione finora
- Teoria de Costos de ProduccionDocumento3 pagineTeoria de Costos de Producciontc_hold100% (3)
- Alcoholes-Química OrgánicaDocumento20 pagineAlcoholes-Química OrgánicaclaudiaNessuna valutazione finora
- Mercadona Compra OnlineDocumento1 paginaMercadona Compra Onlinejcml.entrenamientosNessuna valutazione finora
- El Analisis SectorialDocumento8 pagineEl Analisis SectorialWashington Espirilla TorresNessuna valutazione finora
- Apu TecpetrolDocumento58 pagineApu TecpetrolEdwin FonsecaNessuna valutazione finora
- Recursos Críticos y EstrategiaDocumento20 pagineRecursos Críticos y Estrategiafacu_falaNessuna valutazione finora
- DonofrioDocumento15 pagineDonofrioDency Torres0% (1)
- Guía Aprendizaje Unidad 4Documento3 pagineGuía Aprendizaje Unidad 4Jessica JaimesNessuna valutazione finora
- Matriz EFE - EjemploDocumento2 pagineMatriz EFE - Ejemploprofeaula2Nessuna valutazione finora
- Finanzas - Cap06 Reestructuracion Mckinsey v01 ResumidoDocumento13 pagineFinanzas - Cap06 Reestructuracion Mckinsey v01 ResumidorafaelnberNessuna valutazione finora
- Formato Trabajo Completo SAM-CONAMET 2013Documento2 pagineFormato Trabajo Completo SAM-CONAMET 2013juanomoranNessuna valutazione finora
- Monedas y Billetes de Guatemala El Salvador Mexico Usa España Inglaterra Honduras EtcDocumento9 pagineMonedas y Billetes de Guatemala El Salvador Mexico Usa España Inglaterra Honduras Etcyupi_futbolNessuna valutazione finora
- Reseña MercadeoDocumento1 paginaReseña MercadeovalentinaNessuna valutazione finora
- Trabajo Lorena Administración GenralDocumento5 pagineTrabajo Lorena Administración GenralHENRY MANRIQUENessuna valutazione finora
- Teoria de OpcionesDocumento21 pagineTeoria de OpcionesOscaGRNessuna valutazione finora
- Brochure ExtintoresDocumento4 pagineBrochure ExtintoresPuma De La Torre ExtintoresNessuna valutazione finora
- C2-L5-Caja Chica (Lic. Renny Espinoza)Documento27 pagineC2-L5-Caja Chica (Lic. Renny Espinoza)Geovanny Superlano100% (1)
- Interes Simple Problemas 02Documento2 pagineInteres Simple Problemas 02Alvaro Paredes100% (1)
- Ejercicios Adicionales PDFDocumento9 pagineEjercicios Adicionales PDFandersonNessuna valutazione finora