Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Trabajo de Un Gas
Caricato da
Jesús GonçalvesCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Trabajo de Un Gas
Caricato da
Jesús GonçalvesCopyright:
Formati disponibili
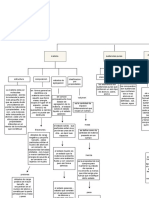
Termodinmica (I)
Fsica
Estadstica
y
Termodinmica
Teora cintica
de
los gases
Frmula de la
estadstica
clsica
Niveles
discretos
de energa
Experimento de
Stern-Gerlach
Viracin de las
molculas
diatmicas
!odelo simple
de atms"era
#istriucin de
las
velocidades de
las
molculas
Termodinmic
a
$ndice
adiatico
de un gas
El ciclo de
%arnot
Segundo
principio
Conceptos bsicos
Trabajo mecnico hecho por o sobre el sistema.
El calor
Primera ley de la Termodinmica
Transformaciones
Los sistemas fsicos que encontramos en la Naturaleza consisten en un areado de un
n!mero muy rande de tomos.
La materia est en uno de los tres estados" s#lido$ lquido o as" En los s#lidos las
posiciones relati%as &distancia y orientaci#n' de los tomos o mol(culas son fijas. En los
lquidos las distancias entre las mol(culas son fijas$ pero su orientaci#n relati%a cambia
continuamente. En los ases$ las distancias entre mol(culas$ son en eneral$ mucho ms
randes que las dimensiones de las mismas. Las fuerzas entre las mol(culas son muy
d(biles y se manifiestan principalmente en el momento en el que chocan. Por esta raz#n$
los ases son ms fciles de describir que los s#lidos y sobre todo que los lquidos.
El as contenido en un recipiente$ est formado por un n!mero muy rande de
mol(culas$ ).*+ ,*
+-
mol(culas en un mol de sustancia. Cuando se intenta describir un
sistema con un n!mero tan rande de partculas resulta in!til &e imposible' describir el
mo%imiento indi%idual de cada componente. Por lo que mediremos manitudes que se
refieren al conjunto" %olumen ocupado por una masa de as$ presi#n que ejerce el as
sobre las paredes del recipiente y temperatura. Estas cantidades fsicas se denominan
macrosc#picas$ en el sentido de que no se refieren al mo%imiento indi%idual de cada
partcula$ sino del sistema en su conjunto.
Conceptos bsicos
.enominamos estado de equilibrio de un sistema cuando las %ariables macrosc#picas
presi#n p$ %olumen V$ y temperatura T$ no cambian. El estado de equilibrio es dinmico
en el sentido de que los constituyentes del sistema se mue%en continuamente.
/e denomina ecuacin de estado a la relaci#n que e0iste entre las %ariables p$ V$ y T.
La ecuaci#n de estado ms sencilla es la de un as ideal pV=nRT$ donde n representa el
n!mero de moles$ y R la constante de los ases R1*.*2+ atm l3&4 mol'.
/e denomina energa interna del sistema a la suma de las eneras de todas sus
partculas. En un as ideal las mol(culas solamente tienen enera cin(tica$ los choques
entre las mol(culas se suponen perfectamente elsticos$ la enera interna solamente
depende de la temperatura.
El estado del sistema se representa por un punto en un diarama p56. Podemos llevar al
sistema desde un estado inicial a otro final a travs de una sucesin de estados de
equilibrio.
Trabajo mecnico eco por o sobre el sistema!
Consideremos$ por ejemplo$ un as dentro de un cilindro. Las mol(culas del as chocan
contra las paredes cambiando la direcci#n de su %elocidad$ su momento lineal. El efecto
del ran n!mero de colisiones que tienen luar en la unidad de tiempo$ se puede
representar por una fuerza F que act!a sobre toda el rea de la pared.
/i una de las paredes es un pist#n m#%il de rea A, y (ste se desplaza dx$ el intercambio
de enera del sistema con el mundo e0terior puede e0presarse como el trabajo realizado
por esta fuerza F a lo laro del desplazamiento dx.
dW=-Fdx=-pAdx=-pdV
/iendo dV el cambio del %olumen del as.
El sino menos indica que si el sistema realiza trabajo &incrementa su %olumen' su
enera interna disminuye$ pero si se realiza trabajo sobre el sistema &disminuye su
%olumen' su enera interna aumenta.
El trabajo total realizado cuando el sistema pasa del estado 7 cuyo %olumen es V
A
al
estado 8 cuyo %olumen es V
B.
"l calor
El calor no es una nue%a forma de enera$ es el nombre dado a una transferencia de
enera de tipo especial en el que inter%ienen ran n!mero de partculas. /e denomina
calor a la enera intercambiada entre un sistema y el medio que le rodea debido a los
choques entre las mol(culas del sistema y el e0terior al mismo y siempre que no pueda
e0presarse macrosc#picamente como producto de fuerza por desplazamiento.
/e debe distinuir tambi(n entre los conceptos de calor y enera interna de una
sustancia. El flujo de calor es una transferencia de enera que se lle%a a cabo como
consecuencia de las diferencias de temperatura. La enera interna es la enera que
tiene una sustancia debido a su temperatura$ que es esencialmente a escala microsc#pica
la enera cin(tica de sus mol(culas.
El calor se considera positi%o cuando fluye hacia el sistema$ cuando incrementa su
enera interna. El calor se considera neati%o cuando fluye desde el sistema$ por lo que
disminuye su enera interna.
Cuando una sustancia incrementa su temperatura de T
A
a T
B
$ el calor absorbido se
obtiene multiplicando la masa &o el n!mero de moles n' por el calor especfico c y por la
diferencia de temperatura T
B
-T
A
.
Q=nc(T
B
-T
A
)
Cuando no hay intercambio de enera &en forma de calor' entre dos sistemas$ decimos
que estn en equilibrio t(rmico. Las mol(culas indi%iduales pueden intercambiar
enera$ pero en promedio$ la misma cantidad de enera fluye en ambas direcciones$ no
habiendo intercambio neto. Para que dos sistemas est(n en equilibrio t(rmico deben de
estar a la misma temperatura.
Primera le# de la Termodinmica
La primera ley no es otra cosa que el principio de conser%aci#n de la enera aplicado a
un sistema de muchsimas partculas. 7 cada estado del sistema le corresponde una
enera interna U. Cuando el sistema pasa del estado 7 al estado 8$ su enera interna
cambia en
U=U
B
-U
A
/uponamos que el sistema est en el estado 7 y realiza un trabajo W$ e0pandi(ndose.
.icho trabajo mecnico da luar a un cambio &disminuci#n' de la enera interna de
sistema
U=-W
Tambi(n podemos cambiar el estado del sistema poni(ndolo en contacto t(rmico con
otro sistema a diferente temperatura. /i fluye una cantidad de calor Q del seundo al
primero$ aumenta su enera interna de (ste !ltimo en
U=Q
/i el sistema e0perimenta una transformaci#n cclica$ el cambio en la enera interna es
cero$ ya que se parte del estado 7 y se reresa al mismo estado$ U=0. /in embaro$
durante el ciclo el sistema ha efectuado un trabajo$ que ha de ser proporcionado por los
alrededores en forma de transferencia de calor$ para preser%ar el principio de
conser%aci#n de la enera$ W=Q.
/i la transformaci#n no es cclica U 0
/i no se realiza trabajo mecnico U=Q
/i el sistema est asilado t(rmicamente U=-W
/i el sistema realiza trabajo U disminuye
/i se realiza trabajo sobre el sistema U aumenta
/i el sistema absorbe calor al ponerlo en contacto t(rmico con un foco a
temperatura superior$ U aumenta.
/i el sistema cede calor al ponerlo en contacto t(rmico con un foco a una
temperatura inferior$ U disminuye.
Todo estos casos$ los podemos resumir en una !nica ecuaci#n que describe la
conser%aci#n de la enera del sistema.
U=Q-W
/i el estado inicial y final estn muy pr#0imos entre s$ el primer principio se escribe
dU=dQ-pdV
Transformaciones
La enera interna U del sistema depende !nicamente del estado del sistema$ en un as
ideal depende solamente de su temperatura. 9ientras que la transferencia de calor o el
trabajo mecnico dependen del tipo de transformaci#n o camino seuido para ir del
estado inicial al final.
Iscora o a volumen constante
No hay %ariaci#n de %olumen del as $ lueo
W=0
Q=nc
V
(T
B
-T
A
)
.onde c
V
es el calor especfico a %olumen constante
Isbara o a presin constante
W=p(v
B
-v
A
)
Q=nc
P
(T
B
-T
A
)
.onde c
P
es el calor especfico a presi#n constante
Calores especficos a presin constante c
P
# a volumen
constante c
V
En una transformaci#n a %olumen constante dU=dQ=nc
V
dT
En una transformaci#n a presi#n constante dU=nc
P
dT-pdV
Como la %ariaci#n de enera interna dU no depende del tipo de transformaci#n$ sino
solamente del estado inicial y del estado final$ la seunda ecuaci#n se puede escribir
como nc
V
dT=nc
P
dT-pdV
Empleando la ecuaci#n de estado de un as ideal pV=nRT$ obtenemos la relaci#n entre
los calores especficos a presi#n constante y a %olumen constante
c
V
=c
P
-R
Para un as monoat#mico
Para un as diat#mico
/e denomina ndice adiabtico de un as ideal al cociente
Isoterma o a temperatura constante
U=0
Q=W
$diabtica o asilada trmicamente% Q&'
"cuacin de la transformacin adiabtica
.el primer principio dU=-pdV
:nterando
.onde el e0ponente de V se denomina ndice adiabtico del as ideal
/i 7 y 8 son los estados inicial y final de una transformaci#n adiabtica se cumple que
Para calcular el trabajo es necesario efectuar una interaci#n similar a la transformaci#n
isoterma.
Potrebbero piacerti anche
- Diseño de infraestructura eléctrica y programa de gestión para mina de criptomonedas en PorlamarDocumento68 pagineDiseño de infraestructura eléctrica y programa de gestión para mina de criptomonedas en PorlamarJesús Gonçalves100% (1)
- Republica Bolivariana de VenezuelaDocumento77 pagineRepublica Bolivariana de VenezuelaJesús GonçalvesNessuna valutazione finora
- Diccionario Bilingue QuimicaDocumento19 pagineDiccionario Bilingue QuimicaLuis Sosa100% (1)
- Quimica I y IIDocumento58 pagineQuimica I y IIRoberto Treviño25% (4)
- Descripción Del VendedorDocumento2 pagineDescripción Del VendedorJesús GonçalvesNessuna valutazione finora
- Analisis Tecnico y Fundamental Del Criptomercado Abril 2019 PDFDocumento8 pagineAnalisis Tecnico y Fundamental Del Criptomercado Abril 2019 PDFJesús GonçalvesNessuna valutazione finora
- Oficio 0060-19i PasantiasDocumento1 paginaOficio 0060-19i PasantiasJesús GonçalvesNessuna valutazione finora
- Taller Del Servicio ComunitarioDocumento1 paginaTaller Del Servicio ComunitarioJesús GonçalvesNessuna valutazione finora
- 1.forma 004 Inv - Inscripcion TGDocumento1 pagina1.forma 004 Inv - Inscripcion TGJesús GonçalvesNessuna valutazione finora
- Tech Data: Customer Service Esolutions Customer Support (Ecs)Documento5 pagineTech Data: Customer Service Esolutions Customer Support (Ecs)Jesús GonçalvesNessuna valutazione finora
- Cronograma P.I. 2018-2Documento2 pagineCronograma P.I. 2018-2Jesús GonçalvesNessuna valutazione finora
- Capitulo II y III CriptoDocumento58 pagineCapitulo II y III CriptoJesús GonçalvesNessuna valutazione finora
- Solicitud de Carta de Postulación A PasantíasDocumento2 pagineSolicitud de Carta de Postulación A PasantíasLuisK'lancheNessuna valutazione finora
- Analisis Tecnico y Fundamental Del Criptomercado Abril 2019 PDFDocumento8 pagineAnalisis Tecnico y Fundamental Del Criptomercado Abril 2019 PDFJesús GonçalvesNessuna valutazione finora
- Fusibles de DistribucionDocumento24 pagineFusibles de DistribucionDiego Garcia100% (1)
- Análisis Técnico y Fundamental del Criptomercado Octubre 2018Documento5 pagineAnálisis Técnico y Fundamental del Criptomercado Octubre 2018Jesús GonçalvesNessuna valutazione finora
- Formatos Del Pasante (Reparado)Documento18 pagineFormatos Del Pasante (Reparado)RubenAlejandroSilvaBritoNessuna valutazione finora
- SDC ApuntesccDocumento149 pagineSDC ApuntesccOscar Andres SotoNessuna valutazione finora
- Teoria de InventarioDocumento14 pagineTeoria de InventarioJesús GonçalvesNessuna valutazione finora
- 2 Manual para La Elaboracion de Trabajo de GradoDocumento121 pagine2 Manual para La Elaboracion de Trabajo de GradohiustynsNessuna valutazione finora
- Proyecto de Investigacion COMPLETO Final PDFDocumento72 pagineProyecto de Investigacion COMPLETO Final PDFJesús GonçalvesNessuna valutazione finora
- Sistema Nacional de Ingreso A La Educación Universitaria 2010Documento1 paginaSistema Nacional de Ingreso A La Educación Universitaria 2010Jesús GonçalvesNessuna valutazione finora
- 8 Cómo Crear Títulos Que Venden PDFDocumento3 pagine8 Cómo Crear Títulos Que Venden PDFJesús GonçalvesNessuna valutazione finora
- 3 - ProyectoDocumento64 pagine3 - ProyectoJesús GonçalvesNessuna valutazione finora
- Este Servicio Es Gratuito Solo Debe Cancelar Los Timbres FiscalesDocumento2 pagineEste Servicio Es Gratuito Solo Debe Cancelar Los Timbres FiscalesJesús GonçalvesNessuna valutazione finora
- Análisis Técnico y Fundamental Del Mercado de Criptoactivos-Nov2018Documento14 pagineAnálisis Técnico y Fundamental Del Mercado de Criptoactivos-Nov2018Jesus GoncalvesNessuna valutazione finora
- BanescOnline Miercoles, 20 de Marzo de 2019 16-13-19 126 PMDocumento1 paginaBanescOnline Miercoles, 20 de Marzo de 2019 16-13-19 126 PMJesús GonçalvesNessuna valutazione finora
- Sistema Nacional de Ingreso A La Educación Universitaria 2010Documento1 paginaSistema Nacional de Ingreso A La Educación Universitaria 2010Jesús GonçalvesNessuna valutazione finora
- Capitulo II CriptoDocumento16 pagineCapitulo II CriptoJesús GonçalvesNessuna valutazione finora
- Capitulo II CriptoDocumento52 pagineCapitulo II CriptoJesús GonçalvesNessuna valutazione finora
- Capitulo II y III CriptoDocumento58 pagineCapitulo II y III CriptoJesús GonçalvesNessuna valutazione finora
- Diseño de Una Infraestructura Electrica y Programa deDocumento16 pagineDiseño de Una Infraestructura Electrica y Programa deJesús GonçalvesNessuna valutazione finora
- Alumbre - MineralDocumento2 pagineAlumbre - MineralJuan Se Guerrero ANessuna valutazione finora
- M3 S14 Ejercicion Correcciones FinalesDocumento23 pagineM3 S14 Ejercicion Correcciones FinalesSanti VásconezNessuna valutazione finora
- Ias-Planificacion Q. Tecnológica-Distancia - 2022Documento5 pagineIas-Planificacion Q. Tecnológica-Distancia - 2022Celeste SeguelNessuna valutazione finora
- CLASE Hibridación, Enlace Metalico y Fuerzas IntermolecularesDocumento23 pagineCLASE Hibridación, Enlace Metalico y Fuerzas IntermolecularesFatima Paola MoreiraNessuna valutazione finora
- Formula Empirica 1Documento2 pagineFormula Empirica 1calosraNessuna valutazione finora
- Obtención de μ, k y DAB con la Teoría Cinética de los GasesDocumento17 pagineObtención de μ, k y DAB con la Teoría Cinética de los Gasesvickyferrer24642Nessuna valutazione finora
- La MateriaDocumento4 pagineLa MateriaJose Landa VelasquezNessuna valutazione finora
- Manual Química HeterocíclicaDocumento58 pagineManual Química HeterocíclicaAegiss0% (1)
- Quimica .DrawioDocumento16 pagineQuimica .DrawioLizeth MarpadNessuna valutazione finora
- Estructura Materia EBAU QuimicaDocumento36 pagineEstructura Materia EBAU QuimicaAna SierraNessuna valutazione finora
- Quimica Trabajo 10Documento5 pagineQuimica Trabajo 10Kiara BentacurNessuna valutazione finora
- Asfalto: propiedades, obtención y aplicaciones en pavimentaciónDocumento17 pagineAsfalto: propiedades, obtención y aplicaciones en pavimentaciónLuis Carlos BuriNessuna valutazione finora
- EstequiometriaDocumento10 pagineEstequiometriaKarla GuerreroNessuna valutazione finora
- Manual Biología Molecular y CelularDocumento86 pagineManual Biología Molecular y CelularMARIA CAMILA FALLACCI BELTRANNessuna valutazione finora
- Tema 6Documento23 pagineTema 6Angélica MontalvoNessuna valutazione finora
- Calculos Quimicos - MiscelaniaDocumento2 pagineCalculos Quimicos - MiscelaniaEsceptico RypNessuna valutazione finora
- Efectos de la hidroterapia en el estrés laboralDocumento140 pagineEfectos de la hidroterapia en el estrés laboralAndrés Terrones CotrinaNessuna valutazione finora
- Callomamani Callomamani VivianaDocumento85 pagineCallomamani Callomamani VivianaViviana CallomamaniNessuna valutazione finora
- Bases Quimicas de La Materia VivaDocumento27 pagineBases Quimicas de La Materia VivaFrank Dominguez Zeta100% (8)
- QuimicaDocumento27 pagineQuimicaDamarïs JaquelineNessuna valutazione finora
- Quimica BasicaDocumento4 pagineQuimica BasicaHenriquez YudibelkisNessuna valutazione finora
- QuimicqaDocumento29 pagineQuimicqaPedro AntonNessuna valutazione finora
- QuímicaDocumento34 pagineQuímicaVanesa CaballeroNessuna valutazione finora
- Espectroscopia Ir II 2012Documento15 pagineEspectroscopia Ir II 2012ferrant10980% (1)
- Edic. Progresiones de Aprendizaje - CNEyTDocumento41 pagineEdic. Progresiones de Aprendizaje - CNEyTvalentin de la cruz100% (1)
- Modelo Del Examen 2do Año-2019Documento12 pagineModelo Del Examen 2do Año-2019Annie Giovanna Ramirez NovoaNessuna valutazione finora
- Grupo 1. - Clasificación de Los Compuestos Orgánicos Por SolubilidadDocumento20 pagineGrupo 1. - Clasificación de Los Compuestos Orgánicos Por SolubilidadJulián IdárragaNessuna valutazione finora