Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Titulaciones Con EDTA
Caricato da
Gardner1983Titolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Titulaciones Con EDTA
Caricato da
Gardner1983Copyright:
Formati disponibili
Introduccin
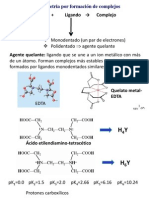
1.) Complejos Metal Quelato
Cualquier eactivo que reaccione con un analito en una proporcin conocida y
con una constante de equlibrio muy alta puede, en principio, usarse en una
titulacin.
Titulaciones de Complejacin: basadas en la rxn de un ion de un metal con
un agente qumico para formar un complejo metal-ligando.
Metal
Ligando
Complejo Metal-Ligand
Metal Acido de Lewis ( aceptor de pares de electrones)
Ligando Base de Lewis (donor de pares de electrones)
Nota: varios tomos de
EDTA se enlazan a Mn
2+
Titulaciones con EDTA Traducido de una presentacin del profesor Powers,
Univesityof Nebraska, Lincoln. http://bionmr.unl.edu/courses/chem221/lectures/chapter-12.ppt
Titulaciones con EDTA
Complejo Fe-DTPA
Introduccin
1.) Complejos Metal Quelato
Las titulaciones de complejacin son reacciones cido-base de Lewis en las
cuales un ligando dona uno o mas pares de electrones a un ion metlico.
Los ligandos usados en titulaciones de complejacin son normalmente
agentes quelantes.
- Ligandos que se unen al metal a travs de mas de un tomo del ligando.
La mayoria de agentes quelantes contienen N o O.
- Elementos que contienen pares de electrones libres que pueden donarse a
un metal
Quelacin de Metales en la Naturaleza
1.) Canales inicos de potasio en membranas celulares
Las seales elctricas son esenciales para la vida
Las seales elctricas estn controladas por el paso selectivo de iones a
travs de las membrans celulares.
- Los canales inicos controlan esta funcin
- Los canales inicos de K son el grupo mas grande y diverso
- Usados en el cerebro, el corazn y el sistema nervioso
Current Opinion in Structural Biology 2001, 11:408414
La apertura del canal de K permite que K
+
salga de
la clula cambiando el potencial elctrico a travs de
la membrana.
El canal de K
+
atraviesa la membrana
El canal tiene
poros que solo
dejan pasar K
+
En el canal, K
+
es
quelado por O
http://www.bimcore.emory.edu/home/molmod/Wthiel/Kchannel.html
Titulaciones con EDTA
Complejos Metal Quelato
1.) Constantes de Formacin (K
f
)
La constante de equilibrio para la rxn entre un ion metlico (M
+n
) y un agente
quelante (L
-P
) es conocida como la constante de formacin o la constante de
estabilidad.
Recuerde varios nombres de constantes de equilibrio: Producto de solubilidad
(K
sp
), constantes de acidez y basicidad (K
a
, K
b
), constante de auto ionizacin del
agua (K
w
)
Efecto quelato: habilidad que tienen los ligandos multidentados de formar
complejos mas fuertes con metales (comparado con ligandos
monodentados).
K
f
= 8x10
9
K
f
= 4x10
9
Dos molculas de etilendiamina se unen mas fuerte que 4 de metilamina
Titulaciones con EDTA
Ligandos multidentados unidos a un metal radioactivo
enlazados a un anticuerpo monoclonal (mAb).
mAb es una proteina que se une a un cierto sitio en un
tumor, entregando una dosis txica de radiacin.
Titulaciones con EDTA
Complejos Metal Quelato
2.) Efecto Quelato
Es usual que agentes acomplejantes con mas de un par de electrones para
donar formen complejos mas fuertes con iones metlicos que agentes con
un solo par de electrones.
- Tipicamente mas de un O o N
- Valores de K
f
muy altos
Ligando multidentado: Agente quelante con mas de un par de electrones
libres
- La estequiometra es 1:1 independientemente de la carga del ion
Ligando monodentado: Quelante con solo un par de electrones libres
EDTA
1.) EDTA (Ethylenediaminetetraacetic acid)
Uno de los agentes quelantes mas comunes usados en titulaciones de
acomplejacin en qumica analtica.
EDTA tiene 2 nitrgenos y 4 oxgenos en su estructura con un total de 6
pares de electrones libres que puede donar a iones metlicos.
- Valores de K
f
muy altos
- 6 sitios cido-base en su estructura
Titulaciones con EDTA
EDTA
2.) Formas Acido-Base
EDTA existe en hasta 7 especies diferentes dependiendo del pH de la
solucin.
La especie mas bsica (Y
4-
) es la que mas reacciona con iones metlicos.
Complejo EDTA-Mn
Titulaciones con EDTA
EDTA
2.) Especies Acido-Base
La fraccin (o) de la especie mas bsica de EDTA (Y
4-
) en funcion de [H
+
]
(pH) del medio
| | EDTA
Y
Y HY Y H Y H Y H Y H Y H
Y
4
Y
4 3 2
2 3 4 5
2
6
4
Y
4
4
] [
] [ ] [ ] [ ] [ ] [ ] [ ] [
] [
+ +
=
+ + + + + +
=
o
o
Fraccin (o) de EDTA en la forma Y
4-
:
donde [EDTA] es la suma de las concentraciones de las especies libres de
EDTA en sln
} ] [ ] [ ] [ ] [ ] [ ] {[
2 3 4 5 6
6 5 4 3 2 1 5 4 3 2 1 4 3 2 1 3 2 1 2 1 1
6 5 4 3 2 1
Y
K K K K K K K K K K K H K K K K H K K K H K K H K H H
K K K K K K
4
+ + + + + +
=
+ + + + + +
o
o
Y4-
depende del pH de la solucin
Titulaciones con EDTA
EDTA
3.) Complejos de EDTA
La especie mas bsica de EDTA (Y
4-
) reacciona con la mayoria de iones
metlicos para formar un complejo 1:1.
- Las otras especies deEDTA tambien quelan iones metlicos
Recuerde: La concentracin de Y
4-
y la concentracin total de EDTA en sln
[EDTA] estn relacionadas entre si por:
] ][ [
] [
+
=
4 n
4 n-
f
Y M
MY
K
Note que esta rxn solo involucra Y
4-
y no las otras especies de EDTA
| | EDTA Y
4
Y
4
=
o ] [
Recuerde que o
Y4-
depende del pH
Titulaciones con EDTA
EDTA
3.) Complejos de EDTA
La especie mas bsica de EDTA (Y
4-
) reacciona con la mayora de iones
metlicos para formar un complejo 1:1.
Titulaciones con EDTA
EDTA
3.) Complejos de EDTA
Substituya [Y
4-
] en K
f
Si el pH esta regulado, o
Y4-
es una constante que ;puede combinarse con K
f
] ][ [
] [
+
=
4 n
4 n-
f
Y M
MY
K
| | EDTA Y
4
Y
4
=
o ] [
] [ ] [
] [
- 4
Y
EDTA M
MY
K
n
4 n-
f
o
+
=
[EDTA] es la concentracin
de EDTA no enlazada a los
iones metlicos
] ][ [
] [
- 4
Y
EDTA M
MY
K K K
n
4 n-
f
'
f
+
= = = o
Constante de formacin condicional o
efectiva :
(a un pH dado)
Titulaciones con EDTA
EDTA
3.) Complejos de EDTA
- 4
Y
o
f
'
f
K K =
A cualquier pH, podemos calcular o
Y4-
y
evaluar K
f
Titulaciones con EDTA
EDTA
4.) Ejemplo:
Cul es la concentracin de Fe
3+
libre en una sln 0.10 M Fe(EDTA)
-
a pH
8.00?
Titulaciones con EDTA
EDTA
5.) Limitaciones del pH
El complejo metal EDTA se vuelve menos estable a medida que el pH
decrece
- K
f
disminuye
- [Fe
3+
] = 5.4x10
-7
M a pH 2.0 -> [Fe
3+
] = 1.4x10
-12
M a pH 8.0
Para lograr una titulacin completa (K
f
10
6
), EDTA requiere un valor
mnimo de pH para la titulacin de cada ion metlico
El punto final es mas difcil de distinguir a
medida que el pH disminuye, limitando la
utilidad de EDTA como titulante.
Titulaciones con EDTA
EDTA
5.) Limitaciones del pH
Si uno ajusta el pH de una titulacin
con EDTA:
un tipo de ion metlico (p. ej. Fe
3+
)
puede titularse sin interferencia de
otros (p. ej. Ca
2+
)
Ph mnimo para la
titulacin efectiva de
iones metlicos
Titulaciones con EDTA
Curvas de Titulacin con EDTA
1.) Curva de Titulacin
La titulacin de un ion metlico con EDTA es similar a la titulacin de un cido
fuerte (M
+
) con una base dbil (EDTA)
La curva de titulacion tiene tres regiones:
- Antes del punto de equivalencia (exceso de M
n+
)
- En el pt de equivalencia ([EDTA]=[M
n+
]
- Despus del pt de equivalencia (exceso de EDTA)
- 4
Y
o
f
'
f
K K =
] [
+
=
n
M log pM
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
Calcule [M
n+
] y pM para una sln de Mg
2+
0.0500 M (50.0 mL) regulada a pH
10.00 y titulada con 0.0500 M EDTA luego de agregar (a) 5.0 mL, (b) 50.0 mL
y (c) 51.0 mL de EDTA?
K
f
= 10
8.79
= 6.2x10
8
o
Y4-
at pH 10.0 = 0.30
( )( ) ( ) mL 00 . 50 V ) M 0500 . 0 ( mL 00 . 5 M 0500 . 0 ) mL ( V
e e
= =
Volumen EDTA en el pt de equivalencia:
mmol de EDTA
mmol de Mg
2+
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
(a) Antes del Pt de Equivalencia ( 5.0 mL de EDTA)
Antes del punto de equivalencia, [M
n+
] = concentracin de M
n+
sin reaccionar, en
exceso. La disociacin de MY
n-4
es despreciable.
] [
)] )( ( - ) )( [(
] [
L 0050 . 0 L 0500 . 0
L 0050 . 0 M EDTA 0500 . 0 L 0500 . 0 M Mg 0500 . 0
Mg
2
2
+
=
+
+
mol de Mg
2+
Antes de empezar
mol de EDTA agregado
Volumen original de la
solucin
Volumen de titulante
agregado
39 . 1 Mg log pMg M 0409 . 0 Mg
2 2 2
= = =
+ + +
] [ ] [
Efecto de
dilucin
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
(b) En el Punto de Equivalencia ( 50.0 mL de EDTA)
Virtualmente todo el ion metlico est ahora en la
forma MgY
2-
) (
) (
) ( ] [
L 0500 . 0 L 0500 . 0
L 0500 . 0
M 0500 . 0 MgY
2
+
=
Original [M
n+
]
Original volume of
M
n+
solution
Original volume
solution
Volume titrant
added
Dilution effect
Mol Mg
+
mol MgY
2-
M 0250 . 0 MgY
2
=
] [
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
(b) En el Punto de Equivalencia ( 50.0 mL de EDTA)
Clculo de [Mg
2+
] libre:
Initial Concentration (M) 0 0 0.0250
Final Concentration (M) x x 0.0250 - x
] ][ [
] ) [
EDTA Mg
EDTA ( Mg
K K
2
2 -
Y
f
'
4
f +
= =
o
) x )( x (
) x 0250 . 0 (
) 30 . 0 )( 10 2 . 6 (
8
=
Resuelva x usando la ecuacin cuadrtica:
94 . 4 pMg 10 16 . 1 EDTA Mg x
2 5 2
= = = =
+ +
] [ ] [
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
(c) Despus del Punto de Equivalencia ( 51.0 mL de EDTA)
Virtualmente, todo el ion metlico est ahora en la forma MgY
2-
y hay un
exceso de EDTA sin reaccionar. Una pequea cantidad de M
n+
existe en
equilibrio con MgY
4-
y EDTA.
) (
) )( (
] [
L 0510 . 0 L 0500 . 0
L 0010 . 0 M 0500 . 0
EDTA
+
=
[EDTA] original
Volumen de
titulante en
exceso
Volumen original de sln
Volumen de
titulante
agregado
Efecto de
Dilucin
Moles de EDTA en exceso
M 10 95 . 4 EDTA
4
= ] [
Calcule el exceso de [EDTA]:
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
(c) Despus del Punto de Equivalencia ( 51.0 mL de EDTA)
Calcule [MgY
2-
]:
) (
) (
) ( ] [
L 0510 . 0 L 0500 . 0
L 0500 . 0
M 0500 . 0 MgY
2
+
~
Original [M
n+
]
Original volume of
M
n+
solution
Original volume
solution
Volume titrant
added
Moles Mg
+
moles MgY
2-
M 0248 . 0 MgY
2
~
] [
Only Difference
Titulaciones con EDTA
Efecto de
Dilucin
Curvas de Titulacin con EDTA
2.) Ejemplo
(c) Despus del Punto de Equivalencia ( 51.0 mL de EDTA)
[Mg
2+-
] puede calcularse de la constante de equilibrio, usando [EDTA] y [MgY
2-
]:
] ][ [
] ) [
EDTA Mg
EDTA ( Mg
K K
2
2 -
Y
f
'
4
f +
= =
o
) M 10 95 . 4 )( x (
) M 0248 . 0 (
) 30 . 0 )( 10 2 . 6 (
4
8
=
57 . 6 pMg 10 7 . 2 Mg x
2 7 2
= = =
+ +
] [
Titulaciones con EDTA
Curvas de Titulacin con EDTA
2.) Ejemplo
Curva de titulacin para 50.0 mL de Mg
2+
0.0500 M con EDTA 0.0500 M a
pH 10.00.
- Tambin aparece la titulacion de Zn
2+
0.0500 M
(50.0 mL)
Observe: El punto de equivalencia es mas
claro para Zn
2+
que para Mg
2+
porque Zn
2+
tiene una constante de formacin mayor
The completeness of these reactions is
dependent on o
Y4-
and correspondingly pH.
pH is an important factor in setting the completeness
and selectivity of an EDTA titration
Titulaciones con EDTA
Agentes Acomplejantes Auxiliares
1.) Hidrxidos Metlicos
En general, a medida que el pH aumenta, una titulacin de un ion metlico
con EDTA tendr una constante de equilibrio mayor
- Y el punto de equivalencia ser mas claro.
Excepcin: Si M
n+
reacciona con OH
-
para formar un hidrxido metlico
insoluble
Agentes Acomplejantes Auxiliares: Uno puede agregar un ligando que
acompleje M
n+
con suficiente fortaleza para prevenir la formacin de
hidrxido.
- Amoniaco, tartrato, citrato o trietanolamina enlazan al metal con menos
fortaleza que EDTA
f
Zn Y
' '
K K
2 4
f
+
= o o
n
n
2
2 1
M
] L [ ] L [ ] L [ 1
1
| | |
o
+ + +
=
La fraccin del ion metlico libre (o
M
) depende de las
constantes acumulativas de formacin(|) :
Use una nueva cosntante de formacin condicional
que incorpora la fraccin del metal libre:
Titulaciones con EDTA
Agentes Acomplejantes Auxiliares
2.) Ilustracin:
Titulacin de Cu
+2
(CuSO
4
) con EDTA
Adicin de una sln reguladora de amoniaco resulta en una sln azul oscura
- Formacin de un complejo Cu(II)-amoniaco
- Adicin de EDTA desplaza amoniaco (con un cambio de color)
CuSO
4
Cu-EDTA
Cu-amoniaco
Titulaciones con EDTA
Indicadores Metal Ion
1.) Determinacin del Punto Final de la Titulacin con EDTA
Cuatro Mtodos:
1. Indicadores metal ion
2. Electrodo de mercurio
3. Eelctrodo de pH
4. Electrodo selectivo a iones
Indicadores Metal Ion: Compuestos que cambian de color cuando se enlazan
a un ion metlico
- Similar a un indicador de pH (cambia de color cuando se enlaza a H
+
)
Para una titulacin con EDTA, el indicador debe enlazar al metal con menos
fortaleza que EDTA
- Similar en concepto a Agentes Acomplejantes Auxiliares
- Debe entregarle el ion metlico a EDTA
Medidas de potencial
(red) (colorless) (colorless)
(blue)
Punto Final indicado por un
cambio de color de rojo a azul
Titulaciones con EDTA
Indicadores Metal Ion
2.) Ilustracin
Titulacin de Mg
2+
con EDTA
- (Indicador) Negro de EriocromoT
Adicin de EDTA
Antes Cerca Despus
Equivalence point
Titulaciones con EDTA
Indicadores Metal Ion
3.) Indicadores Metal Ion Comunes
La mayoria son indicadores de pH y pueden usarse solo en un rango de pH
dado
Titulaciones con EDTA
Indicadores Metal Ion
3.) Indicadores Metal Ion Comunes
Rangos tiles de pH
Titulaciones con EDTA
Tcnicas de Titulacin con EDTA
1.) Casi todos los elementos pueden determinarse mediante titulaciones con
EDTA
Siempre y cuando la concentracin sea suficientemente alta
Referencias:
1) G. Schwarzenbach and H. Flaschka, Complexometric Titrations,
Methuen:London, 1969.
2) H.A. Flaschka, EDTA Titrations, Pergamon Press:New York, 1959
3) C.N. Reilley, A.J. Bernard, Jr., and R. Puschel, In: L. Meites (ed.) Handbook of
Analytical Chemistry, McGraw-Hill:New York, 1963; pp. 3-76 to 3-234.
Algunas Tcnicas Comunes :
a) Titulacin Directa
b) RetroTitulacin
c) Titulaciones de desplazamiento
d) Titulaciones Indirectas
e) Agentes Enmascarantes
Titulaciones con EDTA
Tcnicas de Titulacin con EDTA
2.) Titulacin Directa
Adicin de un regulador de pH apropiado y titulacin del analito con EDTA
Puede requerir un agente acomplejante auxiliar para prevenir la precipitacin
de un hidrxido metlico.
3.) RetroTitulacin
Un exceso conocido de EDTA es agregado al analito
- Quedando EDTA libre despus de que todo el ion metlico ha sido enlazado al
EDTA
El exceso de EDTA es luego titulado con una solucin patrn de un segundo
ion metlico
Esta aproximacin es necesaria si el analito:
- precipita en presencia de EDTA
- Reacciona lentamente con EDTA
- Bloquea el indicador
El segundo ion metlico no debe desplazar el analito del EDTA
>
4 4
Y
) ion metal ond (sec f
Y
) analyte ( f
K K o o
Titulaciones con EDTA
Tcnicas de Titulacin con EDTA
4.) Titulacin por Desplazamiento
Usada para algunos analitos que no tienen un indicador ion metlico
satisfactorio
El Analito (M
n+
) es tratado con un exceso de Mg(EDTA)
2-
, produciendo
desplazamiento del ion Mg
2+
.
M
n+
+ MgY
2-
My
n-4
+ Mg
2+
La cantidad de Mg
2+
desplazado luego se determina por titulacin con una
solucin patrn de EDTA
- Concentracin de Mg
2+
liberado =[M
n+
]
+ +
>
4 2 4 n
Y ) Mg ( f Y ) M ( f
K K o o
Requisito:
Titulaciones con EDTA
Tcnicas de Titulacin con EDTA
5.) Titulacin Indirecta
Usada para determinar aniones que precipitan con iones metlicos
El anion precipita de la solucin por adicin de un exceso de ion metlico
- Ejemplo: SO
4
2-
+ exceso de Ba
2+
- El precipitado es filtrado y lavado
El precipitado luego reacciona con exceso de EDTA para traer el ion metlico
de regreso a la solucin
El exceso de EDTA es titulado con una solucin de Mg
2+
[Total EDTA] = [MY
n-4
] + [Y
4-
]
complejo libre
Conocido Titule
determine
Titulaciones con EDTA
Tcnicas de Titulacin con EDTA
6.) Agentes Enmascarantes
Un reactivo agregado para prevenir la reaccin de un cierto ion metlico con
EDTA
Desenmascaramiento: Liberacin del ion metlico del agente enmascarante
Al
3+
ya no esta disponible para enlazar EDTA porque forma un complejo con F
-
)) EDTA ( Al ( f
) AlF ( f
K K
3
6
>
Requisito:
Titulaciones con EDTA
Potrebbero piacerti anche
- Quimica Analitica ComplexDocumento24 pagineQuimica Analitica ComplexGardner1983Nessuna valutazione finora
- YodometriaDocumento8 pagineYodometriaSthefanía Elizabeth TisalemaNessuna valutazione finora
- Quinolinas e Isoquinolinas SintesisDocumento26 pagineQuinolinas e Isoquinolinas SintesisMario Leonardo Guevara EscalanteNessuna valutazione finora
- CARTEL de La Práctica 4, NRC 13959Documento1 paginaCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoNessuna valutazione finora
- Qai (P) 03 2022-Ii UnwDocumento18 pagineQai (P) 03 2022-Ii UnwVeronica CruzNessuna valutazione finora
- Proteccion y Desprotección de AminasDocumento15 pagineProteccion y Desprotección de AminasGilian SkalariNessuna valutazione finora
- PermanganometriaDocumento5 paginePermanganometriaDaniella Cristina Peña ValdezNessuna valutazione finora
- Agentes Oxidantes - ReductoresDocumento8 pagineAgentes Oxidantes - ReductoresPoniithaw Alesitha de KaulitzNessuna valutazione finora
- Electroquími CA Y CorrosiónDocumento52 pagineElectroquími CA Y CorrosiónSanchez LeilaNessuna valutazione finora
- ImidazolesDocumento4 pagineImidazolesFernanda MartinezNessuna valutazione finora
- Reacciones de ReordenamientoDocumento16 pagineReacciones de ReordenamientoGerardOo Alexander S100% (1)
- Dure ZAADocumento79 pagineDure ZAAhatziry morenoNessuna valutazione finora
- PolarografíaDocumento28 paginePolarografíaManuel Meneses Sanchez0% (1)
- Actividades ExtracciónDocumento28 pagineActividades ExtracciónDiana MoraNessuna valutazione finora
- Potenciometria y Sus Aplicaciones en El Campo de La CienciaDocumento5 paginePotenciometria y Sus Aplicaciones en El Campo de La CienciaAyazo Lopez DaladielNessuna valutazione finora
- Informe 8 - Analítica IiDocumento24 pagineInforme 8 - Analítica IiEsther IsabelNessuna valutazione finora
- Titulaciones ComplexometricasDocumento18 pagineTitulaciones ComplexometricasLuis Diego Cardenas PadillaNessuna valutazione finora
- Titulaciones Redox y PotenciométricasDocumento57 pagineTitulaciones Redox y PotenciométricasJahuey UnalescoNessuna valutazione finora
- 7.0 Complejometría Grupo 01Documento41 pagine7.0 Complejometría Grupo 01Maria Isabel Arevalo RamirezNessuna valutazione finora
- Cerio Terminado444Documento13 pagineCerio Terminado444ClaudiaPalominoZelayaNessuna valutazione finora
- Practca AlcaloidesDocumento6 paginePractca AlcaloidesrudufindoNessuna valutazione finora
- Aislamiento de CaseinaDocumento6 pagineAislamiento de CaseinaMarlon Andres Galvis RojasNessuna valutazione finora
- Sandrapaso 4Documento1 paginaSandrapaso 4SandraIrkGallardoNessuna valutazione finora
- Análisis de Solución Inyectable de NaClDocumento18 pagineAnálisis de Solución Inyectable de NaClfernandoNessuna valutazione finora
- 11 Titulaciones Por Precipitación Mediante PotenciometríaDocumento2 pagine11 Titulaciones Por Precipitación Mediante PotenciometríaDavid Garcia0% (1)
- YodometríaDocumento5 pagineYodometríaNicolas Rodriguez ParraNessuna valutazione finora
- Porcentaje de NH3 en Sal de AmonioDocumento5 paginePorcentaje de NH3 en Sal de AmonioCamii Almeida100% (2)
- Practica 3 Separacion e Identificacion de Aminoacidos Por Cromatografia en Capa FinaDocumento14 paginePractica 3 Separacion e Identificacion de Aminoacidos Por Cromatografia en Capa FinaDiego MartinezNessuna valutazione finora
- La AcetanilidaDocumento5 pagineLa Acetanilidadilmer salcedo0% (1)
- Flav Ono IdesDocumento26 pagineFlav Ono IdesAnonymous vEEQ7019euNessuna valutazione finora
- Tabla de DesecantesDocumento6 pagineTabla de DesecantesAriel Antonio DiazNessuna valutazione finora
- Mecanismo de La Conducción ElectroliticaDocumento8 pagineMecanismo de La Conducción ElectroliticaLiving NafNessuna valutazione finora
- 09 Practica 7. Determinacion de ColesterolDocumento6 pagine09 Practica 7. Determinacion de ColesteroloscarNessuna valutazione finora
- Práctica #7 - LabAnalítica KARENDocumento5 paginePráctica #7 - LabAnalítica KARENDaniela IbarraNessuna valutazione finora
- P-Nitroanilina (Hojas de Seguridad)Documento3 pagineP-Nitroanilina (Hojas de Seguridad)Diana Moedano0% (1)
- Practica 8 Determ. de ClorurosDocumento4 paginePractica 8 Determ. de ClorurosJavier San Juan Mercado100% (1)
- Informe ComplejometriaDocumento9 pagineInforme Complejometriajhon lopezNessuna valutazione finora
- PermanganometriaDocumento5 paginePermanganometriaLevi A PattersonNessuna valutazione finora
- Valoracion de AspirinaDocumento6 pagineValoracion de AspirinaJosé MariaNessuna valutazione finora
- DiazinasDocumento23 pagineDiazinasJuanaRojasNessuna valutazione finora
- Laboratorio No 10 Analitica II Completo YodometriaDocumento13 pagineLaboratorio No 10 Analitica II Completo YodometriaLaura PerdomoNessuna valutazione finora
- PREVIO 9 Determinación de Cloruros en Una Muestra de Sal, Por El MétodoDocumento5 paginePREVIO 9 Determinación de Cloruros en Una Muestra de Sal, Por El MétodoJose Antonio Martinez MorenoNessuna valutazione finora
- Informe 2 - Humedad y CenizasDocumento6 pagineInforme 2 - Humedad y CenizasAngie CampoverdeNessuna valutazione finora
- VALORACIONESDocumento16 pagineVALORACIONESyanNessuna valutazione finora
- Determinación Espectrofotometrica de HierroDocumento5 pagineDeterminación Espectrofotometrica de HierroNarg9415Nessuna valutazione finora
- Práctica 9. FisicoquímicaDocumento10 paginePráctica 9. FisicoquímicaEfraínNessuna valutazione finora
- Purificación de Cetonas Por Bisulfito de SodioDocumento2 paginePurificación de Cetonas Por Bisulfito de SodioJorge Alberto Estrada TorresNessuna valutazione finora
- Informe CafeinaDocumento5 pagineInforme CafeinaJhonny LópezNessuna valutazione finora
- Bicarbonato de Sodio Solucion Inyectable v1.1Documento5 pagineBicarbonato de Sodio Solucion Inyectable v1.1Vero Sandoval100% (1)
- Otras Plantas Medicinales para Afecciones Respiratorias (I) : María Emilia Carretero, Teresa OrtegaDocumento8 pagineOtras Plantas Medicinales para Afecciones Respiratorias (I) : María Emilia Carretero, Teresa OrtegalavagrilNessuna valutazione finora
- MalariaDocumento15 pagineMalariafabian castellanosNessuna valutazione finora
- CUESTIONARIO PREVIO 16 BenciloDocumento5 pagineCUESTIONARIO PREVIO 16 BenciloJose Antonio Silva100% (4)
- Catalisis Como Pilar Fundamental en Quimica VerdeDocumento13 pagineCatalisis Como Pilar Fundamental en Quimica Verdeleonard1613LSNessuna valutazione finora
- Síntesis de LuminolDocumento2 pagineSíntesis de LuminolJoshua ORNessuna valutazione finora
- Clase 1 2019IIDocumento59 pagineClase 1 2019IIKatty Julieth Rangel GutierrezNessuna valutazione finora
- Informe 1 QF I Metóxido B3Documento7 pagineInforme 1 QF I Metóxido B3ClaudiaNessuna valutazione finora
- Práctica #10 - LabAnalíticaDocumento4 paginePráctica #10 - LabAnalíticaDaniela IbarraNessuna valutazione finora
- Titulaciones Con EDTADocumento35 pagineTitulaciones Con EDTARossana100% (1)
- Volumetria ComplejosDocumento45 pagineVolumetria ComplejosRomina Espinoza GonzalezNessuna valutazione finora
- Tarea Constantes CondicionalesDocumento3 pagineTarea Constantes CondicionalesEDINSON RAFAEL ANILLO ARRIETANessuna valutazione finora
- Manual Estufa SolarDocumento12 pagineManual Estufa Solarjual09Nessuna valutazione finora
- Determiancion Intervalos de CalibracionDocumento7 pagineDetermiancion Intervalos de CalibracionGardner1983Nessuna valutazione finora
- 0.16957600 1317655670Documento234 pagine0.16957600 1317655670Gardner1983Nessuna valutazione finora
- Manual Presion Baja PDFDocumento22 pagineManual Presion Baja PDFalejamaldonadobNessuna valutazione finora
- Asamble Estudiantes EIDENARDocumento5 pagineAsamble Estudiantes EIDENARGardner1983Nessuna valutazione finora
- ProgramacionclasesSA II 2015Documento1 paginaProgramacionclasesSA II 2015Gardner1983Nessuna valutazione finora
- Planeador Bioquimica Avanzada Clase 2Documento2 paginePlaneador Bioquimica Avanzada Clase 2Gardner1983Nessuna valutazione finora
- Densidad y Peso Especifico de Solidos, Liquidos y GasesDocumento1 paginaDensidad y Peso Especifico de Solidos, Liquidos y GasesJossy Cruz50% (2)
- Procedimientos ExperimentalesDocumento105 pagineProcedimientos ExperimentalesAvilaCarlos100% (1)
- Dci Principios OmsDocumento4 pagineDci Principios OmsCeviche PradoNessuna valutazione finora
- GICUV-Presentacion ISO 17025Documento76 pagineGICUV-Presentacion ISO 17025Gardner1983Nessuna valutazione finora
- Buenas Prácticas de Pesada - GWPDocumento35 pagineBuenas Prácticas de Pesada - GWPfrancosubaruNessuna valutazione finora
- Quimica Analitica RedoxDocumento33 pagineQuimica Analitica RedoxGardner1983100% (2)
- Equilibrio (2013.08.30)Documento64 pagineEquilibrio (2013.08.30)Sebastian ViverosNessuna valutazione finora
- Fundamentos de ElectroquimicaDocumento30 pagineFundamentos de ElectroquimicaGardner1983100% (1)
- Tabla KpsDocumento4 pagineTabla KpsGardner198350% (4)
- Quimica Analitica Acido BaseDocumento137 pagineQuimica Analitica Acido BaseGardner1983Nessuna valutazione finora
- Practica No. 6 Cuantificacion de GlucogenoDocumento4 paginePractica No. 6 Cuantificacion de GlucogenoLidda Mariam Calixto HerediaNessuna valutazione finora
- Unidad 1 - Tarea 2 - Materia y ReactividadDocumento7 pagineUnidad 1 - Tarea 2 - Materia y ReactividadLilia ElizabethNessuna valutazione finora
- SEDIMENTACION1Documento32 pagineSEDIMENTACION1Elizabeth AlejandraNessuna valutazione finora
- Métodos de Análisis de Metales Pesados en Agua TerminadoDocumento20 pagineMétodos de Análisis de Metales Pesados en Agua TerminadoPatricia Pereda SimoniNessuna valutazione finora
- Análisis de Sistemas ConcentradosDocumento8 pagineAnálisis de Sistemas ConcentradosJohnChicaizaNessuna valutazione finora
- Protocolo de Prácticas Simuladas Física ModernaDocumento9 pagineProtocolo de Prácticas Simuladas Física ModernaDiego Andres Gutierrez CadenaNessuna valutazione finora
- Purificació0n de Sustancias Por Recristalización y SublimaciónDocumento6 paginePurificació0n de Sustancias Por Recristalización y Sublimaciónandres guerreroNessuna valutazione finora
- Papel Indicador de PHDocumento3 paginePapel Indicador de PHArévaloNessuna valutazione finora
- Msds Sandioss - Royal Chemical Minerals and ChemicalsDocumento6 pagineMsds Sandioss - Royal Chemical Minerals and ChemicalsROYAL CHEMICAL DEL PERUNessuna valutazione finora
- Sal de DiazonioDocumento5 pagineSal de Diazonioruben100% (3)
- MetodoDocumento81 pagineMetodoAaron PolancoNessuna valutazione finora
- Sesión 10 2022-2Documento47 pagineSesión 10 2022-2Make emo, great againNessuna valutazione finora
- Catabolismo de Aminoacidos 1Documento12 pagineCatabolismo de Aminoacidos 1Bárbara VictoriaaNessuna valutazione finora
- Problemas Repaso 1º Ev. 1º BatDocumento2 pagineProblemas Repaso 1º Ev. 1º BatEstela ClooneyNessuna valutazione finora
- Lectura 3 Parcial 1 Estructura Cristalina Endurecimiento Por Deformacion Limites de GranosDocumento40 pagineLectura 3 Parcial 1 Estructura Cristalina Endurecimiento Por Deformacion Limites de Granosadriana zelayaNessuna valutazione finora
- Recubrimientos MetalicosDocumento4 pagineRecubrimientos MetalicosErik ToledoNessuna valutazione finora
- SubtilisinaDocumento5 pagineSubtilisinafelicidadNessuna valutazione finora
- Escalas de Temperatura TallerDocumento3 pagineEscalas de Temperatura TallerLaura Camila Medina PatiñoNessuna valutazione finora
- Pre Presentacion 13 7v Nomenclatura 1 2023 1Documento27 paginePre Presentacion 13 7v Nomenclatura 1 2023 1Nicolle Campos chamorroNessuna valutazione finora
- Reporte de Practica, 1, Equipo 1, Analisis de AlimentosDocumento18 pagineReporte de Practica, 1, Equipo 1, Analisis de AlimentosSergio AlarconNessuna valutazione finora
- Los AminoácidosDocumento5 pagineLos AminoácidosSebastian OliverosNessuna valutazione finora
- Lección 03 - Reacciones QuímicasDocumento14 pagineLección 03 - Reacciones QuímicasLuciana CedrónNessuna valutazione finora
- Metabolismo Celular para Quinto Grado de SecundariaDocumento7 pagineMetabolismo Celular para Quinto Grado de SecundariaJoab CelsoNessuna valutazione finora
- Procesos de Manufactura ExpoDocumento19 pagineProcesos de Manufactura ExpoMaria Lucia Jaime VergelNessuna valutazione finora
- Anexo 1 - Diseño Estructural PrefiltroDocumento8 pagineAnexo 1 - Diseño Estructural PrefiltroChristian Parra OrtegaNessuna valutazione finora
- Nenn U2 A2 Salr.Documento6 pagineNenn U2 A2 Salr.Ney RodriguezNessuna valutazione finora
- Flujo Multifasico 2Documento15 pagineFlujo Multifasico 2Anonymous Y9j05cTO4aNessuna valutazione finora
- Regulación Renal de K, Ca, FosfatoDocumento47 pagineRegulación Renal de K, Ca, FosfatoElias BalderramaNessuna valutazione finora
- Programación AnualDocumento21 pagineProgramación AnualAnderson Gonzales MarloNessuna valutazione finora
- Manual Practicas QAIDocumento10 pagineManual Practicas QAILuis Peña PlazasNessuna valutazione finora