Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Reconocimiento Act 2 de Termodinamica
Caricato da
elizabeth2005Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Reconocimiento Act 2 de Termodinamica
Caricato da
elizabeth2005Copyright:
Formati disponibili
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
UNAD
RECONOCIMIENTO DEL CURSO
(INDIVIDUAL)
FASE 1: RESUMEN DE CONCEPTOS PRINCIPALES DE TERMODINMICA
Y
RESUMEN DE ECUACIONES DEL CURSO DE TERMODINMICA
ESTRUCTURA DEL CURSO
GRUPO No. 201015_16
PRESENTADO POR:
MARTHA LUCIA ARTEAGA C.
COD: 39644105
Email. Marthaluciaarteaga2006@hotmail.com
TUTORA:
VICTORIA GUTIERREZ
BOGOT D.C. FEBRERO DE 2013
INTRODUCCIN
La termodinmica es una ciencia que se ocupa del estudio de la energa y sus
transformaciones, particularmente la del calor en trabajo. En las que ms
cambios podemos observar es la industria de la qumica, farmacutica o la de
alimentos, donde podremos verificar las transformaciones que sufren las materias
primas mediante procesos qumicos o fisicoqumicos las consideraciones
energticas son muy importantes y definitivas a la hora de tomar una decisin
frente al diseo de equipos, la implementacin de nuevos procesos para realizar
cambios en los ya existentes.
OBJETIVOS GENERALES
Identificar los principios de conservacin de la energa, las leyes de
termodinmica y la estimulacin de propiedades para la evaluacin de
procesos y sistemas mediante el anlisis de los cambios de estado.
Reconocer las caractersticas, componentes, cambios y la expresin
matemtica de un sistema termodinmico.
Describir la energa, sus formas, condiciones de transformacin y las
ecuaciones termodinmicas que la relacionan.
Conocer y aplicar los principios y el significado de la entropa en un sistema
termodinmico.
Poder aplicar las trayectorias en un ciclo termodinmico y su aplicacin en
las mquinas trmicas.
Conocer y aplicar el significado de combinar la primera y la segunda ley de
la termodinmica, su relacin con la energa libre y la espontaneidad y
tendencia al equilibrio en un proceso termodinmico.
Poder describir nociones, conceptos y problemticas bsicas que
configuran los campos generales de la termodinmica mediante el estudio y
anlisis de situaciones especificas de determinados campos del saber.
RESUMEN DE LOS PRINCIPALES CONCEPTOS DE TERMODINMICA
SISTEMAS ABIERTOS: Aquellos donde hay intercambio tanto de materia
como de energa
SISTEMAS CERRADOS: Aquellos en los que hay intercambio de energa
pero no de materia.
SISTEMAS AISLADOS: Aquellos en los que no se presentan intercambio
ni de materia ni d energa.
ESTADO: Del sistema est determinado por el calor de sus propiedades en
un instante.
PROCESO REVERSIBLE: Es aquel que una vez efectuado puede
invertirse, para que un proceso sea reversible es necesario que solo se
aporte en forma infinitesimal del equilibrio al pasar de un lado al otro.
PROCESO ISOTERMICO: Es un proceso que se realiza mediante
determinadas condiciones manteniendo la temperatura constante.
PROCESO ISOBRICO: Mantiene la presin constante.
PROCESO ISOCRICO O ISOMETRICO: Mantiene volumen contante.
PROCESO ADIABATICO: No existe transferencia de calor entre el sistema
y los alrededores.
TRAYECTORIA: Es una serie de estados intermedios y sucesivos por los
que pasa un sistema para ir de un estado a otro.
LEY CERO DE LA TERMODINMICA: Si dos cuerpos se encuentran en
equilibrio trmico con un tercero los dos se encontrarn en equilibrio
trmico entre s.
CALOR: Es la energa transferida entre dos sistemas debido a la diferencia
de temperatura.
CONDUCCIN: Forma de transmisin de calor donde las molculas ms
energtica transfiere su energa a las adyacentes menos energticas.
CONVECCIN: Forma de transmisin de calor que se presenta entre una
superficie solida y un lquido o gas por agentes exteriores o por diferencia
de intensidad.
RADIACIN: Forma de transmisin de calor mediante ondas
electromagnticas generadas por la temperatura.
TRABAJO: Forma particular de energa que corresponde a una magnitud
escalar, definida como el producto de la fuerza y el desplazamiento
realizado en la misma direccin de la fuerza. Para poder calcular el trabajo
es necesario conocer cmo cambia la presin en funcin del volumen.
ECUACIN DE ESTADO DE GAS IDEAL: Se expresa as: PV = nRT.
Todo gas cuyas propiedades cumplan con esta ecuacin se considera que
tiene un comportamiento ideal.
GASES REALES: Se apartan en mayor o menor medida del
comportamiento ideal dependiendo de su naturaleza de la cercana al punto
crtico a presiones elevadas o a temperaturas muy bajas.
PRIMERA LEY DE LA TERMIDINMICA: Es una derivacin de la ley de la
conservacin de la energa y establece que a un sistema al cual se le
suministra energa en forma de trabajo debe aparecer o un incremento en
su energa interna o manifestarse esta energa en forma de calor. La
entalpa se define como la suma de la energa interna ms el producto de la
presin por el volumen.
CAPACIDAD CALORIFICA: Es la cantidad de calor que se debe
suministrar a un sistema para modificar su temperatura en un grado.
CALOR LATENTE: Es igual al cambio de entalpa. El trabajo de un proceso
adiabtico, Para un sistema gaseoso que tiene comportamiento ideal el
cambio de entalpa depende solo de los cambios de temperatura por lo que
es independiente de la presin. Para el caso de gases reales si el cambio
de presin no es muy grande el efecto de la presin sobre el calor es
despreciable. Para productos o reactivos solios o lquidos la presin ejerce
para influencia sobre la entalpa y se desprecia.
LEY DE HESS: Si una reaccin qumica es susceptible de expresarse
como una sumatoria de reacciones secuenciales el cambio de entalpa de
la regin es igual a la sumatoria de los cambios de entalpa en cada una de
las reacciones intermedias. En reacciones de gases donde generalmente la
temperatura y el volumen son constantes, el trabajo igual a cero, por lo que
el calor de reaccin es igual al cambio de energa interna del sistema.
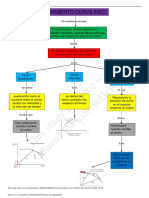
CICLOS TERMODINAMICOS: Las mquinas trmicas reales trabajan con
ciclos que son complejos debido a la presencia de fenmenos irreversibles.
CICLO DE OTTO: Es el ciclo termodinmico ideal mediante el cual se
modela el funcionamiento de las mquinas de encendido por chispa ya sea
de dos o cuatro tiempos, consta de cuatro procesos internamente
reversibles.
CICLO DE DIESEL: Los motores de encendido por compresin funcionan
mediante el ciclo de Diesel el cual consta de cuatro etapas internamente
reversibles.
CICLO DE BRAYLON: Los motores de las turbinas de gas funcionan
mediante el ciclo de Braylon el cual consta de cuatro etapas internamente
reversibles.
CICLO DE RANKINE: Empleado en centrales termoelctricas para la
produccin de energa en donde el fluido de trabajo cambie de fase.
EL CICLO INVERSO DE CARNOT: Ideal para refrigeradores o bombas de
calor.
RECONOCIMIENTO DE LA UNIDAD 2
SEGUNDA LEY DE LA TERMODINMICA: El enunciado de kelvin -
Planck establece que es imposible construir un dispositivo que funcionando
en forma cclica su nico efecto sea convertir completamente en trabajo
todo el calor procedente de una fuente trmica. El enunciado de Clausius
establece que n o es posible construir un dispositivo que funcionando en
forma cclica su nico efecto sea conducir calor de una fuente trmica a
baja temperatura hacia otra de mayor temperatura.
EFICIENCIA DE UNA MQUINA TERMICA: La eficiencia de un
refrigerador se expresa en trminos del coeficiente de operacin, COP,
como la relacin entre el calor retirado del sitio de refrigeracin y el trabajo
suministrado durante el ciclo. La eficiencia de una bomba de calor se
expresa como la relacin entre el calor suministrado hacia los alrededores y
el trabajo suministrado durante el ciclo.
APLICACIN EN LA INDUSTRIA DE LOS ALIMENTOS
CALEFACCIN: Se encuentra asociada a los procesos de coccin,
escaldado, pasteurizacin, horneado, fruido o a las operaciones de
vaporacin, secado, deshidratacin, destilacin o intercambio de calor.
EVAPORACIN: Es una operacin muy frecuente en la industria de los
alimentos. El empleo apropiado de bajas temperaturas para la
conservacin de los alimentos debido a la inhibicin de crecimiento de
microorganismos y la actividad enzimtica. El acondicionamiento del aire
surge la necesidad de proporcionar un entorno como para el trabajo un
ambiente apropiado para el almacenamiento y para permitir el
funcionamiento adecuado de equipos electrnicos.
HUMEDAD ESPECFICA: Generalmente se representa por la letra W.
HUMEDAD RELATIVA: Es la relacin entre la cantidad de agua presente
en el aire y la cantidad mxima de agua que el aire puede contener a una
determinada temperatura.
PUNTO DE ROCIO: Es la temperatura a la cual se produce la
condensacin de una mezcla de aire y vapor de agua que enfra a presin
constante.
CARTA PSICOMETRICA: Es un diagrama donde se encuentran
representados las propiedades como humedad relativa, humedad
especfica, entalpa, volumen especfico, presin de vapor, temperatura de
bulbo seco y temperatura de bulbo hmedo, para un estado determinado de
la mezcla de aire y vapor de agua a presin constante que generalmente es
de 1 atmosfera o 101, 325 Kpa en el eje y hacia el lado derecho se
representan las humedades especificas (w) y en el eje horizontal las
temperaturas de bulbo seco (Tbs).
SECADO: Es una operacin comn en la industria de los alimentos y
consiste en reducir el contenido del agua en un alimento mediante
evaporacin la cual se realiza en forma natural exponiendo el producto a la
accin de los rayos solares o llevando el producto a un equipo en donde se
pone en contacto con una corriente de aire caliente y seco.
RESUMEN DE ECUACIONES
UNIDAD 1
CAPITULO 1
LECCIN 2
Escala de temperaturas
T (K) = (C) + 273,15
LECCIN 3
Transmisin de calor por conductividad
Q = K
t
A
LECCIN 4
Ecuacin de estado
PV = nRT
Ecuacin de Waals
P =
LECCIN 5
Ecuacin de Redlich- Kwong
P =
Ecuacin de Redlich Kwong Souve
2 2
1+m 1- T
Tc
LECCIN 6
Trabajo
W =
CAPITULO 2
LECCIN 7
Ecuacin general
LECCIN 8
Diagrama PV
X =
LECCIN 9
Funcin de punto
LECCIN 10
Capacidad calorfica
C =
CAPITULO 3
LECCIN 11
Proceso Isotrmico
1
Q
2
= nRTLn
LECCIN 13
Calor normal de formacin
H
o
f (H
2
O)(l) = H
o
f (H
2
O)(l)- H
o
H2
(g) + H
2
(g)
LECCIN 14
Reaccin a partir de calor de combustin
H
o
R
= n
i
H
o
C Rj
- n
i
H
o
C Pj
UNIDAD 2
CAPITULO 4
LECCIN 16
Integracin de Ecuaciones
U
2
U
1
=
LECCIN 17
Segunda ley de la Termodinmica
W =
c
f
LECCIN 18
El Ciclo de Carnot
Q
1 + W
= Q
2
LECCIN 19
Entropa
= 0
LECCIN 20
Calentamiento irreversible
S
sistema
=
T2
=
T2
T1 T1
CAPITULO 5
LECCIN 21
La mquina de vapor. Ciclo de Rankine
n =
LECCIN 22
Motores de cuatro tiempos Ciclo de Otto
-1
= 1
= 1-
LECCIN 23
Motores por ignicin por compresin. Ciclo Diesel
T
3
=
LECCIN 24
Ciclo de Brayton
- 1
-1
LECCIN 25
Mquinas frigorficas
=
LECCIN 26
Anlisis Dimensional
ENERGA = p.v
CAPITULO 6
LECCIN 27
Aplicacin de las leyes de la termodinmica a procesos
de flujo continuo
(m
t + t
m
t
) + (m
e
m
i
) = 0
LECCIN 28
Aplicaciones de la termodinmica a procesos de flujo
estable
Pi Vi Ai
=
P
j
V
j
A
j
LECCIN 29
Aplicaciones de la termodinmica a procesos de flujo
estable
W = -h
LECCIN 30
Aplicaciones de las leyes de la termodinmica a
procesos de flujo transitorio.
E
vc
= m
i
h
i
CONCLUSIONES
Este curso contempla todo el desarrollo de las diferentes unidades que
componen el curso cubriendo las temticas con las diferentes ecuaciones a
desarrollar para poder cumplir con el programa de Ingeniera de Alimentos de la
UNAD, todos los captulos de cada unidad presentan una estructura similar con el
fin de facilitar el estudio auto dirigido de la termodinmica.
BIBLIOGRAFIA
Mdulo: MNERA TANGARIFE, Rubn Daro (2009) Termodinmica Bogot
UNAD.
Potrebbero piacerti anche
- Defectos de La MantequillaDocumento2 pagineDefectos de La Mantequillaelizabeth2005Nessuna valutazione finora
- Info CP7 TodoDocumento1 paginaInfo CP7 Todoelizabeth2005Nessuna valutazione finora
- Caso 1Documento3 pagineCaso 1elizabeth2005Nessuna valutazione finora
- Orden y AseoDocumento2 pagineOrden y Aseoelizabeth2005Nessuna valutazione finora
- Defectos de La MantequillaDocumento2 pagineDefectos de La Mantequillaelizabeth2005Nessuna valutazione finora
- Resolución 2674 de 2013Documento35 pagineResolución 2674 de 2013dolmix09Nessuna valutazione finora
- Herramienta Excel de ApoyoDocumento52 pagineHerramienta Excel de Apoyoelizabeth2005Nessuna valutazione finora
- Grasas y Aceites 3Documento34 pagineGrasas y Aceites 3Isaac Anibal Cuba JimenezNessuna valutazione finora
- PROYECTO RESOLUCIÓN - Requisitos Derivados LacteosDocumento57 paginePROYECTO RESOLUCIÓN - Requisitos Derivados LacteosCamiloandres GalvisrojasNessuna valutazione finora
- Quiz NutricionDocumento12 pagineQuiz Nutricionelizabeth2005Nessuna valutazione finora
- Guia Integrada Actividades 211615-2015-IDocumento16 pagineGuia Integrada Actividades 211615-2015-Ielizabeth2005Nessuna valutazione finora
- Examen Final ElectricidadDocumento32 pagineExamen Final Electricidadelizabeth2005Nessuna valutazione finora
- PROYECTO RESOLUCIÓN - Requisitos Derivados LacteosDocumento57 paginePROYECTO RESOLUCIÓN - Requisitos Derivados LacteosCamiloandres GalvisrojasNessuna valutazione finora
- Guia Integrada Actividades 211615-2015-IDocumento16 pagineGuia Integrada Actividades 211615-2015-Ielizabeth2005Nessuna valutazione finora
- Diseño EperimentalDocumento3 pagineDiseño Eperimentalelizabeth2005Nessuna valutazione finora
- Tecnologia de Cereales y OleaginosasDocumento78 pagineTecnologia de Cereales y OleaginosasCraig Clark100% (1)
- Quiz NutricionDocumento12 pagineQuiz Nutricionelizabeth2005Nessuna valutazione finora
- Paisaje y UrbanismoDocumento12 paginePaisaje y Urbanismoelizabeth2005Nessuna valutazione finora
- Evaluaciones Unidad 1corregidas - Tecnicas de Investigacion - Unad 2013Documento10 pagineEvaluaciones Unidad 1corregidas - Tecnicas de Investigacion - Unad 2013John Alexander Delgado LeyvaNessuna valutazione finora
- Examenes Metodología de La InvestigaciónDocumento76 pagineExamenes Metodología de La Investigaciónelizabeth2005Nessuna valutazione finora
- ANOVA Multifactorial - Docx 2Documento6 pagineANOVA Multifactorial - Docx 2elizabeth2005Nessuna valutazione finora
- LWT - Ciencia y Tecnología de AlimentosDocumento27 pagineLWT - Ciencia y Tecnología de Alimentoselizabeth2005Nessuna valutazione finora
- Bebidas Fermentadas PDocumento6 pagineBebidas Fermentadas Pelizabeth2005Nessuna valutazione finora
- 1 Leccion Evaluativa NumeroDocumento10 pagine1 Leccion Evaluativa Numeroelizabeth2005Nessuna valutazione finora
- OVA Unidad 1Documento8 pagineOVA Unidad 1juancholo7Nessuna valutazione finora
- Evaluación Nacional 2012Documento21 pagineEvaluación Nacional 2012elizabeth2005Nessuna valutazione finora
- Evaluacion de PresaberesDocumento5 pagineEvaluacion de Presabereselizabeth2005Nessuna valutazione finora
- Diseno de InvestigacionDocumento57 pagineDiseno de InvestigacionPao PaoNessuna valutazione finora
- Evaluaciones Unidad 1corregidas - Tecnicas de Investigacion - Unad 2013Documento10 pagineEvaluaciones Unidad 1corregidas - Tecnicas de Investigacion - Unad 2013John Alexander Delgado LeyvaNessuna valutazione finora
- Arreo de Las Vacas Hacia El Tambo FolletoDocumento4 pagineArreo de Las Vacas Hacia El Tambo Folletoelizabeth2005Nessuna valutazione finora
- A. Ejerc. Desarrollado de Resist. Mat. IDocumento15 pagineA. Ejerc. Desarrollado de Resist. Mat. IVidal Odon Ramos Merma100% (1)
- Actividad de Aprendizaje - Trabajo Mecánico - 5toDocumento1 paginaActividad de Aprendizaje - Trabajo Mecánico - 5toJheyson Noa DueñasNessuna valutazione finora
- Placas Planas y EsferasDocumento16 paginePlacas Planas y EsferasVane MolinaNessuna valutazione finora
- S01.s2 - Cargas Eléctricas y Ley de CoulombDocumento17 pagineS01.s2 - Cargas Eléctricas y Ley de CoulombMayeli ZrNessuna valutazione finora
- Electricidad y Magnetismo Elemental UamDocumento4 pagineElectricidad y Magnetismo Elemental UamAedb3Nessuna valutazione finora
- Obj. 10 Rotacion de Un Objeto RigidoDocumento3 pagineObj. 10 Rotacion de Un Objeto RigidoMargaro85Nessuna valutazione finora
- Ecuacion de Euler y BernoulliDocumento20 pagineEcuacion de Euler y BernoulliCristhian JP100% (3)
- Informe 4Documento8 pagineInforme 4Nelson BosquezNessuna valutazione finora
- Fisica 2 Examen Final Regular - Tema1 UeDocumento4 pagineFisica 2 Examen Final Regular - Tema1 UeLian TumaNessuna valutazione finora
- T5 Deformacion Ciclica Modelo E-NDocumento35 pagineT5 Deformacion Ciclica Modelo E-NMikel MendiaNessuna valutazione finora
- Formulario Forjado, Extrusion y LaminadoDocumento8 pagineFormulario Forjado, Extrusion y LaminadoMiguel100% (1)
- Tarea Semana 1 FisicaDocumento5 pagineTarea Semana 1 Fisicaale artys100% (5)
- Definición de VoltajeDocumento77 pagineDefinición de Voltajeisaias mendez almeidaNessuna valutazione finora
- Mapa Conceptual 3 PDFDocumento1 paginaMapa Conceptual 3 PDFCamilo VinuezaNessuna valutazione finora
- 01TALLER Oscilaciones Libres - MASDocumento3 pagine01TALLER Oscilaciones Libres - MAScarlos arceNessuna valutazione finora
- Guia 0 Parte 1 Funciones Derivadas e Integrales SolucionesDocumento9 pagineGuia 0 Parte 1 Funciones Derivadas e Integrales SolucionesPablo ViverosNessuna valutazione finora
- Guía de Apendizaje DinámicaDocumento6 pagineGuía de Apendizaje DinámicaBrassy JarlNessuna valutazione finora
- 04 Ondas MecanicasDocumento38 pagine04 Ondas Mecanicasedy meNessuna valutazione finora
- Columnas 1 ADocumento29 pagineColumnas 1 ALes Cadena RNessuna valutazione finora
- Curso Diseño de Losas Vigueta y BovedillaDocumento66 pagineCurso Diseño de Losas Vigueta y BovedillaOmar Luna J.Nessuna valutazione finora
- Protocolo de Prueba Campo Cercano U.M. CHINALCO - B3-DIO PDFDocumento12 pagineProtocolo de Prueba Campo Cercano U.M. CHINALCO - B3-DIO PDFCarlos LopezNessuna valutazione finora
- Puente PrattDocumento16 paginePuente PrattRevollo NefiNessuna valutazione finora
- Experimento #01 Descarga de Orificio.Documento19 pagineExperimento #01 Descarga de Orificio.Jhon JesúsNessuna valutazione finora
- Unidad 5 EstáticaDocumento14 pagineUnidad 5 EstáticaMarcos Augusto ZetinaNessuna valutazione finora
- FISICA II - Deformacion Unitaria PDFDocumento4 pagineFISICA II - Deformacion Unitaria PDFShion de AriesNessuna valutazione finora
- Laboratorio de Fisica Electromagnetica Ley de CoulomDocumento14 pagineLaboratorio de Fisica Electromagnetica Ley de CoulomBLANCA MOLINANessuna valutazione finora
- Trabajo DinámicaDocumento4 pagineTrabajo DinámicaGabriel YucraNessuna valutazione finora
- Practiga YogurtDocumento5 paginePractiga YogurtJazmin ChasipantaNessuna valutazione finora
- Conducción en Estado Transitorio o No EstableDocumento23 pagineConducción en Estado Transitorio o No EstableEric HansenNessuna valutazione finora
- Fluidos PDFDocumento9 pagineFluidos PDFKasandra CallupeNessuna valutazione finora