Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Ejercicios de Aplicación Analitica
Caricato da
Anonymous QX8RIly6fTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Ejercicios de Aplicación Analitica
Caricato da
Anonymous QX8RIly6fCopyright:
Formati disponibili
Ejercicios de aplicacin
Rubn Daro Osorio Giraldo Facultad de Ciencias Exactas y Naturales Universidad de Antioquia 1. Verdadero y Falso. Colocar una V si el enunciado es Verdadero o una F si es Falso.
( ( ( ( (
) ) ) ) )
Las soluciones son mezclas qumicas de sustancias homogneas. El soluto de una solucin verdadera no es observable ni an con microscopio. Las soluciones saturadas son estables, las sobresaturadas no lo son. La concentracin de una solucin depende de la cantidad de solucin. La molalidad es el nmero de moles de soluto en 1 kg de solucin. a. n especie/V sln b. Slido disperso en aire c. Medio dispersante d. Solucin de gas en gas e. n sto/kg ste f. Mxima cantidad g. mg sto/kg sln h. n sto/n tot i. Lquido disperso en lquido j. p = MRT k. DTc = kC.m l. Membrana semipermeable
2. Apareamiento. Encuentre las parejas que se correlacionan.
1. Partes por milln 2. Molalidad 3. Emulsin 4. Solucin saturada 5. Molaridad 6. Aire 7. Humo 8. Solvente 9. Fraccin molar 10. smosis 11. Descenso crioscpico 12. Presin osmtica ( ( ( ( ( ( ) ) ) ) ) )
3. Verdadero y Falso. Colocar una V si el enunciado es Verdadero o una F si es Falso.
La temperatura de ebullicin de una solucin depende de su concentracin. En un coloide, las partculas de la fase dispersa se pueden observar al microscopio. El agua de mar es una solucin verdadera. Las sustancias solubles en agua son generalmente compuestos polares o inicos. Las propiedades coligativas dependen de la naturaleza del soluto y del nmero de partculas disueltas. Una solucin 0.0010 M es equivalente a una solucin 0.0010 m.
4. Apareamiento y seleccin mltiple. Cuando 5.55 g de CaCl2 se disuelven en 400 g de agua, se forma una solucin de densidad 1.10 g/mL.
1. Partes por milln a. 0.250 2. Molalidad b. 0.138 3. Porcentaje en peso c. 1.52 104 4. Fraccin molar d. 1.38 5.C CaCl2 e. 0.00224
6. [Cl-]
f. 0.125
5. Si se pesan 5.6 g de KOH y se adiciona agua hasta completar 500 mL de solucin, la concentracin resultante es, aproximadamente: a. 0.040 M b. 0.56 M c. 5.6 M d. 0.020 M e. 0.20 M
Unidades de concentracin
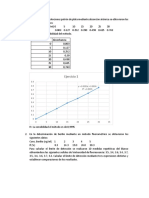
1. Completar la siguiente tabla para soluciones acuosas de glucosa, 2 C6H12O6 :
Masa de soluto (g) 12.5 1.20
n (sto)
Volumen sln (mL) 250
CT (mol/L)
0.520 1250 0.800
2
2. Completar la siguiente tabla para soluciones acuosas de NaOH:
d (g/mL) 1.05 1.22 1.35
CT, mol/L 1.32
molalidad
Porcentaje p/p (%)
20.0 11.8
3. Una serie de anlisis realizados a jugos de naranja, limn y uva dieron los siguientes resultados, en porcentajes por peso:
Componentes Carbohidratos Ca P Fe
Naranja, % 10.8 0.029 0.016 0.0002 9.8
Limn, % 25
Uva, %
0.0041 0.0026 0.000075
0.011 0.011 0.0003
4. Se desea sustitur 100 g de jugo de limn por cierta cantidad de jugo de uva y de naranja, 3 de modo que cada uno de ellos aporte la misma cantidad de Ca . a. Cuntos gramos de naranja y de uva sern necesarios? R/. 14 g, 37 g b. Cmo varan en cada caso los aportes de carbohidratos? R/. 1.5 g, 9.3 g
5. Un acuario de 60.0 L contiene peces afectados por una variedad de hongo denominada saprolegnia. El tratamiento recomendado es aadir una solucin de CuSO 4 de modo que la concentracin de Cu en el acuario no sobrepase de 0.80 ppm. Si se dispone de una solucin de CuSO4 al 5.0% p/v, Cuntas gotas deben aadirse al acuario para lograr la dosis correcta? (1 mL = 20 gotas) R/. 48 gotas 6. Un recipiente pequeo que contiene cloruro de amonio, NH4Cl, pesa 27.8793 g. Una porcin del slido se removi y se transfiri cuidadosamente a un matraz aforado de 1 L. El recipiente ms el slido remanente pes 22.5293 g. Luego se prepar una solucin 4 acuosa aadiendo agua hasta el aforo. Calcular la concentracin del cloruro de amonio. R/. 0.100 M 7. Una solucin acuosa contiene 109.2 g de KOH/L. La densidad de la solucin es 1.09 g/mL. Se desean utilizar 100 mL de esta solucin para preparar KOH 0.250 m. Qu masa 5 de KOH y/o agua debe aadirse a los 100 mL iniciales? R/. 681 g de agua 8. Calcular cmo pueden prepararse 250 g de solucin de Na 2CO3 al 10% en peso a partir del 6 Na2CO3.10H2O y agua. R/. 67.5 g de Na2CO3.10H2O, 182.5 g de H2O 9. En 1000 g de agua a 20 C se disuelven 725 L de NH3 medidos a 20 C y 744 torr. La disolucin resultante tiene una densidad de 0.882 g/mL. Calcular la concentracin de la 6 solucin de NH3 y el aumento de volumen que experimenta el agua al disolver el gas. R/. 17.3 M, 704 mL 10. Al preparar una solucin de HCl ha resultado algo diluda pues es tan solo 0.932 M. Calcular el volumen de HCl 32.14% en peso y densidad 1.160 g/mL que hay que aadir a 1 6 L del cido diludo para que resulte exactamente 1.000 M. R/. 7.37 mL 11. El formol es una solucin antisptica que se usa en biologa. Contiene 40 mL de formaldehdo, CH2O (d = 0.82 g/mL) por cada 100 mL de agua. Cul es la molalidad del 2 formaldehdo en el formol? R/. 10.9 m 2 12. Se ha preparado una solucin disolviendo 1.25 g de C2H5OH en 11.6 g de agua. Calcular: a. El porcentaje por peso de C2H5OH. R/. 9.73 % b. La fraccin molar de agua c. La molalidad del C2H5OH. R/. 2.34 mol/kg 13. Se desean preparar 250 mL de solucin de HNO 3 2.0 M a partir de dos soluciones de HNO3 1.0 M y 4.0 M. Determinar qu volumen de cada solucin es necesario mezclar, sin 7 aadir agua, para obtener la solucin requerida. R/. 167 mL y 83 mL 14. El HBr tiene una concentracin de 48.0% de HBr en peso y una densidad de 1.50 g/mL. a. Cuntos gramos de HBr concentrado deben utilizarse para preparar 500 mL de solucin de HBr 0.600 M? R/. 50.6 g b. Cuntos mililitros de HBr concentrado deben utilizarse para preparar esta solucin? R/. 33.7 mL 15. Hasta qu volumen deben dilurse 50.00 mL de una solucin 0.40 M de Cr 2(SO4)3.18H2O 9 para preparar una solucin 0.050 M de Cr 2(SO4)3? R/. 400 mL 16. Una muestra de roca que contena piedra caliza (CaCO 3) se calent convirtiendo el CaCO3 en CaO. Este se trat con agua para prosucir Ca(OH) 2 que se valor despus con HCl. En un anlisis, una muestra de 0.200 g tomada despus que el CaCO 3 se convirti en CaO, requiri 30.30 mL de HCl 0.100 M para su neutralizacin. Cul es el porcentaje 8 de CaCO3 en la roca original? R/. 56.9% 17. Se tienen 20.00 g de una solucin acuosa al 10.0% en peso de NaNO 3. Cuntos gramos 10 de NaNO3 puro deben aadirse para que la solucin se convierta en otra al 20.0%? R/. 2.00 g 18. Una muestra de 35.0 mL de HCl concentrado se diluy a un volumen final de 125 mL. El cido concentrado tiene un 37.0 % en masa de HCl y tiene una densidad de 1.18 g/mL.
19.
20.
21.
22.
23.
24.
25.
26.
Cul es la concentracin de la solucin final? R/. 3.35 M Si se diluye 1.0 L de HCl del 37% p/p y densidad 1.19 g/mL, hasta obtener un cido del 1 25%, qu cantidad de agua debe aadirse? R/. 570 mL La obtencin de vinos comprende una serie de reacciones complejas realizadas en su mayor parte por microorganismos. La concentracin inicial en azcares de la solucin inicial o "mosto" es la que determina el contenido final de alcohol del vino. Si en la produccin de un determinado vino se parte de un mosto con una densidad de 1.093 g/mL 1 y con un 11.5% por peso de azcar, calcular: a. Kg azcar/kg agua. R/. 0.130 Kg b. g azcar/L de mosto. R/. 126 g Un laboratorio dedicado al estudio de los efectos de los productos qumicos en el cuerpo humano, ha establecido que no se puede sobrepasar la concentracin de 10 ppm de HCN en el aire durante 8 hr seguidas si se quiere evitar riesgos para la salud. Sabiendo que una dosis letal de HCN en el aire (segn el ndice Merck) es de 300 mg/Kg de aire a temperatura ambiente, a cuntos mg HCN/Kg de aire equivalen las 10 ppm? Cul es la 1 fraccin de dosis letal en 10 ppm? R/. 9.31 mg/Kg, 3.1% Los nitratos empleados como abonos o que entran en la composicin de los explosivos minerales, se obtienen a partir de un cido ntrico cuya composicin no rebasa el 55%. Si se parte de un cido ntrico concentrado (68% en peso, densidad 1.52 g/mL), qu 1 volumen debe medirse para obtener 100 L de cido 55%, densidad 1.43 g/mL? R/. 76.1 L Se debe preparar una solucin conteniendo un 8.5% de KI que ser utilizada para grabar oro en las tarjetas de circuitos impresos. Dicha solucin se debe efectuar con base en una solucin concentrada con 15% de KI y otra diluda con un 2.6% de KI. Cul debe ser la 1 relacin de masas de ambas soluciones a fn de preparar la solucin deseada? R/. 0.91 La fabricacin del cido sulfrico es una de las ms importantes aplicaciones de la industria qumica. Uno de los mtodos ms empleados (ahora en desuso) es el denominado de las "cmaras de plomo" en el cual se obtiene cido con un 63.66% en peso de H2SO4. Calcular la cantidad de agua que debe evaporarse por Kg de mezcla inicial, 1 para concentrar dicho cido hasta alcanzar un 75% de riqueza. R/. 151 g Cierta empresa industrial dedicada a la produccin de jabones y detergentes lquidos desea preparar 10.00 g de una disolucin de leja de sosa al 60%. Para ello parte de NaOH slido del 97% en peso pero se comete un error y se aade un exceso de agua por lo que la leja resulta ser del 54%. Cunto NaOH slido del 97% en peso debe aadirse a la 1 solucin para obtener la concentracin deseada? R/. 1.622 g Durante un proceso industrial de produccin de HCl 1.0 M se ha cometido un error que da como resultado la produccin de HCl 0.937 M. Calcular el volumen de HCl de 39% en peso y densidad 1.160 g/mL que debe aadirse a 1000 L de la solucin inicial para que resulte 1 exactamente 1.0 M. R/. 5.52 L
Estequiometra de soluciones
27. Una planta industrial necesita producir 7800 Kg de CaSO 4. Para ello dispone de las materias primas necesarias: CaCO3 y H2SO4. El CaCO3 se encuentra en estado puro y el cido en solucin de densidad 1.2 g/mL y 90% en peso. Si se sabe que el rendimiento de 1 la reaccin es de 84%, qu volumen de cido debe emplearse? R/. 6190 L 28. Cierta empresa industrial compra 5000 Kg de Zn con el fin de usarlo para galvanizar una partida de hierro de que dispone y as evitar su corrosin. Para determinar la pureza del cinc comprado se toman 50.00 g del mismo y se tratan con HCl del 37% en peso y densidad 1.180 g/mL, consumindose 126 mL de cido. Calcular el porcentaje de pureza
del Zn y la concentracin molar analtica del HCl. R/. 98.8%, 12.0 M 29. Cierta empresa compra 150 Kg de sulfuro de cobre (II) para su posterior uso en un proceso industrial. Con el fn de determinar la pureza del compuesto se hacen reaccionar 0.250 g del mismo con HNO3 diludo y se necesitan 24.0 mL del cido para disolver el compuesto. Sabiendo que 15.0 mL del cido neutralizan 17.0 mL de NaOH 0.150M, determinar la 1 pureza del mineral. R/. 78.0% 30. Calcular el peso y el volumen de solucin amoniacal de un 18.45 % en peso de NH 3 y densidad 0.928 g/mL, que puede obtenerse a partir de 1000 g de (NH4)SO4 del 96.3 % de 6 pureza y cal viva en exceso. R/. 1345 g, 1450 mL
(NH4)2SO4 + CaO NH3 + CaSO4 + H2O
31. La reaccin que se da a continuacin puede utilizarse en el laboratorio como procedimiento para preparar cantidades pequeas cantidades de Cl2(g). Si se hace reaccionar una muestra de 62.6 g que tiene 98.5% en peso de K2Cr2O7, con 325 mL de HCl de densidad 5 1.15 g/mL y 30.1% en peso, cuntos gramos de Cl2(g) se obtienen?
Cr2O72- + H3O+ + Cl- Cr3+ + H2O + Cl2(g)
32. Un trozo de mrmol (suponga que es CaCO3 puro) reacciona con 2.00 L de HCl 2.52 M. Despus de disolverse, se extrae una muestra de 10.00 mL del HCl sobrante, se aade un poco de agua y se valora con 24.87 mL de NaOH 0.9987 M. Cul debe haber sido la 5 masa del trozo de mrmol? R/. 7.25 g 33. Se agregan 3.27 g de Mg a 250 mL de solucin de HCl 2.08 M. Si se supone que el 6 volumen no cambia, calcular la concentracin del cido que queda despus del ataque. R/. 1.00 M 34. Cuando se aade agua a una mezcla de aluminio e hidrxido sdico, se desprende 2 hidrgeno. Esta reaccin se utiliza comercialmente en algunos productos de limpieza:
Al(s) + OH- + H2O Al(OH)4- + H2(g)
Se mezcla una cantidad suficiente de agua con 50.00 g de NaOH para obtener 600 mL de solucin; se aaden 41.28 g de Al: a. Calcular la concentracin inicial de la solucin de NaOH. b. Cuntas moles de H2 se formarn? c. El hidrgeno se recoge a 25C y 758.6 torr. La presin de vapor del agua a esta temperatura es de 23.8 torr. Cul es el volumen de gas generado? 35. Calcular la cantidad de Cu(NO3)2.6H2O que puede obtenerse a partir de 100 mL de HNO3 6 3.00 M sobre un exceso de cobre. R/. 33.3 g
HNO3 + Cu Cu(NO3)2 + NO + H2O
36. Cierta cantidad de perxido de sodio, Na2O2, se agreg a 100 mL agua y se produjeron 61.6 mL de oxgeno seco medido a CN, junto con una solucin de NaOH. Cul es la 7 concentracin de la solucin de NaOH? R/. 0.110 M 37. Una muestra de 1.25 g de Mg(OH)2 impuro requiere 29.50 mL de solucin de HCl 0.600M para su neutralizacin. Si la impureza es MgCl2, Cul es el porcentaje en peso de 7 Mg(OH)2 en la muestra contaminada? R/. 41.3 % 38. El agua de los ros generalmente es "dura" debido a la presencia de sulfato de calcio, (CaSO4) y otras sales clcicas. Para "ablandar" esta clase de aguas, el CaSO4 se puede 4 eliminar adicionando CaCO3:
CaSO4 + Na2CO3 CaCO3 + Na2SO4
Qu masa de Na2CO3 se necesitar para eliminar todo el sulfato presente en 2.0 10 3 -3 3 dm de agua que contiene 1.8 10 mol de CaSO4 /cm ? R/. 0.38 Mg 39. Se requiere preparar una solucin de NH4NO3 que contenga 50 g de esta sal por litro. Calcular los volmenes de HNO3 (d = 1.38 g/mL, 61.8% HNO3) y de NH3 (d = 0.918
40.
41.
42.
43.
44.
45.
46.
47.
g/mL, 21.5% NH3) que deben mezclarse para preparar 700 mL de la solucin de nitrato 6 amnico. R/. 37.7 mL NH3, 32.4 mL HNO3 0.4570 g de una solucin de Mg y Al se disuelven en 100 mL de HCl 1.00 M el exceso del cual requiere para su neutralizacin 57.1 mL de NaOH 1.00 M. Determinar la composicin de la aleacin. R/. 59.8% Mg, 40.2% Al 0.250 g de un cloruro metlico anhidro, MClx, necesitan de 24.00 mL de solucin de AgNO 3 0.100 M para su precipitacin. Si dicho peso es del cloruro hidratado se consumen tan solo 20.45 mL. La masa molar del metal es aproximadamente 140 g/mol. Identificar el 6 metal y hallar las frmulas de los dos cloruros. R/. Ba, BaCl2, BaCl2.2H2O Cuando se colocaron 2.50 g de una barra de zinc en 500 mL de una solucin de AgNO 3 se form plata metlica en la superficie de la barra. Despus de cierto tiempo la barra se sac de la solucin, se sec y se pes. Si la masa final de la barra, despus de secarse y 11 pesarse, fue de 3.37 g, calcular: a. La masa de Zn y la masa de Ag en la barra. R/. 1.25 g de Ag y 2.12 g de Zn b. La concentracin del Zn en la solucin. R/. 0.0116 M 2+ Una muestra de 1.00 g de un metal X (que se sabe que forma iones X ) se aadi a 100 mL de H2SO4 0.500 M. Una vez que reaccion todo el metal, el cido remanente requiri 11 33.4 mL de solucin 0.500 M de NaOH. Calcular la masa molar del metal e identificarlo. R/. 24 g/mol, Mg Una muestra de 17.4 mL de una solucin de H2SO4 al 70% en peso cuya densidad es de 1.61 g/mL ha sido diluda hasta un volumen de 100 mL y posteriormente se ha hecho reaccionar con un gran exceso de Zn. El hidrgeno desprendido ha sido combinado con Cl2 para dar HCl. Este ltimo se disuelve en la cantidad suficiente de agua para dar 200 10 mL de HCl. Calcular la concentracin de la solucin de HCl. R/. 2.00 M Una muestra de 85 g de un sulfuro de antimonio que tiene una pureza de 40% se oxida hasta que todo el S se convierte en SO3. Este ltimo se disuelve en agua para dar 200 mL de solucin de H2SO4. Qu volumen de NaOH 0.400 M se requiere para neutralizar 10 completamente la solucin de H2SO4? R/. 1.50 L A un beaker que contiene 164 mL de una solucin de CuSO 4 se le aaden 10.0 g de Mg. Cuando se ha completado la reaccin, se tiene una mezcla de Mg y Cu que pesa 14.45 g. a. Cul fu el reactivo lmite? b. Calcular la concentracin de la solucin original. R/. 0.69 M Una mezcla de Na2CO3 y NaHCO3 que pesa 14.8 g se ha disuelto en suficiente agua para obtener 400 mL de solucin. Estos se tratan con un exceso de H2SO4 2.00 M y se hierve para desprender todo el CO2 disuelto. Se recogen 3.73 L de gas seco, medidos a 740 torr y 22.0 C. Calcular la concentracin de carbonato y bicarbonato en los 400 mL de 10 solucin. R/. 0.250 M
Potrebbero piacerti anche
- 6th Central Pay Commission Salary CalculatorDocumento15 pagine6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Copia de Taller Semana 16 - MeiosisDocumento8 pagineCopia de Taller Semana 16 - MeiosisLaura Nicole QuiñonezNessuna valutazione finora
- Ejercicios de Volumetria RedoxDocumento7 pagineEjercicios de Volumetria RedoxjmattaNessuna valutazione finora
- Practica 3 QO.Documento14 paginePractica 3 QO.mikke pereaNessuna valutazione finora
- Ejercicios de Permanganometria (E)Documento2 pagineEjercicios de Permanganometria (E)Catalina Duque Henao100% (1)
- Dervidos de ÁcidosDocumento30 pagineDervidos de ÁcidosEdwar Celon100% (2)
- Reacción Balz-SchiemannDocumento13 pagineReacción Balz-SchiemannKevin Rada0% (1)
- Ejercicios DisolucionesDocumento6 pagineEjercicios DisolucionesDlcm Born To WinNessuna valutazione finora
- Maquina de AnestesiaDocumento88 pagineMaquina de AnestesiaJosepAguilar100% (1)
- Espacios Confinados ARCELORMITTALDocumento87 pagineEspacios Confinados ARCELORMITTAL03JMercado100% (1)
- Guia RedoxDocumento3 pagineGuia RedoxMatii VegaNessuna valutazione finora
- Soluciones 1-2013 1TDocumento2 pagineSoluciones 1-2013 1TLuis VacaNessuna valutazione finora
- Taller VolumetríaDocumento2 pagineTaller VolumetríaSergio GomezNessuna valutazione finora
- Practica 1 Orgánica 2Documento4 paginePractica 1 Orgánica 2Daniela PullaNessuna valutazione finora
- Balance Termico y Entropia#8Documento13 pagineBalance Termico y Entropia#8Ceballos Peña KlarenaNessuna valutazione finora
- Problem Ill As 2Documento54 pagineProblem Ill As 2Ronald Caceres CandiaNessuna valutazione finora
- Ejercicios 2Documento9 pagineEjercicios 2Anonymous 666Nessuna valutazione finora
- Clase 3-IndicadoresDocumento24 pagineClase 3-IndicadoresAntonio José González ParejaNessuna valutazione finora
- Informe #5 - Grupo 16 - Fisiología SeminarioDocumento16 pagineInforme #5 - Grupo 16 - Fisiología SeminarioLiz VeronicaNessuna valutazione finora
- Taller 4 Aplicaciones de Las Valoraciones Acido-S BaseDocumento1 paginaTaller 4 Aplicaciones de Las Valoraciones Acido-S BaseCarolina posadaNessuna valutazione finora
- CARTEL de La Práctica 4, NRC 13959Documento1 paginaCARTEL de La Práctica 4, NRC 13959Berenice Sanchez GalindoNessuna valutazione finora
- Guia 06 Estequiometria en Solucion QUI080Documento4 pagineGuia 06 Estequiometria en Solucion QUI080Alan John AndradesNessuna valutazione finora
- Informe 3 KpsDocumento5 pagineInforme 3 KpsJunior RiosNessuna valutazione finora
- Reporte de Practica 9 FQDocumento4 pagineReporte de Practica 9 FQMiguel Angel BarreraNessuna valutazione finora
- Volumetría Por Precipitación 1Documento3 pagineVolumetría Por Precipitación 1Juan Luciano100% (1)
- Práctica 5. SÍNTESIS DE LA p-NITROANILINADocumento15 paginePráctica 5. SÍNTESIS DE LA p-NITROANILINADannae PonceNessuna valutazione finora
- TITULACIONES REDOX-Analisis de Una Muestra de HidrazinaDocumento9 pagineTITULACIONES REDOX-Analisis de Una Muestra de HidrazinaMillan AntonioNessuna valutazione finora
- Clase 1 2019IIDocumento59 pagineClase 1 2019IIKatty Julieth Rangel GutierrezNessuna valutazione finora
- Soluciones BufferDocumento4 pagineSoluciones Buffershunashi lorenzanaNessuna valutazione finora
- Tarea 1 - Visible MMSDocumento6 pagineTarea 1 - Visible MMSMONTSERRAT MURILLO SERRANONessuna valutazione finora
- Laboratorio 3Documento2 pagineLaboratorio 3Nicols Bustamante MolinaNessuna valutazione finora
- Informe 1Documento3 pagineInforme 1andrewscm100% (4)
- Clase IsomeriaDocumento122 pagineClase IsomeriaLimey JuniorNessuna valutazione finora
- Valoracion de AspirinaDocumento6 pagineValoracion de AspirinaJosé MariaNessuna valutazione finora
- Practica 5 Obtencion de AnilinaDocumento2 paginePractica 5 Obtencion de AnilinaBenjamin CastilloNessuna valutazione finora
- Problemario SinRespuestaDocumento6 pagineProblemario SinRespuestaJorge FrancoNessuna valutazione finora
- Tarea Semana 3 Análisis InstrumentalDocumento6 pagineTarea Semana 3 Análisis InstrumentalJuan GilNessuna valutazione finora
- Reactivo de Lucas, Reactivo de Brady, Disolucion de Almido 0.1% y Cloruro de AcetiloDocumento9 pagineReactivo de Lucas, Reactivo de Brady, Disolucion de Almido 0.1% y Cloruro de AcetiloAlexis Macias SaavedraNessuna valutazione finora
- EstequiometríaDocumento2 pagineEstequiometríaquimica_introduccionNessuna valutazione finora
- Ejercicio 1y 2 de CurvasDocumento2 pagineEjercicio 1y 2 de CurvasNatasha VargasNessuna valutazione finora
- Practica de Laboratorio Lambert BeerDocumento5 paginePractica de Laboratorio Lambert Beerlaura QuinteroNessuna valutazione finora
- Síntesis y Caracterizacción Del Ácido AcetilsalicílicoDocumento12 pagineSíntesis y Caracterizacción Del Ácido AcetilsalicílicoMartaYanesSánchezNessuna valutazione finora
- Orga III-5Documento4 pagineOrga III-5mariferNessuna valutazione finora
- TALLER GRAVIMETRIA RVFDocumento4 pagineTALLER GRAVIMETRIA RVFDiana SotoNessuna valutazione finora
- Unidad 6. Equilibrio Acido BaseDocumento46 pagineUnidad 6. Equilibrio Acido BaseBryan Josue Amaya Mercedes100% (1)
- Sustitución Electrofilica Aromática - Síntesis Acido M - NitrobenzoicoDocumento6 pagineSustitución Electrofilica Aromática - Síntesis Acido M - NitrobenzoicoEdwin Montenegro0% (3)
- Refracción Molar de MezclasDocumento3 pagineRefracción Molar de MezclasJazmin ELNessuna valutazione finora
- Desea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasDocumento1 paginaDesea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasBrando Kevin Palomino MorenoNessuna valutazione finora
- Problemario de Análisis Farmacéutico 2016 PDFDocumento68 pagineProblemario de Análisis Farmacéutico 2016 PDFEstefany GuerreroNessuna valutazione finora
- Práctica No 2 Determinación Gravimetrica de Cloruros PorDocumento10 paginePráctica No 2 Determinación Gravimetrica de Cloruros PorNicole Osuna100% (1)
- Guías 1 y 2 de BacteriolgiaDocumento12 pagineGuías 1 y 2 de BacteriolgiaDanna Paternina MaussaNessuna valutazione finora
- Practica 4Documento7 paginePractica 4Tahyri ShicayNessuna valutazione finora
- Ejercicios ConcentracionesDocumento2 pagineEjercicios ConcentracionesJonathan VelazquezNessuna valutazione finora
- Informe 3 REACCIÓN DE HALUROS DE ALQUILODocumento7 pagineInforme 3 REACCIÓN DE HALUROS DE ALQUILOLinda Lucia Insignares OteroNessuna valutazione finora
- Taller1 - Volumetría 2020Documento3 pagineTaller1 - Volumetría 2020Valentina CalleNessuna valutazione finora
- Taller de IonizacionDocumento7 pagineTaller de IonizacionMOVANITOTINessuna valutazione finora
- Tema 5 Control de Calidad y Pureza de DrogasDocumento38 pagineTema 5 Control de Calidad y Pureza de DrogasEsteban A. SilvaNessuna valutazione finora
- Taller Disoluciones QuímicasDocumento3 pagineTaller Disoluciones QuímicasDiana Castillo0% (1)
- Ayuda SupletorioDocumento197 pagineAyuda SupletorioAnthony HurtadoNessuna valutazione finora
- Obtención de Aldehídos Y Cetona Con 1,3-DitianosDocumento12 pagineObtención de Aldehídos Y Cetona Con 1,3-DitianosKevin GonzalesNessuna valutazione finora
- Un Acuario de 60Documento4 pagineUn Acuario de 60Dlcm Born To Win100% (1)
- Ejercicios Disoluciones y Propiedades ColigativasDocumento2 pagineEjercicios Disoluciones y Propiedades ColigativasRamin Zand Isa KhaniNessuna valutazione finora
- Taller de Soluciones y Propiedades ColigativasDocumento3 pagineTaller de Soluciones y Propiedades ColigativasWilliam Javier Ospino NegreteNessuna valutazione finora
- MTC - Reactivación Económica Sector Transporte y Comunicaciones - Abril 2020 PDFDocumento23 pagineMTC - Reactivación Económica Sector Transporte y Comunicaciones - Abril 2020 PDFaleksandar_dimitrijevicNessuna valutazione finora
- 02 - Supervision y Residencia de Obras en Agua y SaneamientoDocumento5 pagine02 - Supervision y Residencia de Obras en Agua y SaneamientoAnonymous QX8RIly6fNessuna valutazione finora
- Modelos de Gps IhvcaDocumento2 pagineModelos de Gps IhvcaAnonymous QX8RIly6fNessuna valutazione finora
- Tar DomesticasDocumento5 pagineTar DomesticasAnonymous QX8RIly6fNessuna valutazione finora
- 03 - Relleno Sanit PentDocumento7 pagine03 - Relleno Sanit PentAnonymous QX8RIly6fNessuna valutazione finora
- 03 - Tar DomesticasDocumento6 pagine03 - Tar DomesticasAnonymous QX8RIly6fNessuna valutazione finora
- Primera Práctica Calificada de Investigación Aplicada VDocumento2 paginePrimera Práctica Calificada de Investigación Aplicada VAnonymous QX8RIly6fNessuna valutazione finora
- Metrado de La Captacion MisquiyacuDocumento6 pagineMetrado de La Captacion MisquiyacuAnonymous QX8RIly6fNessuna valutazione finora
- Plotter t120Documento2 paginePlotter t120rosmelNessuna valutazione finora
- Diametro Tub Ntp399.002Documento6 pagineDiametro Tub Ntp399.002Anonymous QX8RIly6fNessuna valutazione finora
- Pip Mejoramiento TahuishcoDocumento101 paginePip Mejoramiento TahuishcoAnonymous QX8RIly6fNessuna valutazione finora
- Libro Inei San MartinDocumento323 pagineLibro Inei San MartinHector Moises Chavez VargasNessuna valutazione finora
- TDR Ejecución de Obra Vertientes I Etapa - ObraDocumento38 pagineTDR Ejecución de Obra Vertientes I Etapa - ObraAnonymous QX8RIly6fNessuna valutazione finora
- Bases de Las Competencias Deportivas Internas 00500Documento4 pagineBases de Las Competencias Deportivas Internas 00500Anonymous QX8RIly6fNessuna valutazione finora
- Valorización N°01 - Instalacion de Biodigestores Camp. 13 Fray Martin OkDocumento1 paginaValorización N°01 - Instalacion de Biodigestores Camp. 13 Fray Martin OkAnonymous QX8RIly6fNessuna valutazione finora
- Invierte Pe PDFDocumento13 pagineInvierte Pe PDFEber Cconislla ChacmanaNessuna valutazione finora
- Te MarioDocumento2 pagineTe MarioSegundo SánchezNessuna valutazione finora
- Las Hadas y Los ChullachaquisDocumento3 pagineLas Hadas y Los ChullachaquisAnonymous QX8RIly6fNessuna valutazione finora
- Formulario de TrigoDocumento8 pagineFormulario de TrigoAnonymous QX8RIly6fNessuna valutazione finora
- Ficha de Análisis de SílaboDocumento3 pagineFicha de Análisis de SílaboAnonymous QX8RIly6f67% (3)
- Himno Al Distrito de SoritorDocumento1 paginaHimno Al Distrito de SoritorAnonymous QX8RIly6fNessuna valutazione finora
- Ficha de Supervisión en Aula 1Documento3 pagineFicha de Supervisión en Aula 1Anonymous QX8RIly6fNessuna valutazione finora
- SensibilidadDocumento3 pagineSensibilidadAnonymous QX8RIly6fNessuna valutazione finora
- Himno Al Distrito de SoritorDocumento1 paginaHimno Al Distrito de SoritorAnonymous QX8RIly6fNessuna valutazione finora
- Equivalencia de Diametros de TuberiasDocumento4 pagineEquivalencia de Diametros de TuberiasAnonymous QX8RIly6fNessuna valutazione finora
- Plan de Accion Paseo PrimaveralDocumento5 paginePlan de Accion Paseo PrimaveralAnonymous QX8RIly6fNessuna valutazione finora
- Trip EDIFICACIONES 2013 - Pavco PDFDocumento6 pagineTrip EDIFICACIONES 2013 - Pavco PDFGeyner ParedesNessuna valutazione finora
- Sílabo Tics IVDocumento7 pagineSílabo Tics IVAnonymous QX8RIly6fNessuna valutazione finora
- Taller Ciencias Sociales 4Documento10 pagineTaller Ciencias Sociales 4Maria Nancy Mayorga García100% (1)
- Mapeo Geomecanic0: Practicas Pre ProfesionalesDocumento47 pagineMapeo Geomecanic0: Practicas Pre ProfesionalesJeanmarco Straus Paxi floresNessuna valutazione finora
- EndulzamientoDocumento352 pagineEndulzamientoDiego QuirogaNessuna valutazione finora
- Introdución A Los Sistemas de Baja DimensionalidadDocumento7 pagineIntrodución A Los Sistemas de Baja DimensionalidadhumbertotnNessuna valutazione finora
- Dosaje de Acido Ascorbico PracticaDocumento10 pagineDosaje de Acido Ascorbico Practicajulio ContrerasNessuna valutazione finora
- Informe 9 Sistemas TernariosDocumento14 pagineInforme 9 Sistemas TernariosSteevenRafaelPinargoteNessuna valutazione finora
- Practica de Ley de CoulombDocumento7 paginePractica de Ley de CoulombDiego SantanaNessuna valutazione finora
- Calculo de La Velocidad en La Investigacion de Accidentes de TraficoDocumento111 pagineCalculo de La Velocidad en La Investigacion de Accidentes de TraficooskarmhNessuna valutazione finora
- Tarea IIAexpDocumento8 pagineTarea IIAexpPablo CzNessuna valutazione finora
- SDS US Spanish - Oatey Blue Lava Hot PVC CementDocumento13 pagineSDS US Spanish - Oatey Blue Lava Hot PVC CementRobinson HerreraNessuna valutazione finora
- Mapa Conceptual Quimica Organica 2Documento1 paginaMapa Conceptual Quimica Organica 2Vanessa Marcela Parejo Gomez100% (1)
- TALLER Tercer ParcialDocumento3 pagineTALLER Tercer ParcialSantiago RuedaNessuna valutazione finora
- Practica DifusividadDocumento12 paginePractica DifusividadLuis BayNessuna valutazione finora
- Conalep Centro Mexicano Francés: Un PocoDocumento27 pagineConalep Centro Mexicano Francés: Un PocoLuis BaltazarNessuna valutazione finora
- Sciu-179 - Ejercicio - U009 1Documento5 pagineSciu-179 - Ejercicio - U009 1Dayron Rujel reyes100% (3)
- Tratamiento Termico en Alimentos ExponerDocumento17 pagineTratamiento Termico en Alimentos ExponerHiriatam Sifuentes SanchezNessuna valutazione finora
- Chek List UpsDocumento8 pagineChek List UpsCristhian ManriqueNessuna valutazione finora
- Memoria Técnica de AguasDocumento25 pagineMemoria Técnica de AguasRicardo Posligua OrtizNessuna valutazione finora
- NeptunoDocumento5 pagineNeptunoCristina IsabelNessuna valutazione finora
- La Aromaticidad de MobiusDocumento5 pagineLa Aromaticidad de MobiusPedro MejíasNessuna valutazione finora
- Taller de MezclasDocumento5 pagineTaller de Mezclasdorismaria2419Nessuna valutazione finora
- Informe Tipos de Reacciones y EstequeometriaDocumento4 pagineInforme Tipos de Reacciones y EstequeometriaMarcos AlvarezNessuna valutazione finora
- Origen de La Corteza TerrestreDocumento13 pagineOrigen de La Corteza TerrestreBenjamin Santos SalinasNessuna valutazione finora
- Lab Fisicoquimica (Calor Latente)Documento4 pagineLab Fisicoquimica (Calor Latente)David DiazNessuna valutazione finora
- TFG Francisco Prieto de Santos (Definitivo)Documento49 pagineTFG Francisco Prieto de Santos (Definitivo)el viajantexNessuna valutazione finora
- Planta de Agua UagrmDocumento16 paginePlanta de Agua UagrmFabricio Dávalos100% (2)
- 2019 1 060555 1 06 06 Bar112Documento4 pagine2019 1 060555 1 06 06 Bar112Carlos Padua CopitanNessuna valutazione finora
- Prueba Septimo Año Básico Sustancias Puras y MezclasDocumento5 paginePrueba Septimo Año Básico Sustancias Puras y Mezclaspapelmdm44% (9)