Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Diagrama de Fases
Caricato da
Priscila SaavedraCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Diagrama de Fases
Caricato da
Priscila SaavedraCopyright:
Formati disponibili
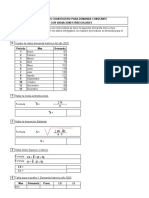
DIAGRAMA DE FASES
I. OBJETIVOS Obtener diagrama de fases para sistemas binarios y terciarias, Determinar el volumen de una sustancia, que se debe aplicar para la turbidez en una solucin binaria. II. Determinar la temperatura de turbidez en una solucin ternaria. MARCO TEORICO Diagrama de Fase: es un resumen practico de los datos obtenidos a travs del estudio de los efectos de los cambios de temperatura y presin en el estado de agregacin de una determinada sustancia. Punto triple, condiciones de temperatura y presin a las que pueden coexistir en equilibrio las tres fases de una sustancia pura: slida, lquida y gaseosa. n gr!fico de la presin frente a la temperatura que muestra los intervalos en los que pueden existir las distintas fases se denomina diagrama de fases. "n el del agua, mostrado aqu, las lneas AB y BC representan las curvas de presin de vapor del #ielo y el agua lquida respectivamente. $a lnea BD muestra el efecto que un aumento de la presin tiene sobre el punto de congelacin. $a pendiente de esa lnea indica que un aumento de la presin disminuye el punto de congelacin. "sto es lo contrario de lo que ocurre con la mayora de los dem!s lquidos, y se debe al #ec#o de que el agua %a diferencia de otros lquidos% se expande al congelarse
"n la regin ABD, el #ielo es la &nica fase estable' en DBC y ABC, las &nicas fases estables son, respectivamente, el agua y el vapor de agua. "n el punto de interseccin B, la temperatura es de (,() *+, y tanto el #ielo como el agua tienen la misma presin de vapor: ,)(,- pascales. B es el punto triple del agua. . diferencia del punto de congelacin y del punto de ebullicin, que dependen de la presin, el punto triple es una propiedad fi/a. 0e utiliza para definir el 1elvin, la unidad de temperatura termodin!mica. 2or definicin, #ay exactamente 345,), 6 entre el punto triple del agua y el cero absoluto.$a temperatura del punto triple para cualquier sustancia pura es muy prxima a la de fusin, puesto que la variacin de esta <ima con la presin es muy peque7a. Regla de las fases, en qumica fsica, expresin matem!tica que describe el comportamiento de los sistemas qumicos en equilibrio, formulada por el fsico estadounidense 8. 9illard :ibbs dentro de sus investigaciones sobre termodin!mica. n sistema qumico consiste en cualquier na disolucin de sal en agua, por combinacin de componentes qumicos ba/o observacin.
e/emplo, es un sistema qumico en el que los componentes son la sal y el agua. $os componentes qumicos de un sistema pueden presentarse en sus fases slida, lquida o gaseosa. $a regla de las fases es aplicable &nicamente a los sistemas denominados #eterogneos, en los que dos o m!s fases fsicamente diferentes se encuentran en equilibrio. n sistema no puede contener m!s de una fase na aleacin de cobre y nquel, por gaseosa, pero s puede tener varias fases lquidas y slidas.
e/emplo, contiene dos fases slidas' una mezcla de tetracloruro de carbono y agua tiene dos fases lquidas' una disolucin de agua con sal, tres fases ;la sal es la fase slida, el agua es la fase lquida y el vapor de agua la fase gaseosa<. "l agua es un e/emplo de sistema qumico #eterogneo de un solo componente. $as fases lquida y gaseosa ;agua y vapor de agua< se dan con/untamente en un amplio margen de temperatura y presin. =a/o una temperatura y presin determinadas, que se conoce como el punto triple, se dan en equilibrio las tres fases: vapor de agua ;gas<, agua ;lquido< y #ielo ;slido<. $a regla de las fases est! representada por la ecuacin F > C ? P @ 3, donde F es el n&mero de variables ;normalmente temperatura, presin y concentracin< que pueden cambiar sin que ello provoque la desaparicin de una fase o la aparicin de otra nueva' C representa el n&mero de componentes qumicos del sistema, y P el n&mero de fases presentes. $a regla de las fases posibilita la correlacin de gran cantidad de datos fsicos y, con algunos lmites, permite la prediccin del comportamiento de los sistemas qumicos. "sta regla se aplica en la resolucin de numerosos
problemas pr!cticos, especialmente en la preparacin de aleaciones met!licas, en ingeniera qumica y en geologa. I. DESARROLLO
Equipo: Sistema Binario: T A ua
Feno! A ua
"orni!!a
Sistema Ternario:
A#. A#$ti#o C!oro%ormo A ua
III.&
MATERIALES 'om(re 0oporte Aornilla Baso de 2recipitacin Cermmetro Cubos de "nsayo Frasco de Bidrio 2ipeta =ureta 'o ) ) ) ) E ) 3 ) Capa#i)a) 3-( ml 3(( D + - ml - ml ) ml 3- ml
III.*
REACTIVOS 'om(re +loroformo Gcido .ctico Fenol .gua Destilada ;liquida< Canti)a) Con#entra#i+n 2uro
III.,
-ROCEDIMIE'TO "n un tubo de ensayo introducir una cantidad determinada de fenol y otra de agua destilada. +alentar el tubo de ensayo en ba7o mara y tomar la temperatura a la cual la mezcla se clarifica, esta temperatura corresponde a la temperatura de clarificacin. 0acar el tubo de ensayo del ba7o mara y de/arlo enfriar lentamente. Comar la temperatura a la cual el liquido se enturbia, esta temperatura corresponde a la temperatura de turbidez. 0eguir el mismo procedimiento con tubos de ensayo que contienen diferentes vol&menes de agua y fenol. Healizar un grafico de la temperatura de turbidez en funcin de la composicin de fenol y agua que tiene cada tubo de ensayo.
Sistema Binario : Fenol y Agua -
Sistema Ternario : Cloroformo, cido actico y Agua "n oc#o tubos de ensayo introducir cantidades de cloroformo y !cido actico en proporciones que van desde (,3 ml #asta ) ml, y desde )ml #asta (,3 ml respectivamente. . cada uno de los tubos de ensayo, agregar a travs de una bureta, agua destilada gota a gota, #asta que se presente turbidez en la mezcla.
.notar el volumen de agua agregada a cada tubo de ensayo. Healizar un diagrama ternario considerando la composicin porcentual en peso de los tres componentes en cada tubo de ensayo.
III.
DATOS . RES/LTADOS
0 Tu(o ) 3 5 I , 4 J E VFeno! 1m!2 V"*O 1m!2 (,3 (,3 (,3 (,3 (,3 (,3 (,3 (,3 (,3 (,3 (,I (,, (,J ),( ),3 ),I ),, ),J TC!ari%i#a#i+n13C2 4( ,E 45 4I 4( -E ,5 ,J -5 TTur(i)e413C2 ,,,, ,4 ,5 I4 I, -E 5-
Sistema Binario : Fenol y Agua :
5 Feno! 6 mFeno! 7 mTota! 8 &99
Tu o !" B Fenol > (,3 ml B .gua > (,3 ml m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > (,)EE,I- gr mCotal > (,5E-I3- gr M Fenol > (,)E-4J( L(,5E-I3- K )(( # Fenol $ %&,'! m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > (,5EE3EI gr mCotal > (,-E-(4I gr M Fenol > (,)E-4J( L(,-E-(4I K )(( # Fenol $ )(,&*
Tu o (" B Fenol > (,3 ml B .gua > (,I ml
Tu o )" B Fenol > (,3 ml B .gua > (,, ml
m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml
mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > (,-EJEI( gr mCotal > (,4EI43( gr
M Fenol > (,)E-4J( L(,4EI43( K )(( # Fenol $ (%,+% m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > (,4EJ-J4 gr mCotal > (,EEI5,4 gr M Fenol > (,)E-4J( L(,EEI5,4 K )(( # Fenol $ !&,+& m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > (,EEJ35I gr mCotal > ),)EI()I gr M Fenol > (,)E-4J( L),)EI()I K )(( # Fenol $ !+,%*
Tu o %" B Fenol > (,3 ml B .gua > (,J ml
Tu o '" B Fenol > (,3 ml B .gua > ),( ml
Tu o +" B Fenol > (,3 ml B .gua > ),3 ml
m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml
mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > ),)E4JJ) gr mCotal > ),5E5,,) gr
M Fenol > (,)E-4J( L),5E5,,) K )((
# Fenol $ !%,*' m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > ),5E4-3J gr mCotal > ),-E55(J gr M Fenol > (,)E-4J( L),-E55(J K )(( # Fenol $ !(,(& m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > ),-E4)4I gr mCotal > ),4E3E-I gr M Fenol > (,)E-4J( L),4E3E-I K )(( # Fenol $ !*,&( m.gua > B .gua K .gua ' Fenol > (,E4JE( grLml ' .gua > (,EEJ35I grLml mFenol > B Fenol K Fenol mFenol > (,)E-4J( gr m.gua > ),4E,J3) gr mCotal > ),EE3,() gr M Fenol > (,)E-4J( L),EE3,() K )(( # Fenol $ &,-( 0 Tu(o ) 3 5 I , TTur(i)e413C2 ,,,, ,4 ,5 I4 :Feno! 152 IE,-) 53,E( 3I,,I )E,,E ),,I( )I,(:A ua 152 -(,IE ,4,)( 4-,5, J(,5) J5,,( J-,E-
Tu o ," B Fenol > (,3 ml B .gua > ),I ml
Tu o -" B Fenol > (,3 ml B .gua > ),, ml
Tu o &" B Fenol > (,3 ml B .gua > ),J ml
4 J E
I, -E 5-
)3,3E )(,E3 E,J3
J4,4) JE,(J E(,)J
Sistema Ternario : Cloroformo, cido actico y Agua :raficar la temperatura de turbidez: CA3O > )J D+
A3O >(,EEJ,3- grLml
'.c..cetico > ),(3 grLml'Fenol > (,E4JE grLml VC!oro%ormo 1m!2 (,3 (,I (,(,, (,4 (,J (,E ),( VA# A#eti#o 1m!2 ),( (,J (,4 (,, (,(,I (,5 (,3 VA ua 1m!2 ),),( (,J (,4 (,J (,, (,(,3
+loroformo > ),I5 grLml
0 Tu(o ) 3 5 I , 4 J
5 C!oro%ormo 6 CC!oro%ormo 7 mTota! 8 &99 5 A#. A#$ti#o 6 mA#.A#eti#o 7 mTota! 8 &99
Tu o !" m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo
m+loroformo > B+loroformo K +loroformo
B+loroformo > (,3 ml B.c..cetico > ),( ml B.gua > ),- ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > (,3J, gr m.c..cetico > ),(3 gr m.gua > ),IE4E5J gr mCotal > 3,J(5E5J gr
M +loroformo > (,3J, L 3,J(5E5J K )((
# Cloroformo $ !*,(* M .c. .ctico > ),(3 L 3,J(5EIJ K )(( # Ac. Actico $ )+,)m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo
Tu o ("
m+loroformo > B+loroformo K +loroformo
B+loroformo > (,I ml B.c..cetico > (,J ml B.gua > ),( ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > (,-43 gr m.c..cetico > (,J), gr m.gua > (,EEJ,3- gr mCotal > 3,5J,,3- gr
M +loroformo > (,-43 L 3,5J,,3- K )(( # Cloroformo $ (),&, M .c. .ctico > (,J), L 3,5J,,3- K )(( # Ac. Actico $ )%,!& m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo
Tu o )"
m+loroformo > B+loroformo K +loroformo
B+loroformo > (,- ml B.c..cetico > (,4 ml B.gua > (,J ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > (,4)- gr m.c..cetico > (,4)I gr m.gua > (,4EJE( gr mCotal > 3,334E( gr
M +loroformo > (,4)- L 3,334E( K )(( # Cloroformo $ )(,*& M .c. .ctico > (,4)I L 3,334E( K )((
# Ac. Actico $ )(,*' m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo
Tu o %"
m+loroformo > B+loroformo K +loroformo
B+loroformo > (,, ml B.c..cetico > (,, ml B.gua > (,4 ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > (,J-J gr m.c..cetico > (,,)3 gr m.gua > (,,EE(5J gr mCotal > 3,),E(5J gr
M +loroformo > (,J-J L 3,),E(5J K )(( # Cloroformo $ )&,'+ M .c. .ctico > (,,)3 L 3,),E(5J K )(( # Ac. Actico $ (-,(( m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo m+loroformo > ),(() gr m.c..cetico > (,-) gr m.gua > (,4EJE( gr mCotal > 3,5(EE( gr M +loroformo > ),(() L 3,5(EE( K )(( # Cloroformo $ %),)% M .c. .ctico > (,-) L 3,5(EE( K )(( # Ac. Actico $ ((,*m .gua > B .gua K .gua
Tu o '"
m+loroformo > B+loroformo K +loroformo B+loroformo > (,4 ml B.c..cetico > (,- ml B.gua > (,J ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
Tu o +"
m+loroformo > B+loroformo K +loroformo
m.c..cetico > B.c..cetico K +loroformo
B+loroformo > (,J ml B.c..cetico > (,I ml B.gua > (,, ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > ),)II gr m.c..cetico > (,I(J gr m.gua > (,-EE)4- gr mCotal > 3,)-))4- gr
M +loroformo > ),)II L 3,)-))4- K )(( # Cloroformo $ '!,,& M .c. .ctico > (,I(J L 3,)-))4- K )(( # Ac. Actico $ !-,&, m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo m+loroformo > ),3J4 gr m.c..cetico > (,5(, gr m.gua > (,IEE5)3 gr mCotal > 3,(E35)3 gr M +loroformo > ),3J4 L 3,(E35)3 K )(( # Cloroformo $ +!,'! M .c. .ctico > (,5(, L 3,(E35)3 K )(( # Ac. Actico $ !%,+( Tu o -" m .gua > B .gua K .gua m.c..cetico > B.c..cetico K +loroformo
Tu o ,"
m+loroformo > B+loroformo K +loroformo B+loroformo > (,E ml B.c..cetico > (,5 ml B.gua > (,- ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml ' .gua > (,EEJ,3- grLml
m+loroformo > B+loroformo K +loroformo
B+loroformo > ),( ml B.c..cetico > (,3 ml
' +loroformo > ),I5 grLml ' .c..cetico > ),(3 grLml
m+loroformo > ),I5 gr m.c..cetico > (,3(I gr
B.gua > (,3 ml
' .gua > (,EEJ,3- grLml
m.gua > (,)EE43- gr mCotal > ),J5543- gr
M +loroformo > ),I5 L ),J5543- K )(( # Cloroformo $ ,,,&M .c. .ctico > (,3(I L ),J5543- K )(( # Ac. Actico $ !!,!( 0 Tu(o ) 3 5 I , 4 J II. :C!oro%ormo 152 )(,3( 35,E4 53,(E 5E,-, I5,5I -),4E ,),-) 44,EJ :A#.A#eti#o 152 5,,5J 5I,)E 53,(3J,33 33,(J )J,E4 )I,,3 )),)3 :A ua 152 -5,I3 I),JI 5-,J, 53,33 5I,-J 3E,3I 55,J4 )(,E
OBSERVACIO'ES . CO'CL/SIO'ES "star atento al momento en que la solucin se vuelve turbia, para poder tener me/ores resultados. Observar la temperatura en el termmetro en intervalos de tiempo fi/os, para evitar errores. No descuidar el termmetro, ya que cualquier variacin importante es un error mec!nico y no sistem!tico. BIBLIOGRAFIA David Shoemaker (1968), Experimentos de Fisi o!"#mi a Editoria$ C%&%A%'%, ()xi o, Pa*s+ (an"e$ ,r!"i-a (1969), Experimentos de Fisi o!"#mi a Editoria$ .im"sa, ()xi o% Pa*s+ /0 1 02
III.
IV.
C/ESTIO'ARIO Me4#!as )e L;qui)os Inmis#i(!es < Mis#i(!es: +uando se tiene un sistema de dos lquidos
inmisci les entre si cada uno act&a como si el otro no estuviera presente. $a presin arriba de este sistema ser! igual a la suma de las presiones de cada uno de estos lquidos puros a la temperatura en cuestin. +uando el sistema #ierve, la presin total ser! igual a la presin baromtrica que es a su vez igual a la suma de las presiones de cada uno de los lquidos puros a la temperatura de ebullicin. $a temperatura a la que los dos lquidos #ierven ser! por lo tanto menor que la temperatura de ebullicin de cada uno de los lquidos independientes. n liquido puede ayudar al otro a destilarse ;0e suman sus presiones para igualar a la presin baromtrica<. +uando se tienen mezclas de lquidos misci les entre si, desaparece todo vestigio de las propiedades que tiene cada uno de ellos por separado, es decir cambia su punto de ebullicin, su punto de fusin, y las dem!s propiedades, pero si se aseme/an muc#o a ambas. So!u(i!i)a):,de una sustancia en un disolvente, es la cantidad de esa sustancia contenida en cien gramos de disolvente, a una temperatura y presin dadas. na disolucin est! saturada a una determinada presin y temperatura cuando contiene disuelta la m!xima cantidad de soluto posible a esa temperatura. $a concentracin de soluto correspondiente a su disolucin saturada expresa el grado de solubilidad de la sustancia en un disolvente determinado y a una temperatura dada. "n general, la solubilidad de las sustancias slidas en agua aumenta con la temperatura. $os gases se disuelven en los lquidos en una proporcin que depende de la naturaleza de ambos. $as disoluciones de gases obedecen la ley de Aenry, seg&n la cual, a una temperatura dada, la masa de gas disuelto en una cantidad determinada de lquido es proporcional a la presin que el gas e/erce sobre la superficie del mismo. 0alvo excepciones, la solubilidad de los gases en agua disminuye al aumentar la temperatura. Di!u#i+n: .7adir disolvente en una solucin ya establecida, con el fin de disminuir la concentracin de la solucin. Dia rama )e Fases: es un resumen practico de los datos obtenidos a travs del estudio de los efectos de los cambios de temperatura y presin en el estado de agregacin de una determinada sustancia. Re !a )e Fases )e Gi((s 1Fases= #omponentes < ra)os )e !i(erta)2: $a regla de las fases est! representada por la ecuacin F > C ? P @ 3, donde F es el n&mero de variables ;normalmente
temperatura, presin y concentracin< que pueden cambiar sin que ello provoque la desaparicin de una fase o la aparicin de otra nueva' C representa el n&mero de componentes qumicos del sistema, y P el n&mero de fases presentes. $a regla de las fases posibilita la correlacin de gran cantidad de datos fsicos y, con algunos lmites, permite la prediccin del comportamiento de los sistemas qumicos. "sta regla se aplica en la resolucin de numerosos problemas pr!cticos, especialmente en la preparacin de aleaciones met!licas, en ingeniera qumica y en geologa. Sistema Binario: "s aquel que tiene dos componentes, donde el e/e de las ordenadas indica la temperatura y el e/e de las abscisas el porcenta/e de las sustancias que conforman el sistema. Sistema Ternario: "s el sistema conformado por tres sustancias, su grafica se la realiza en un triangulo, tomando solo en cuenta el porcenta/e de las sustancias en el sistema.
Potrebbero piacerti anche
- Ejercicios 1Documento2 pagineEjercicios 1Henry RamosNessuna valutazione finora
- Bomba de CalorDocumento8 pagineBomba de CalorHenry RamosNessuna valutazione finora
- Norma CopoazuqDocumento8 pagineNorma CopoazuqHenry RamosNessuna valutazione finora
- Estructura Base Modelo de PronósticoDocumento2 pagineEstructura Base Modelo de PronósticoHenry RamosNessuna valutazione finora
- CamaraDocumento12 pagineCamaraHenry RamosNessuna valutazione finora
- Tema 4 - Agua SubterráneaDocumento29 pagineTema 4 - Agua SubterráneaALEJANDRA GIMENA GARVIZU AGUILARNessuna valutazione finora
- Examen de MatemáticasDocumento1 paginaExamen de MatemáticasHenry RamosNessuna valutazione finora
- Enzimas IIDocumento3 pagineEnzimas IIHenry RamosNessuna valutazione finora
- Cuestionario Autoev. Unidad Vii y AnexosDocumento4 pagineCuestionario Autoev. Unidad Vii y AnexosHenry RamosNessuna valutazione finora
- Tema 4 Evaluacion Calidad Del AguaDocumento29 pagineTema 4 Evaluacion Calidad Del AguaHenry RamosNessuna valutazione finora
- Ficha Geren CIA 12Documento1 paginaFicha Geren CIA 12Henry RamosNessuna valutazione finora
- Recuperar refrigerantes conozca componentes procesosDocumento10 pagineRecuperar refrigerantes conozca componentes procesosHenry RamosNessuna valutazione finora
- FichagerenciaDocumento1 paginaFichagerenciaHenry RamosNessuna valutazione finora
- Diagrama para La Elaboración de Dulce de LecheDocumento1 paginaDiagrama para La Elaboración de Dulce de LecheHenry RamosNessuna valutazione finora
- Tema 4 - Aguas Dulces SuperficialesDocumento25 pagineTema 4 - Aguas Dulces SuperficialesHenry RamosNessuna valutazione finora
- Guía básica para clasificar y reciclar residuos sólidosDocumento30 pagineGuía básica para clasificar y reciclar residuos sólidosHenry RamosNessuna valutazione finora
- Ficha Tecnica II.2021Documento1 paginaFicha Tecnica II.2021Henry RamosNessuna valutazione finora
- AmoniacoDocumento14 pagineAmoniacoHenry RamosNessuna valutazione finora
- HACCP Modelo Clase 25-11-21Documento3 pagineHACCP Modelo Clase 25-11-21Henry Ramos100% (1)
- DCA temperatura reventado arvejaDocumento5 pagineDCA temperatura reventado arvejaHenry RamosNessuna valutazione finora
- Tarea 4 (2P)Documento1 paginaTarea 4 (2P)Henry RamosNessuna valutazione finora
- AbsorxionDocumento11 pagineAbsorxionHenry RamosNessuna valutazione finora
- Tarea 6 (2P)Documento1 paginaTarea 6 (2P)Henry RamosNessuna valutazione finora
- Documento de AlipsmeDocumento12 pagineDocumento de AlipsmeHenry RamosNessuna valutazione finora
- Conclusion EsDocumento1 paginaConclusion EsHenry RamosNessuna valutazione finora
- Exposicion UhpDocumento2 pagineExposicion UhpHenry RamosNessuna valutazione finora
- Practica 4Documento3 paginePractica 4Henry RamosNessuna valutazione finora
- Articulo 1Documento5 pagineArticulo 1Henry RamosNessuna valutazione finora
- Matriz Agua - Ciclo HidrológicoDocumento25 pagineMatriz Agua - Ciclo HidrológicoHenry RamosNessuna valutazione finora
- Articulo 2Documento12 pagineArticulo 2Henry RamosNessuna valutazione finora