Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
La Combustin Trabajo1
Caricato da
techeroCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
La Combustin Trabajo1
Caricato da
techeroCopyright:
Formati disponibili
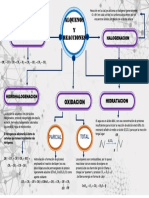
La combustin: Es el conjunto de procesos fsico-qumicos por los cuales se libera controladamente parte de la energa interna del combustible.
Una parte de esa energa se va a manifestar en forma de calor y es la que a nosotros nos interesa. La reaccin de un elemento qumico con el oxgeno sabemos que se llama oxidacin. La combustin no es ms que una reaccin de oxidacin, en la que normalmente se va a liberar una gran cantidad de calor. Los combustibles tienen en su composicin unos elementos principales, combustibles (C, H, S) y otros no combustibles, como el V, Ni, Na, Si, El comburente ms habitual usado en la combustin es el aire (21% O, 73% N 2 (inerte)). Se llama calor de combustin a la disminucin de entalpa de un cuerpo en C/N de presin y a una temperatura definida. Ser entonces el calor que se libera cuando el combustible arde en una llama o cuando los componentes principales reaccionan con el oxgeno. En la combustin, cada uno de los componentes combustibles del combustible va a sufrir la reaccin de oxidacin correspondiente. Reaccin de combustin: Se trata de una reaccin de oxidacin con la particularidad de que se realiza muy rpidamente, es exotrmica. Esta reaccin se produce entre los elementos combustibles de un combustible y el oxgeno del comburente. Para que un combustible sufra la combustin, es necesario que alcance su temperatura de ignicin. Se define el punto de ignicin de un combustible como la temperatura a la cual, una vez iniciada la llama, esta ya no se extingue. Es esta temperatura de 20 a 60C ms alta que la temperatura de inflamacin. En una reaccin de oxidacin tendremos Primer Miembro Segundo Miembro Combustible + comburente Gases de combustin + calor Combustible: Toda sustancia capaz de arder Comburente: Sustancia que aporta el oxgeno para que el combustible sufra oxidacin Los combustibles industriales suelen estar constituidos por mezclas de pocos elementos, ya que esto simplifica en gran medida el proceso. Los componentes de un combustible se pueden clasificar en: Combustibles. Inertes. Estos hay que eliminarlos y por lo tanto resultan perjudiciales
Fases de la reaccin de combustin: Se pueden distinguir tres fases en la reaccin de combustin: Fase de pre reaccin (formacin de radicales). Los compuestos hidrocarbonados se descomponen dando lugar a la formacin de radicales, que son unos compuestos intermedios inestables y muy activos, para que de este modo el carbono y el hidrgeno puedan reaccionar con el oxgeno. Fase de Oxidacin: En esta fase se produce la combinacin entre los elementos y el oxgeno. Es una fase muy exotrmica y es cuando tiene lugar la propagacin de la llama. Fase de Terminacin: Aqu es cuando se forman los compuestos estables. El conjunto de estos compuestos es lo que llamamos gases de combustin. Es necesario que se produzca una gran coordinacin entre la 1 y la 2 fase, ya que si no podra llegar a producirse una explosin, por acumulacin de radicales. La explosin es la onda que se produce y transmite por la masa reaccionante a una velocidad de 1500-2500 m/s, pudiendo producirse ms de una detonacin di despus de la primera queda producto que an pueda reaccionar violentamente. 4.- CLASES DE REACCIONES DE COMBUSTIN: Las reacciones se pueden clasificar segn el modo en el cual transcurran de la siguiente manera: Combustin NEUTRA o estequiomtrica Combustin INCOMPLETA o imperfecta Combustin COMPLETA Combustin neutra: Es aqulla que se produce cuando el aire empleado aporat la cantidad justa de oxgeno para que todos los reactivos de transformen en productos. Para que la estequiometra se cumpla, hay que considerar TODOS los elementos que sufren la reaccin de combustin en el combustible. Cuando la reaccin tenga lugar totalmente, entonces no habr H, O, S y C, que se transformarn en productos correspondientes que irn en los gases de combustin. Como inertes aparecer, por lo menos, el nitrgeno. A veces, a los gases de combustin se les llama poder comburvoro o poder fumgeno. Se define ste como los gases hmedos totales procedentes de una combustin neutra o estequiomtrica (de todos los elementos combustibles e inertes tambin)
Combustin incompleta: Es aqulla en la que por defecto en el suministro de aire no hay oxgeno necesario para que se produzca la oxidacin total del carbono. Esto quiere decir que no todo el carbono se va a transformar en CO2 y aparecer como producto de combustin de CO. Aparecen entonces los inquemados. Los inquemados tambin se pueden producir por defecto en el aparato quemador. Los inquemados se definen como la materia combustible que ha quedado sin quemar o parcialmente quemada. Pueden ser de dos clases: Slidos: Carbono (holln). Provocan un ennegrecimiento de los humos de combustin Gaseosos: CO, H2 Cuando aparecen inquemados es seal de que no se ha aprovechado bien el combustible, por lo que la combustin que se est realizando es mala y se deberan tomar medidas de algn tipo para mejorarla. Combustin completa; Para que se produzca una combustin completa se hace necesario aportar un exceso de aire, es decir, de oxgeno. El exceso se realiza sobre la cantidad este quilomtricamente necesaria para que todos los productos combustibles sufran la oxidacin (tanto el C como el O el H). En este caso no se van a producir inquemados. En la prctica se hace difcil conseguir la combustin completa. Por ello es necesario aportar un exceso de aire. El exceso de aire se define como la cantidad de aire por encima del terico que hay que aportar para que se realice la combustin completa del combustible Productos resultantes de la reaccin de combustin: En general, los productos de combustin se llaman humos. Se definen stos como la masa de compuestos que resultan de un proceso de combustin. Mayoritariamente estn formados por xidos de los elementos combustibles de un combustible, adems de por los elementos del combustible que no sufren reaccin, donde hay que incluir el N2 del aire que no va a reaccionar con el oxgeno. Otros elementos que pueden aparecer en los humos pueden ser pequeas proporciones de elementos en suspensin, como carbn u holln (que se define como una sustancia alquitranosa de coquizacin). Los humos pueden clasificarse en secos (sin agua) o hmedos (con agua).
Oxidacin: Originalmente, el trmino oxidacin se asign a la combinacin del oxgeno con otros elementos. Existan muchos ejemplos conocidos de esto. El hierro se enmohece y el carbn arde. En el enmohecimiento, el oxgeno se combina lentamente con el hierro formando xido ferroso (Fe2 O3); en la combustin, se combina rpidamente con el carbn para formar CO2. La observacin de estas reacciones origin los trminos oxidacin lenta y "rpida. Sin embargo, los qumicos observaron que otros elementos no metlicos se combinaban con las sustancias de la misma manera que lo hacia el oxgeno con dichas sustancias. El oxgeno, el antimonio y el sodio arden en atmsfera de cloro y el hierro en presencia de flor. Como estas reacciones eran semejantes, los qumicos dieron una definicin de oxidacin ms general. Los reactantes O2 o Cl2, eliminaban electrones de cada elemento. Por tanto, la oxidacin se defini como el proceso mediante el cual hay prdida aparente de electrones de un tomo o in. Reduccin: Originalmente una reaccin de reduccin se limitaba al tipo de reaccin en la cual los xidos se reducan" (se desprendan) de sus xidos. El xido de hierro se "reduca a hierro con monxido de carbono. El xido de cobre (II) poda reducirse a cobre con hidrgeno. En estas reaccion es se eliminaba oxgeno y se obtena el elemento libre. El elemento libre puede obtenerse de otras maneras. La inmersin de un clavo de hierro en una solucin de sulfato de cobre (II) causa una reaccin en la cual se produce cobre libre. La semejanza entre las reacciones de oxidacin-reduccin condujo a los qumicos a formular una definicin ms general de reduccin: La reduccin es un proceso mediante el cual los tomos o iones adquieren electrones.
REACCIONES EXOTRMICAS: El prefijo exo significa hacia fuera. Por lo tanto entendemos que las reacciones exotrmicas son aquellas que liberan energa en forma de calor. El esquema general de una reaccin exotrmica puede ser escrito de la manera siguiente, donde A, B, C y D representan sustancias genricas.
A partir de la Ley de la Conservacin de Energa, podemos afirmar que La energa total de los reactivos es igual a la energa total de los productos. En otras palabras, toda la energa que entr en el primer miembro de la ecuacin qumica, debe salir ntegramente en el segundo miembro de la ecuacin. De donde obtenemos la siguiente conclusin: si una reaccin es exotrmica, entonces la entalpa de los reactivos (Hr ) es mayor que la entalpa de los productos(Hp ), pues una parte de la energa que estaba contenida en los reactivos fue liberada para el medio ambiente en forma de calor y apenas otra parte de esa energa qued contenida en los productos. Entonces en una reaccin exotrmica: Hr > Hp No es posible determinar directamente la entalpa de cada sustancia participante de una reaccin, pero podemos determinar experimentalmente la variacin de entalpa H, que ocurre cuando una reaccin qumica es realizada.
Como en la reaccin exotrmica Hr > Hp , entonces en este tipo de reaccin el valor de H ser siempre negativo. Siendo que la reaccin exotrmica: H > 0. Observa que no existe energa negativa; un sistema contiene energa. El signo negativo de DH quiere decir apenas que la energa fue liberada.
REACCIONES ENDOTRMICAS: El prefijo endo significa hacia adentro. Por lo tanto se entiende que las reacciones endotrmicas son aquellas que absorben energa en forma de calor. El esquema general de una reaccin endotrmica puede ser escrito de la siguiente manera, donde A, B, C y D representan sustancias genricas.
Una vez que la energa total se conserva del primer para el segundo miembro de cualquier reaccin qumica, podemos afirmar que: si una reaccin es endotrmica,
la entalpa de los productos Hp es mayor que la entalpa de los reactivos Hr , pues una determinada cantidad de energa fue absorbida por los reactivos en forma de calor, durante la reaccin, quedando contenida en los productos. Siendo que en la reaccin endotrmica: Hp> Hr. Y siendo DH = Hp Hr , entonces en la reaccin endotrmica el valor de H ser siempre positivo. Siendo que en la reaccin endotrmica: H > 0.
Comburente El comburente es el encargado de oxidar el combustible favoreciendo la combustin. El comburente ms habitual en la tierra es el oxgeno, que se encuentra en la atmsfera en una proporcin de un 21%. Esta proporcin es ms que suficiente para que se produzca la combustin de los combustibles. Dependiendo de otros factores con concentraciones de entre un 10-15% de oxgeno puede producirse la combustin. En ocasiones deseamos producir una combustin en lugares en los que el oxgeno escasea como puede ser el espacio, en el que el oxgeno es totalmente inexistente. Las combustiones que necesitamos realizar en el espacio son las de los cohetes que maniobran los satlites o los transbordadores espaciales. Para este tipo de combustiones los cohetes van equipados con oxgeno en estado lquido.
Potrebbero piacerti anche
- Resumen Partículas Magnéticas MTDocumento9 pagineResumen Partículas Magnéticas MTJorgeEscajadilloNessuna valutazione finora
- Man Ó MetrosDocumento14 pagineMan Ó MetrostecheroNessuna valutazione finora
- Informe Inspeccion VisualDocumento7 pagineInforme Inspeccion VisualtecheroNessuna valutazione finora
- Capitulo AnexosDocumento59 pagineCapitulo AnexosRoberto Garcia FelceNessuna valutazione finora
- Turbina KaplanDocumento10 pagineTurbina KaplantecheroNessuna valutazione finora
- Presentación INSTELECDocumento14 paginePresentación INSTELECtecheroNessuna valutazione finora
- Presentación 1Documento14 paginePresentación 1techeroNessuna valutazione finora
- AluminioDocumento6 pagineAluminiotecheroNessuna valutazione finora
- Fluidos de CorteDocumento27 pagineFluidos de Cortetechero100% (1)
- Expo Qui MicaDocumento15 pagineExpo Qui MicatecheroNessuna valutazione finora
- Ecuación de EstadoDocumento12 pagineEcuación de EstadotecheroNessuna valutazione finora
- Trabajo de MecanicaDocumento15 pagineTrabajo de MecanicatecheroNessuna valutazione finora
- Bolas de Acero - CatalogoDocumento16 pagineBolas de Acero - CatalogoLeAa CristiaNoNessuna valutazione finora
- Marco TeoricoDocumento62 pagineMarco TeoricotatianaNessuna valutazione finora
- Materiales para Herramientas de CorteDocumento3 pagineMateriales para Herramientas de CorteSantiago Marin BecerraNessuna valutazione finora
- Ejercicios de QuimicaDocumento11 pagineEjercicios de QuimicaFrankNessuna valutazione finora
- Tipos de Valvulas IndustrialesDocumento38 pagineTipos de Valvulas IndustrialesAlexAlmeidaNessuna valutazione finora
- Lab #12 de QMC 1206Documento4 pagineLab #12 de QMC 1206Sady MarazNessuna valutazione finora
- Elmar 10K Curso Espanol 02 FEB 2011Documento29 pagineElmar 10K Curso Espanol 02 FEB 2011soy la cerda83% (6)
- Air Wick Scented Oil Island Paradise SP GHS - No CMRDocumento13 pagineAir Wick Scented Oil Island Paradise SP GHS - No CMRJonathan Javier GómezNessuna valutazione finora
- Mapa AlquenosDocumento1 paginaMapa AlquenosYaz MooreNessuna valutazione finora
- PropuestaDocumento17 paginePropuestaLeidy KatherineNessuna valutazione finora
- Segundo ParcialDocumento2 pagineSegundo ParcialPaula Bonza PérezNessuna valutazione finora
- Práctica 2Documento3 paginePráctica 2EmilyNessuna valutazione finora
- Actividad 2 Video Celda Galvánica o VoltaicaDocumento2 pagineActividad 2 Video Celda Galvánica o VoltaicaMARCOS ALEJANDRO RODRIGUEZ RODRIGUEZNessuna valutazione finora
- Análisis de La Cinética Química en Experiencia de Reloj de YodoDocumento12 pagineAnálisis de La Cinética Química en Experiencia de Reloj de YodoBest gamer lasNessuna valutazione finora
- Fundición en Molde PermanenteDocumento14 pagineFundición en Molde PermanenteKaren VegaNessuna valutazione finora
- Definicion Del Enlace Quimico para Tercero de SecundariaDocumento7 pagineDefinicion Del Enlace Quimico para Tercero de SecundariaMelissaAyalaAllpajaNessuna valutazione finora
- BROCHURE TUNGSTEN - 30cmX 22 FinalDocumento5 pagineBROCHURE TUNGSTEN - 30cmX 22 FinalNestor TorresNessuna valutazione finora
- Comportamiento Del Gas Natural y Comportamiento de FasesDocumento21 pagineComportamiento Del Gas Natural y Comportamiento de FasesSambya Naysa Cardenas CandiottiNessuna valutazione finora
- Guia de ElectroquimicaDocumento2 pagineGuia de ElectroquimicaSALVADORNessuna valutazione finora
- Cuestionario de Procesos de UniónDocumento23 pagineCuestionario de Procesos de UniónMike WeasleyNessuna valutazione finora
- Aarr Hospitalarias - Grupo 1Documento11 pagineAarr Hospitalarias - Grupo 1Dp BlancaNessuna valutazione finora
- Espectroscopia Ultravioleta-Visible.-1Documento28 pagineEspectroscopia Ultravioleta-Visible.-1Rocio Delgado100% (1)
- Diseño de Tuberias ECUACIONESDocumento11 pagineDiseño de Tuberias ECUACIONESJhonson Lopez Lara100% (1)
- Producto Academico #02Documento11 pagineProducto Academico #02UnPoCoDeToDo100% (2)
- Galerias FiltrantesDocumento8 pagineGalerias FiltrantesLennin G. VizcarraNessuna valutazione finora
- E.max ZirCADDocumento40 pagineE.max ZirCADAngelicaNessuna valutazione finora
- No Idealidad en RQDocumento56 pagineNo Idealidad en RQDaniel Valdés100% (2)
- Normalización de Aceros, Soldaduras y Uniones HVDocumento125 pagineNormalización de Aceros, Soldaduras y Uniones HVElian MorantNessuna valutazione finora
- Sem.2 Tarea CalificadaDocumento3 pagineSem.2 Tarea CalificadaValey Zarai Felix AnarcayaNessuna valutazione finora
- Informe de LaboratorioDocumento10 pagineInforme de LaboratorioNicole Carolina Quintero RomeroNessuna valutazione finora