Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Trabajo Final Acuporinas Extra
Caricato da
Ana Lilia López AlcántaraCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Trabajo Final Acuporinas Extra
Caricato da
Ana Lilia López AlcántaraCopyright:
Formati disponibili
[ACUAPORINAS ; AQPS] 16 de abril de 2013
Universidad Autnoma Metropolitana, Unidad Iztapalapa Licenciatura en Biologa Experimental TRANSPORTE Y COMUNICACIN CELULAR Trabajo para Examen extraordinario Lpez Alcntara Ana Lilia
Acuaporinas
INTRODUCCIN
El agua ha sido un compuesto vital para la vida en la Tierra, y porqu no fuera de ella, sin embargo ste ltimo punto no es trascendental por ahora; si bien el agua al ser parte constitutiva de muchos organismos vivos, les permite interactuar con el medio de forma tal que su existencia se ve afectada directamente por la ausencia o presencia de sta, pero es importante conocer cul es la forma en que los organismos han de controlar: la entrada, salida y concentracin de dicho compuesto en
sus diversas estructuras celulares. En 1992, se realiz un estudio lidereado por Peter Agre, quien descubri que existen protenas integrales de membrana cuya importancia reside en permitir el paso del agua a travs de las membranas celulares en respuesta a gradientes osmticos (acuaporinas), de stas actualmente se conocen trece subtipos distribudos en diferentes rganos del ser humano como : rin, cerebro.ojos, sistema respiratorio, entre otros.
Qu son las acuaporinas? Las acuaporinas son protenas integrales de membrana cuyo peso va de entre 28 a 32 kDa, se localizan en la superficie de las membranas celulares (1) . Posen una secuencia de aminocidos altamente conservada que permite estimar una homologa de un 20-50% entre los diferentes miembros de sta familia. Estn constitudas por seis segmentos transmembrana hlice-alpha que rodean dos secuencias repetidas NPA (Asparagina,Prolina,Alanina) ; las terminales amino y carboxilo estn orientados hacia el citosol en una conformacin en reloj de arena.
[ACUAPORINAS ; AQPS] 16 de abril de 2013
Figura (A) Estructura de la acuaporina: Pose seis hlices-alpha transmembranales, adems de dos secuencias NPA repetidas, las terminaciones NH2 y COOH se encuentran invertidas.
Los dominios NPA forman parte fundamental del poro hidroflico , as como las fuerzas electrostticas entre dichos aminocidos polares , permitiendo el paso del agua o de pequeas molculas sin carga en favor de un gradiente de concentracin. El dimetro del poro es de 4-5 y en su interior las molculas de agua siguen un trayecto tortuoso , que deja pasar una nica molcula a la vez.(2)
Figura (B) Estructura de la acuaporina en foma de reloj de arena: La disposicin en tetrmeros genera la forma de reloj de arena dentro de la membrana.Debido a sto la acuaporina es ms estable permitiendo el paso de una molcula de agua por cada poro.
La distribucin de las acuaporinas es intramembranal en forma de monmeros, dnde cada monmero est constitudo por homotetrmeros caracterstica que le confiere mayor estabilidad.
[ACUAPORINAS ; AQPS] 16 de abril de 2013
Segn su permeabilidad, las acuaporinas se clasifican en tres grupos : Acuaporinas selectivas para agua ( AQP-0 ,AQP-1, AQP-2, AQP-4, AQP-5 ) , las acuaporinas transportadoras de : agua, glicerol y urea (AQP-3, AQP-7, AQP-9, AQP-10 y AQP-14) y las acuaporinas no-ortodoxas: AQP-6, AQP-8, AQP-11 y AQP-12 .
Acuaporinas AQP-0 AQP-1 AQP-2 AQP-4 AQP-5 Acuagliceroprotenas AQP-3 AQP-7 AQP-9 AQP-10 AQP No ortodoxas AQP-6 AQP-8 AQP-11 AQP-12 AQPxlo (AQP-14) sta acuaporina se encuentra nicamente en las ranas y en los mamferos de la subfamilia Prototheria
Tabla 1.0 Clasificacin de las acuaporinas. La tabla muestra las tres clasificaciones en que se subdividen las acuaporinas: Acuaporinas selectivas de agua, Acuaporinas selectivas a glicerol y urea (acuagliceroprotenas) y Acuaporinas no ortodoxas (cuya funcin no est definida an).
Sin embargo, existe una cuarta subdivisin de las Acuaporinas, sta est representada por la AQP-xlo, que es de recinte descubrimiento (2002), sta acuaporina pose de entre un 30 a 59 % de homologa con las acuagliceroporinas, dicha acuaporina fue descubierta gracias a la clonacin de los oocitos de Xenopus laevis , mostrando una alta permeabilidad osmtica al agua as como al glicerol y urea, pero de forma contraria, la acuaporina excluy a los polioles y a la tiourea. As mismo se observ que en un pH extracelular alcalino el flujo de agua era mayor , y en menor grado se observ la asimilacin de urea, pero no de glicerol , por dichos efectos es que la AQP-xlo es conciderda una nueva acuaporina paraloga en los mamferos.(5)
Por otro lado , la investigacin de las acuaporinas ha generado que hasta la fecha se tenga conocimiento de un extenso repertorio de genes que codifican para stas, citando por ejemplo que solo para la planta de algodn se tiene conocimiento de la existencia de ms de 70 genes parlogos que estn relacionado a las acuaporinas, en el caso de los animales invertebrados como los
[ACUAPORINAS ; AQPS] 16 de abril de 2013 telesteos, se conocen cerca de 18 genes parlogos, as mismo para la AQP-7 en el humano se tiene conocimiento de la existencia 17 genes parlogos (3) . Esto en conclusin nos hace tomar como referencia a las acuaporinas como un modelo de estudio , no solo para el conocimiento del transporte de agua en los organismos ,sino tambin para la reparacin de disfunciones en el sistema , ya que genera por ejemplo enfermedades tales como: las cataratas , Diabetes inspida nefrognica, Neuromielitis,entre otras. As mismo la investigacin de stas protenas , sirven como un modelo de estudio para anlisis de linajes evolutivos , lo cual nos permitir conoce qu tanta relacin existe entre las especies, y tal vez conocer con mayor facilidad el origen de la vida en el Tierra.
REFERENCIAS BIBLIOGRFICAS
1. Aquaporin wter channels: from atomic structure to clinical medicine; Agre Peter, King S. Landon, Journal of Physiology , The Physhiological Society (2002). 2. Acuaporinas: molculas revelacin en cosmetic y oncologa cutnea; Osorio Guiovana, Berbabu Jos, Artculo de Revisin . Artculo: 275.680 3. Aquaporin evolution in fishes ; Finn Nigel Roderick and Cerd Joan , Artculo de minirevisin, Frontiers in Physiology, July (2011). 4. The Aquaporins; Kruse Elisabeth, Uehlein Norbert and Kaldenhoff Ralf; Protein family review, February (2006). 5. Cloning and Functional Characterization of a Novel Aquaporin from Xenopus laevis Oocytes; Virkki V.Leila, Franke Christina; The journal of Biological Chemistry , The American Society for Biochemistry and Molecula Biology , Inc. October (2002).
Potrebbero piacerti anche
- Reporte Cuantificacion de Hongos y LevadurasDocumento6 pagineReporte Cuantificacion de Hongos y LevadurasAna Lilia López AlcántaraNessuna valutazione finora
- Reporte Práctica 1 MicrobiologíaDocumento9 pagineReporte Práctica 1 MicrobiologíaAna Lilia López AlcántaraNessuna valutazione finora
- Práctica 1 QUIMICA DE ADITIVOSDocumento9 paginePráctica 1 QUIMICA DE ADITIVOSAna Lilia López AlcántaraNessuna valutazione finora
- Ensayo Alimentación MexicanaDocumento4 pagineEnsayo Alimentación MexicanaAna Lilia López AlcántaraNessuna valutazione finora
- Obtencion de Acido Bencilico .LDocumento3 pagineObtencion de Acido Bencilico .LAna Lilia López Alcántara100% (1)
- Examen Operaciones UnitariasDocumento6 pagineExamen Operaciones UnitariasAna Lilia López AlcántaraNessuna valutazione finora
- P-TP-OPE-009 Instalacion de LamparasDocumento4 pagineP-TP-OPE-009 Instalacion de LamparasRony Medina MedinaNessuna valutazione finora
- Taller Intensivo Enero 23Documento45 pagineTaller Intensivo Enero 23Jardín de Niños ENRIQUE PESTALOZZINessuna valutazione finora
- Informe #1 - Equipos de Mecanica de RocassDocumento14 pagineInforme #1 - Equipos de Mecanica de RocassJose Carlos Juro ZavalaNessuna valutazione finora
- Realidad Nacional FinalDocumento5 pagineRealidad Nacional FinalcristianNessuna valutazione finora
- Kerbrat - Orechioni, La Problemática de La EnunciaciónDocumento12 pagineKerbrat - Orechioni, La Problemática de La EnunciaciónJude KiryuuNessuna valutazione finora
- Tarea 4 Domingo HugoDocumento5 pagineTarea 4 Domingo HugoHugo RamiroNessuna valutazione finora
- Clasificacion de Enfermedades en Las PlantasDocumento3 pagineClasificacion de Enfermedades en Las PlantasOmar BaltaNessuna valutazione finora
- Nic 37Documento13 pagineNic 37RaulGutierrezNessuna valutazione finora
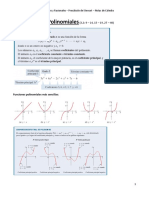
- 3.2-3.4 Funciones PolinomialesDocumento10 pagine3.2-3.4 Funciones PolinomialesRonald GutierrezNessuna valutazione finora
- SENTENCIA Oposición Al SaneamientoDocumento26 pagineSENTENCIA Oposición Al SaneamientoDGH AsesoríaNessuna valutazione finora
- 523 - G100 Instalador V 4.00Documento27 pagine523 - G100 Instalador V 4.00Leandro RuizNessuna valutazione finora
- Especificaciones Tecnicas para Levantamientos Topograficos Con Estacion TotalDocumento0 pagineEspecificaciones Tecnicas para Levantamientos Topograficos Con Estacion TotalEdgar HANessuna valutazione finora
- Calderon. - La Teoría Del Iceberg y La Práctica de La Alusión en Los Cuentos de Ernest Hemingway y de Francisco ColoaneDocumento8 pagineCalderon. - La Teoría Del Iceberg y La Práctica de La Alusión en Los Cuentos de Ernest Hemingway y de Francisco ColoaneClaudio GalvánNessuna valutazione finora
- Acido MuriaticoDocumento13 pagineAcido MuriaticoailenNessuna valutazione finora
- Procedimiento de Pegas Por TermofusionDocumento4 pagineProcedimiento de Pegas Por TermofusionFernando VillanuevaNessuna valutazione finora
- Trabajo Mecánico y PotenciaDocumento25 pagineTrabajo Mecánico y PotenciaERICK CACERESNessuna valutazione finora
- Delimitaciones Del Territorio de Oceanía TrabajoDocumento10 pagineDelimitaciones Del Territorio de Oceanía TrabajoBon LaxingNessuna valutazione finora
- Monitor4 Operation Manual Spanish PDFDocumento8 pagineMonitor4 Operation Manual Spanish PDFEzequiel RuizNessuna valutazione finora
- DIA 1 Elabora Tu Propuesta Sobre Cómo Se Pueden Mejorar Las Tierras de Cultivo Cuidando La Biodiversidad.Documento3 pagineDIA 1 Elabora Tu Propuesta Sobre Cómo Se Pueden Mejorar Las Tierras de Cultivo Cuidando La Biodiversidad.PINELLA CHAVEZNessuna valutazione finora
- ESTA+1 PRACTICA5 JoanVargas-NicolasAlmeciga PDFDocumento10 pagineESTA+1 PRACTICA5 JoanVargas-NicolasAlmeciga PDFJoan David Vargas PerezNessuna valutazione finora
- Marcelo Alvarez, Tarea Semana 6 PDFDocumento10 pagineMarcelo Alvarez, Tarea Semana 6 PDFMarcelo Alvarez ValenciaNessuna valutazione finora
- Diapositivas - Ley #29763Documento42 pagineDiapositivas - Ley #29763Humberto HernándezNessuna valutazione finora
- Grupo - 2 Capitulo 15Documento20 pagineGrupo - 2 Capitulo 15VALERIA ALONSO LOPEZNessuna valutazione finora
- TUMBES-Sílabo Deliberación y ParticipaciónDocumento9 pagineTUMBES-Sílabo Deliberación y ParticipaciónBrian Tooth100% (1)
- PadinDocumento14 paginePadinCristian MennilloNessuna valutazione finora
- Teoría de La Organización - GestioPolisDocumento81 pagineTeoría de La Organización - GestioPolisAlfredo SolorzanoNessuna valutazione finora
- Semana 14 - Actividad de Educación Física-PrimeroDocumento3 pagineSemana 14 - Actividad de Educación Física-PrimeroGegu Gegu100% (1)
- 1er Trabajo Parcial Circuitos Electricos11Documento7 pagine1er Trabajo Parcial Circuitos Electricos11Roberto BettNessuna valutazione finora
- PantógrafoDocumento5 paginePantógrafovalente222Nessuna valutazione finora
- Presentación 3Documento8 paginePresentación 3ricardo villegasNessuna valutazione finora