Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Informe #05
Caricato da
Luis Enrique Cóndor PorrasTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Informe #05
Caricato da
Luis Enrique Cóndor PorrasCopyright:
Formati disponibili
Qumica I 1 Gases
LABORATORIO N5 - GASES
I. OBJETIVO Estudiar algunas propiedades de los gases y comprobar experimentalmente el cumplimiento de las leyes de los gases. II. FUNDAMENTO TERICO En ciertas condiciones de presin y temperatura, es posible que la mayora de las sustancias existan en alguno de los tres estados de la materia: slido, lquido o gaseoso. Por ejemplo, el agua puede estar en estado slido como hielo, en estado lquido como agua o en estado gaseoso como vapor. Las propiedades fsicas de una sustancia dependen a menudo de su estado. Los gases son en diversos aspectos mucho ms sencillos que los lquidos y los lquidos. Sujetos a cambios de temperatura y presin, los gases se comportan en forma ms previsible que los slidos y los lquidos. Las leyes que norman este comportamiento han desempeado una importante funcin en el desarrollo de la teora atmica de la materia y la teora cintica molecular de los gases. Volumen molar (Vm): Volumen que ocupa un mol de gas en condiciones normales, conocido como el volumen molar estndar, es casi siempre una constante para todos los gases. EI volumen molar de un gas ideal en condiciones normales es 22,4 L/mol. n = [VCN/Vm) n = # de moles m = masa en g M = masa molecular VCN = volumen a CN a determinar Condiciones Normales (C.N.) => Vm = 22,4 L/mol a P = 1 atm y T = 0C
La Ley de Graham, formulada en 1829 por Thomas Graham, establece que las velocidades de efusin de los gases son inversamente proporcionales a las races cuadradas de sus respectivas densidades.
Laboratorio N5
Qumica I 2 Gases
III. EXPERIMENTACIN Y RESULTADOS En este laboratorio se llevaron a cabo 4 experimentos, para el estudio de los gases. Experimento 1: Propiedades de los gases Gas 1 (Dixido de carbono) Luego de la siguiente reaccin:
Observaciones: Al liberar el en el agua se observ la aparicin de burbujas que ascendan sin disminuir su tamao lo cual demuestra que no es soluble en agua. Adems al agregar fenolftalena a la solucin resultante notamos que se torna de un color violeta lo cual demuestra que la solucin es bsica. Para el gas se not que era incolora y tena un olor ligeramente picante. Gas 2 (Hidrgeno) Luego de la siguiente reaccin:
Observaciones: Luego de liberar el en el agua se nota que las burbujas se van co sumie do e e gu o que demuestr que e g s es so ub e e e gu . Adems al agregar fenolftalena a la solucin que quedo en el tubo de ensayo notamos que no cambia de color lo cual demuestra que es acida. Para el gas se not que era incolora y tena un olor desagradable. Tambin se not que al acercar el gas al fuego empez su combustin. Resultados GAS 1 Es soluble en agua? Es acida o bsica la solucin? Color Olor Es ms liviano o ms pesado que el aire? Aviva la combustin? No Bsica Incoloro Ligeramente picante Ms pesado No GAS 2 Si Acida Incoloro Desagradable Ms liviano Si
Laboratorio N5
Qumica I 3 Gases
Experimento 2: Determinacin del volumen molar
De la experiencia realizada se obtuvo los siguientes datos
Hallando la presin de la columna de agua Procedemos a transformar de mediante equivalencias
Hallando la presin del Mediante las siguientes ecuaciones hallamos la
De las dos ecuaciones se tiene
Laboratorio N5
Qumica I 4 Gases
Reemplazando
Hallando el volumen de H2 a CN Sea P, V y T: presin, volumen y temperatura respectivamente (valores cualesquiera). Para la cual para los gases ideales cumplen que
Pero para las condiciones normales
Reemplazando
Donde en nuestro caso
Laboratorio N5
Qumica I 5 Gases
Experimento 3: Comprobacin de la ley de Boyle-Mariotte Para este experimento se utiliz el equipo que muestra la figura:
El lquido manomtrico usado fue el agua. Se tomaron datos de presin, temperatura y volumen en 3 casos:
Niveles iguales Nivel de la pera 50 cm ms alto que la bureta Nivel de la pera 50 cm ms bajo que la bureta
Datos, clculos y resultados experimentales: Datos: Volumen del gas a niveles iguales: Volumen del cuando la pera a 50 cm ms alto: Volumen del cuando la pera a 50 cm ms bajo: Temperatura del agua: Presin baromtrica del laboratorio: Presin de vapor de agua a 20C: 46,7 mL 44,8 mL 48,9 mL 20C 752,1 mmHg 17,54 mmHg
Clculos: A niveles iguales: En este caso, la presin que ejerce el gas hmedo es igual a la presin baromtrica del laboratorio, para hallar la presin del gas seco debemos restarle la presin de vapor de agua a 20C a la del gas hmedo y siendo el volumen del gas seco igual al del volumen del gas hmedo, entonces:
Laboratorio N5
Qumica I 6 Gases
Hallando P.V, para el gas seco
Nivel de la pera 50 cm ms alto: En este caso, la presin que ejerce el gas hmedo es igual a la presin baromtrica del laboratorio ms la ejercida por los 50 cm de agua, entonces hallamos el equivalente de la columna de agua en mmHg: Sabemos:
Entonces reemplazando los valores respectivos H2O:
Se calcula la presin del gas seco como en el caso anterior, adems el volumen vara:
Hallando P.V, para el gas seco
Laboratorio N5
Qumica I 7 Gases
Nivel de la pera 50 cm ms bajo: En este caso, la presin que ejerce el gas hmedo es igual a la presin baromtrica del laboratorio menos la ejercida por los 50 cm de agua, entonces del caso anterior, el equivalente de la columna de agua en mmHg es:
Se calcula la presin del gas seco como en el caso anterior, adems el volumen vara:
Hallando P.V, para el gas seco
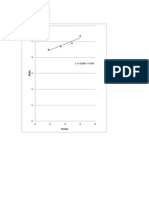
Resultados Presin del gas hmedo (mmHg) Nivel de la pera 50 cm ms alto Niveles iguales Nivel de la pera 50 cm ms bajo Observaciones: El valor de la presin de vapor de agua a 20C es terico puesto que no se considera la humedad relativa en la experimentacin. La tabla de resultados muestra valores muy similares en el producto de la presin y volumen para el gas seco, lo que comprueba la ley de BoyleMariotte. Las variaciones de volumen son similares.
Laboratorio N5
Presin del gas seco (mmHg) 771,36 734,56 697,76
Volumen del gas seco (mL) 44,8 46,7 48,9
P.V (Gas seco) 34562,304 34303,952 34120,464
788,9 752,1 715,3
Qumica I 8 Gases
Experimento 4: Difusin de Graham
Clculos y resultados: Calculando la masa molar de HCl y NH3: HCl = 36.46 g/mol NH3 = 17.031 g/mol
Aplicando la ley de Graham para el clculo de la velocidad de difusin de cada uno de los gases.
Tomando en cuenta una observacin de la cinemtica, calculamos el punto donde se produce el encuentro entre los dos gases.
T= = (4.12 k) = (6.03 K) Observacin: El anillo formado en el tubo en la comprobacin de la ley de Graham es la sal NH4Cl (s) producto de la reaccin de cloro gaseoso y amoniaco .
Laboratorio N5
= 0.19m = 19 cm = 0.28m =28 cm
Qumica I 9 Gases
IV. PREGUNTAS
1.- Mencione las propiedades fsicas y qumicas ms importantes del gas CO 2 obtenido en el laboratorio.
El anhdrido carbnico o dixido de carbono es un gas resultante de la combinacin de dos cuerpos simples: el carbono y el oxgeno. Se produce por la combustin del carbn o los hidrocarburos, la fermentacin de los lquidos y la respiracin de los humanos y de los animales. Presente en proporcin dbil en la atmsfera, se asimila por las plantas, que por su parte devuelven oxgeno. En resumen, el CO2 es un gas de olor ligeramente picante, incoloro y ms pesado que el aire. De estructura cristalina parecida al cuarzo. No es esencial para la vida. Solidifica a temperatura de -78,5C, formando nieve carbnica. En solucin acuosa el gas crea el cido carbnico, muy inestable para ser aislado de forma sencilla .
2.- Mencione las propiedades fsicas y qumicas ms importantes del gas H2 obtenido en el laboratorio.
La molcula de hidrgeno, en condiciones usuales, es un gas incoloro, inodoro e inspido. Es la molcula ms pequea que se conoce. Su densidad es = 273 Kg./L., y su densidad como gas es 76 Kg./m3. Tiene gran rapidez de transicin de las molculas a la fase gaseosa de ah la ausencia casi total del hidrgeno en la atmsfera terrestre. Tambin tiene gran facilidad de difusin y efusin, y buena conductividad calorfica. El Hidrgeno es altamente inflamable, muy ligero, no permite la vida y reacciona fcilmente con otras sustancia qumicas.
3.- Al determinar el volumen molar con los datos obtenidos en el laboratorio Cul es el porcentaje de error cometido respecto al volumen molar teorico?.
%de error = % de error =
V. CONCLUSIONES Las propiedades de los gases son diversas y muy variadas dependiendo de qu elemento se trate. En la comprobacin de la ley de Boyle-Mariotte se trabaj con datos con poca precisin en su medicin por lo que de haber sido ms precisos, se hubiese obtenido una mejor comprobacin.
Laboratorio N5
= 00.18 %
Qumica I 10 Gases
Luego de analizar el comportamiento de los gases concluimos que tienden a fluir de una zona de mayor a otra de menor presin. La velocidad de un gas es inversamente proporcional a su masa molar y densidad. Los gases pueden ser trasportados por un medio diferente a su estado fsico como solido o lquido.
VI. APLICACIONES INDUSTRIALES Los gases industriales son un grupo de gases manufacturados que se comercializan con usos en diversas aplicaciones. Principalmente son empleados en procesos industriales, tales como la fabricacin de acero, aplicaciones mdicas, fertilizantes, semiconductores, etc. Pueden ser a la vez orgnicos e inorgnicos y se obtienen del aire mediante un proceso de separacin o producidos por sntesis qumica. Pueden tomar distintas formas como comprimidos, en estado lquido, o slido. Clases de gases industriales acetileno (C2H2) dixido de carbono (CO2) monxido de carbono (CO) cloro (Cl2) hidrgeno (H2) cloruro de hidrgeno (HCl) metano (CH4) xido nitroso (N2O) propano (C3H8) dixido de azufre (SO2)
VII. BIBLIOGRAFA Chang, Raymond. Qumica. Mxico: Editorial McGraw-Hill, 6 ed., 1998. Texto clsico de qumica general apropiado para los estudiantes de los primeros cursos de universidad. Describe los estados de la materia y sus propiedades de una manera muy didctica. Petrucci, R. y Harwood, W. Qumica General. Principios y aplicaciones. Madrid: Editorial Prentice Hall, 7 ed., 1998. Texto de consulta apropiado para los estudiantes de los primeros cursos de universidad. http://es.wikipedia.org/wiki/Gas_industrial
Laboratorio N5
Potrebbero piacerti anche
- 7 Principios de La Seguridad Basada en ComportamientosDocumento11 pagine7 Principios de La Seguridad Basada en ComportamientosJako Mestre Maldonado100% (1)
- Espirometria 1aDocumento82 pagineEspirometria 1aLuis Enrique Cóndor PorrasNessuna valutazione finora
- SBCDocumento9 pagineSBCFacundo Pejovez CicarelliNessuna valutazione finora
- DO-SGI-02 - Objetivos de Seguridad, Salud Ocupacional, Medio Ambiente y Calidad - Ver.06Documento3 pagineDO-SGI-02 - Objetivos de Seguridad, Salud Ocupacional, Medio Ambiente y Calidad - Ver.06Luis Enrique Cóndor PorrasNessuna valutazione finora
- Seguridad basada en el comportamientoDocumento49 pagineSeguridad basada en el comportamientoMarielis RodríguezNessuna valutazione finora
- Lab Quimica 3Documento10 pagineLab Quimica 3Luis Enrique Cóndor PorrasNessuna valutazione finora
- Lab Quimica 3Documento10 pagineLab Quimica 3Luis Enrique Cóndor PorrasNessuna valutazione finora
- Errores y MedicionDocumento20 pagineErrores y MedicionLuis Enrique Cóndor PorrasNessuna valutazione finora
- CuerpoDocumento14 pagineCuerpoLuis Enrique Cóndor PorrasNessuna valutazione finora
- Segunda Ley de NewtonDocumento11 pagineSegunda Ley de NewtonLuis Enrique Cóndor PorrasNessuna valutazione finora
- Segunda Ley de NewtonDocumento11 pagineSegunda Ley de NewtonLuis Enrique Cóndor PorrasNessuna valutazione finora
- 1 - PrologoDocumento3 pagine1 - PrologoLuis Enrique Cóndor PorrasNessuna valutazione finora
- Características de La LlamaDocumento16 pagineCaracterísticas de La LlamaLuis Enrique Cóndor PorrasNessuna valutazione finora
- Segunda Ley de NewtonDocumento11 pagineSegunda Ley de NewtonLuis Enrique Cóndor PorrasNessuna valutazione finora
- Diagramas Velocidad InstantaneaDocumento3 pagineDiagramas Velocidad InstantaneaLuis Enrique Cóndor PorrasNessuna valutazione finora
- Laboratorio Velocidad Instantanea y Aceleracion FinalDocumento9 pagineLaboratorio Velocidad Instantanea y Aceleracion FinalLuis Enrique Cóndor Porras100% (1)
- Valoriz 2 Colegio A Unid FebDocumento3 pagineValoriz 2 Colegio A Unid FebLuis Enrique Cóndor PorrasNessuna valutazione finora
- Experimento QuimicaDocumento4 pagineExperimento QuimicaLuis Enrique Cóndor PorrasNessuna valutazione finora
- Tipos de Topología de RedDocumento2 pagineTipos de Topología de RedLander LezcanoNessuna valutazione finora
- SistemaLubricacionMotoresDocumento21 pagineSistemaLubricacionMotoresVianey GuadalupeNessuna valutazione finora
- TRABAJO ESMERILADO 181761 - Et Al. Grupo 3Documento10 pagineTRABAJO ESMERILADO 181761 - Et Al. Grupo 3DANIEL FELIPE OVALLE PICONNessuna valutazione finora
- ET RiegoDocumento22 pagineET RiegoJuan Manuel Prieto MontesNessuna valutazione finora
- Taller Sistemas Aplicados Tema ExcelDocumento2 pagineTaller Sistemas Aplicados Tema ExcelDavid Gonzalez TovarNessuna valutazione finora
- Memoria de Cálculo Sib GralDocumento15 pagineMemoria de Cálculo Sib GralWalter Nieves Sandi0% (1)
- Algoritmos A DesarrollarDocumento64 pagineAlgoritmos A DesarrollarMartha SalgueroNessuna valutazione finora
- EstadisticaDocumento16 pagineEstadisticaJuan Herrera MuñozNessuna valutazione finora
- La Serie Armónica y La Serie de Los Inversos de Los Números PrimosDocumento2 pagineLa Serie Armónica y La Serie de Los Inversos de Los Números PrimosGustavo RíosNessuna valutazione finora
- Riesgosen Gasoductos IAPGDocumento26 pagineRiesgosen Gasoductos IAPGHJ SJNessuna valutazione finora
- Paul DiracDocumento5 paginePaul DiracOctavio JuarezNessuna valutazione finora
- 2021 1 Edu1401 3 PDFDocumento9 pagine2021 1 Edu1401 3 PDFDiego DíazNessuna valutazione finora
- 34.1 JIMÉNEZ Guerrero, Magdalena Diana - Razonamiento Complejo PDFDocumento222 pagine34.1 JIMÉNEZ Guerrero, Magdalena Diana - Razonamiento Complejo PDFLetty Guzmán100% (11)
- Análisis PredictivoDocumento8 pagineAnálisis PredictivoBetzaida CoronadoNessuna valutazione finora
- El Diseño FotográficoDocumento120 pagineEl Diseño FotográficoAndrés Giovanni Rozo Samer100% (1)
- Ballestas en vehículos de carga: tipos y funciones principalesDocumento11 pagineBallestas en vehículos de carga: tipos y funciones principalesMiguel MaciasNessuna valutazione finora
- Simetría en figuras 2DDocumento18 pagineSimetría en figuras 2Dalexisomar_cidNessuna valutazione finora
- Grúa Telescópica Móvil Grove Tms800eDocumento13 pagineGrúa Telescópica Móvil Grove Tms800eKenneth Humberto Pérez PachecoNessuna valutazione finora
- Tesis Doctoral - David Alonso UrbanoDocumento608 pagineTesis Doctoral - David Alonso UrbanoEmma AlarconNessuna valutazione finora
- Diapo FinalesDocumento48 pagineDiapo FinalesJose Gonzales100% (1)
- Hds SimeticonaDocumento10 pagineHds SimeticonaJuan Pablo BarralesNessuna valutazione finora
- Guia para Realizar ProtocoloDocumento19 pagineGuia para Realizar ProtocoloBuho TenazNessuna valutazione finora
- SCV 2016 A 01Documento20 pagineSCV 2016 A 01Saulo124Nessuna valutazione finora
- Benex (1) (1) WDDocumento12 pagineBenex (1) (1) WDfernandoNessuna valutazione finora
- Capitulo 6.1 - Cargas DistribuidasDocumento7 pagineCapitulo 6.1 - Cargas DistribuidasFranco PetoNessuna valutazione finora
- Examen Final Estadisticaii Intento 2Documento6 pagineExamen Final Estadisticaii Intento 2MARTHA MARTINEZNessuna valutazione finora
- Investigación de mercado de la panadería RosyDocumento9 pagineInvestigación de mercado de la panadería RosyMaria Elizabeth Alhuay Urquizo0% (1)
- Trazos y Valoración: Dibujo 1 2023-0Documento5 pagineTrazos y Valoración: Dibujo 1 2023-0Franco UgarteNessuna valutazione finora
- Medición de PresiónDocumento32 pagineMedición de PresiónJose Campos DiazNessuna valutazione finora
- El Mundo en Que Vivimos: Las Rocas y Los MineralesDocumento2 pagineEl Mundo en Que Vivimos: Las Rocas y Los MineralesSpolen ZupasmaniakNessuna valutazione finora