Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Prática 06-CONDUTIVIDADE
Caricato da
Adriano MedeirosTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Prática 06-CONDUTIVIDADE
Caricato da
Adriano MedeirosCopyright:
Formati disponibili
1
Adriano Csar Bernardo de Medeiros Universidade Federal de Pernambuco, Recife - PE.
Licenciatura em fsica
Data da prtica:23/08/2013; Data de entrega do relatrio:14/09/13 Resumo: Introduo: Experimental: Res. e disc.: Concluso: Referncias: Nota final: /0,5 /1,5 /0,5 /6,0 /1,0 /0,5 /10,0
1. Resumo
Eletrlito toda a substncia que se dissocia ou ioniza originando ons positivos (ctions) e ons negativos (nions) pela adio de um solvente ou aquecimento. Desta forma tornase um condutor de eletricidade. Medidas de condutncia eltrica permitem diferenciar eletrlitos fracos e fortes. Examinando a dependncia da condutividade com a concentrao possvel determinar a condutividade de eletrlitos a uma diluio infinita e, desta forma, calcular o grau de dissociao e a constante de dissociao de eletrlitos fracos. O objetivo deste experimento determinar o ponto de equivalncia da titulao de solues de HCl com NaOH pelo mtodo condutimtrico e comparar com o resultado obtido pelo uso do indicador fenolftalena.
2.
Introduo
A condutimetria o mtodo que verifica a capacidade da anlise de conduzir uma corrente eltrica. Na condutimetria a grandeza medida a condutncia (condutividade) de uma soluo, que traduz a maior ou menor facilidade com que uma soluo conduz a corrente eltrica. Em solues lquidas a corrente conduzida entre os eltrodos pelos ons dissolvidos. Em solues lquidas a corrente conduzida entre os eletrodos pelos ons dissolvidos. A condutncia da soluo depende do nmero e dos tipos de ons na soluo. O tamanho dos ons importante porque ele determina a velocidade com que os ons podem propagarse atravs da soluo. Os ons menores movem-se mais rapidamente do que os maiores. A carga significante porque ele determina a quantidade da atrao eletrosttica entre o eletrodo e os ons. A condutncia especfica de uma soluo de um eletrlito depende dos ons presentes,
variando a sua concentrao. Quando se dilui a soluo de um eletrlito, a condutncia especfica diminui, pois h menos ons por ml de soluo para conduzir a corrente. Se a soluo se coloca entre dois eletrodos separados e o suficientemente grandes como para conter totalmente a soluo, a condutncia aumenta a medida que a soluo se dilui. Isto se deve principalmente a uma diminuio das aes interinicas dos eletrlitos fortes e a um aumento na grade de dissociao dos eletrlitos fracos. Se existe 1 equivalentegrama do soluto, a condutncia dessa soluo se denomina condutncia equivalente. Para eletrlitos fortes, a condutncia equivalente aumenta medida que a concentrao diminui e se aproxima de um valor limite, denominado condutncia equivalente diluio infinita. A quantidade dessa condutncia equivalente pode ser determinada por extrapolao. J para os eletrlitos fracos, no se pode empregar o mtodo de extrapolao, mas pode-se calcular atravs da condutncia equivalente, a diluio infinita dos respectivos ons de acordo com a Lei de migrao independente dos ons. Como a medida condutomtrica requer a presena de ons, a condutometria no comumente utilizada para as anlises de molculas que no se dissociam. A medida da condutncia o total de da condutncia de todos os ons da soluo. Desde que todos os ons contribuam para a condutividade da soluo, o mtodo no particularmente utilizado para a anlise qualitativa, pois o mtodo no seletivo. As duas maiores utilizaes da condutometria so para monitorar o total da condutncia de uma soluo e para determinar o ponto final das titulaes que envolvem ons. Os medidores condutomtricos so utilizados nos sistemas de purificao da gua, deionizadores, para indicar a presena ou a ausncia de ons livres na gua. Qumica Experimental LF2, prtica 06.
Experimento -6-
TIRULAO CONDUTIMTRICA
3. 3.1.
Parte experimental Reagentes e equipamentos
Material e Reagentes Condutivmetro Agitador magntico Bqueres de 100 mL Bureta de 50 mL Soluo de NaOH 0,01 M Soluo de HCl 0,01 M Pra Erlenmeyer de 125 mL Fenolftalena Um Comprimido de Aspirina ou similar 3.2. Procedimentos
3.2.1
Inicialmente fizemos uma titulao usual de 25 mL de HCl 0.01 M com NaOH 0,001 M usando 2 gotas de fenolftalena como indicador. Fizemos a titulao com a bureta de 50 mL preenchido com soluo NaOH 0,01 M e anotamos o resultado. Realizamos esse procedimento por mais duas vezes.
Ligamos o agitador magntico em baixa velocidade e medimos a condutividade. Procedemos com a titulao condutimtrica, gotejando a soluo de NaOH 0,01 M (de 2 em 2 mL), anotando o valor da condutividade na tabela aps cada adio at chegarmos a 40,00 mL de NaOH. Anotamos os resultados que deram origem tebela 01.
4. Discusso e Resultados 4.2.1 Resultado 3.2.1
Aps titulao usual do HCl 0,01 verificamos os seguintes resultados. 1) 28,1 mL de HCl 2) 31,1 mL de HCl 3) 31,8 mL de HCl Fator NaOH 1,0282 M
4.2.2 Resultado 3.2.2 soluo
Soluao pura de HCl HCl + 2 mL NaOH HCl + 4 mL NaOH HCl + 6 mL NaOH HCl + 8 mL NaOH HCl + 10 mL NaOH HCl + 12 mL NaOH HCl + 14 mL NaOH HCl + 16 mL NaOH HCl + 18 mL NaOH HCl + 20 mL NaOH HCl + 22 mL NaOH HCl + 24 mL NaOH HCl + 26 mL NaOH HCl + 28 mL NaOH HCl + 30 mL NaOH HCl + 32 mL NaOH HCl + 34 mL NaOH HCl + 36 mL NaOH HCl + 38 mL NaOH HCl + 40 mL NaOH
3.2.2
Colocamos 25 mL de HCl 0,01 M em um bquer de 250 mL e mergulhamos a clula do condutivmetro lavadas com lcool etlico. Adicionamos 80 mL de gua destilada para a soluo cobrir o condutivmetro. Colocamos uma barra magntica no bquer e montamos o sistema. (fig 01)
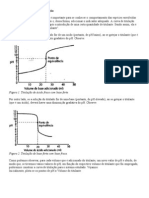
Condutividade (mS/cm) 8,58 7,40 6,51 5,97 5,32 4,54 4,07 3,56 3,14 2,57 2,42 2,00 1,70 1,44 1,21 1,27 1,37 1,46 1,55 1,63 1,71
Tabela 01
fig. 01
Qumica Experimental LF2, prtica 06.
5. Concluso
O experimento nos verificou a condutividade molar diluio infinita de um eletrlito forte HCl (acido Clordrico) onde a extrapolao da linha reta equivale a condutncia da concentrao zero que determina a condutncia na diluio infinita.
Questes
1) Quais os princpios envolvidos numa titulao condutimtrica? A adio de um eletrlito a uma soluo de outro eletrlito, em condies que no provoquem aprecivel alterao do volume, afetar a condutncia da soluo conforme possam ocorrer, ou no, reaes inicas. Quando no ocorrer reao inica, como na adio de um sal simples a outro, a condutncia ser, simplesmente, aumentada. Se ocorrer reao inica, a condutncia pode ou crescer ou decrescer; assim, na adio de uma base a um cido forte, a condutncia diminui em virtude da substituio dos ons hidrognio, que tem condutividade elevada, por um outro ction de menor condutividade. Este o princpio bsico das titulaes condutimtricas, ou seja, a substituio de ons, que tm uma certa condutividade, por outros ons, com outra condutividade. 2) Indique quais os erros que podem ocorrer na titulao condutimtrica e na usual. Como minimiz-los? 3) A partir dos resultados obtidos numa titulao condutimtrica, explique como se determina o ponto de equivalncia. Neste tipo de titulao, o ponto de equivalncia se d aproximadamente em pH 7, pois o cido ioniza-se praticamente na totalidade e a base se dissocia praticamente na totalidade. Quando os ons H3O+ e OHreagem, formam gua. HCl com NaOH: HCl(aq) Cl-(aq) + H3O+ (aq) (ionizao do cido) NaOH(aq) Na+(aq) + OH-(aq) (dissociao da base) OH-(aq) + H3O+(aq) 2H2O(l) (a reao de neutralizao que ocorre na titulao) Numa titulao de uma base forte com um cido forte ocorre o mesmo tipo de reaes e o ponto de equivalncia o mesmo, tendo como diferena a forma da curva de titulao (em vez de ser crescente decrescente).
Grfico 1. Titulao de 25 mL de soluo (aps diluio) co NaOH a 0,01 M.
Observamos ento que a condutncia molar de um eletrlito forte varia com a concentrao do eletrlito, pois este proporcional ao nmero de ons na soluo. Para um eletrlito forte vimos que a condutncia molar diminui com a concentrao sendo que a concentrao de ons em soluo proporcional a concentrao do eletrlito.
6. Referncias
Brown, T.L.; Lemay, H.E.; Bursten, B.E. Atkins, P.; Jones, L. Princpios de Qumica B.H. Mahan. Qumica: curso universitario. So Paulo, 2005.
Qumica Experimental LF2, prtica 06.
Potrebbero piacerti anche
- Lista de Exercícios Força Centrípeta PDFDocumento51 pagineLista de Exercícios Força Centrípeta PDFAdriano Medeiros100% (1)
- Aula 41 Dinamica Do Movimento Circular 1 PDFDocumento2 pagineAula 41 Dinamica Do Movimento Circular 1 PDFAdriano MedeirosNessuna valutazione finora
- Listamovcircblog 1Documento5 pagineListamovcircblog 1Adriano MedeirosNessuna valutazione finora
- Força Centripeta - 1o - Ano - Fisica - Carlos - AlbertoDocumento2 pagineForça Centripeta - 1o - Ano - Fisica - Carlos - AlbertoAdriano MedeirosNessuna valutazione finora
- 1 Lista de Física 1MDocumento2 pagine1 Lista de Física 1MAdriano MedeirosNessuna valutazione finora
- Provas-Anteriores Aeronautica Eear Cfs Cfs-b-1-2007Documento12 pagineProvas-Anteriores Aeronautica Eear Cfs Cfs-b-1-2007Davi SperandioNessuna valutazione finora
- ListaCinematicaVetorial e ForcaCentripetaDocumento11 pagineListaCinematicaVetorial e ForcaCentripetaAdriano MedeirosNessuna valutazione finora
- 87 - Testes - Hidrostatica - EXERCICIOS PDFDocumento17 pagine87 - Testes - Hidrostatica - EXERCICIOS PDFAdriano MedeirosNessuna valutazione finora
- Cefetpr1 Fis Geo QuimDocumento11 pagineCefetpr1 Fis Geo QuimPablo AmaralNessuna valutazione finora
- Física - Aula 06 - Mecância - Dinâmica - Atrito e Plano InclinadoDocumento9 pagineFísica - Aula 06 - Mecância - Dinâmica - Atrito e Plano InclinadoFísica Concurso Vestibular100% (7)
- Revisao Fis - EEAr PDFDocumento4 pagineRevisao Fis - EEAr PDFAdriano MedeirosNessuna valutazione finora
- Ciências Da NaturezaDocumento40 pagineCiências Da NaturezaAdriano MedeirosNessuna valutazione finora
- Gabarito - S7 - Sim - Enem - Humanas e Tecnologias - 2013 PDFDocumento1 paginaGabarito - S7 - Sim - Enem - Humanas e Tecnologias - 2013 PDFAdriano MedeirosNessuna valutazione finora
- Módulo Pedagógico (INADE)Documento88 pagineMódulo Pedagógico (INADE)Adriano MedeirosNessuna valutazione finora
- Refração MedDocumento2 pagineRefração MedAdriano MedeirosNessuna valutazione finora
- O Paradoxo Hidrostático de Galileu e A Lei de ArquimedesDocumento22 pagineO Paradoxo Hidrostático de Galileu e A Lei de ArquimedesGuilherme Weber100% (1)
- 1303 1308 2017032708485438Documento5 pagine1303 1308 2017032708485438Adriano MedeirosNessuna valutazione finora
- Eletrostatica - Aula01 V Ou FDocumento4 pagineEletrostatica - Aula01 V Ou FclovisjrNessuna valutazione finora
- Fisica e ArteDocumento8 pagineFisica e ArteAdriano MedeirosNessuna valutazione finora
- Lista de Espelhos Planos e Esfc3a9ricosDocumento6 pagineLista de Espelhos Planos e Esfc3a9ricosAdriano MedeirosNessuna valutazione finora
- 1.1. Física - Teoria - Livro 1Documento48 pagine1.1. Física - Teoria - Livro 1J Sophia CrisNessuna valutazione finora
- 87 Testes Hidrostatica - EXERCICIOSDocumento17 pagine87 Testes Hidrostatica - EXERCICIOSMarcel Messias Gonçalves0% (1)
- Gabarito Ssa2 - 1ß DiaDocumento2 pagineGabarito Ssa2 - 1ß DiaAdriano MedeirosNessuna valutazione finora
- FISV484 A 114Documento29 pagineFISV484 A 114Luiz SantosNessuna valutazione finora
- Novo Enem OpticaDocumento17 pagineNovo Enem OpticaAdriano MedeirosNessuna valutazione finora
- TD012FIS12 AFA EFOMM Espelhos EsfericosDocumento8 pagineTD012FIS12 AFA EFOMM Espelhos EsfericosAdriano MedeirosNessuna valutazione finora
- Acustica 2014 ExerciciosDocumento8 pagineAcustica 2014 ExerciciosAdriano MedeirosNessuna valutazione finora
- 01 Ie Es CFS A 2017Documento59 pagine01 Ie Es CFS A 2017Adriano MedeirosNessuna valutazione finora
- 2va - Quimica AnaliticaDocumento10 pagine2va - Quimica AnaliticaIgor MarçalNessuna valutazione finora
- Analise PotassioDocumento141 pagineAnalise PotassioLuCas Vieira CintraNessuna valutazione finora
- modEXAME QuimicaDocumento5 paginemodEXAME QuimicaErik CuradoNessuna valutazione finora
- Titulação LeiteDocumento1 paginaTitulação LeiteSameque PereiraNessuna valutazione finora
- Modelo Ficha Técnica CQ PDFDocumento8 pagineModelo Ficha Técnica CQ PDFfabiana dos santosNessuna valutazione finora
- NBR 10739 - 1989 - Agua - Determinacao de Oxigenio Consumido - Metodo Do Permanganato de PotassioDocumento3 pagineNBR 10739 - 1989 - Agua - Determinacao de Oxigenio Consumido - Metodo Do Permanganato de PotassioItalo Lacerda Fernandes100% (3)
- Relatório de Estágio IRGOVELDocumento16 pagineRelatório de Estágio IRGOVELViviane Marques100% (1)
- NBR 10908 - 1990 - Aditivos para Argamassa e Concreto - Ensaios de UniformidadeDocumento7 pagineNBR 10908 - 1990 - Aditivos para Argamassa e Concreto - Ensaios de UniformidadeRonald Rolim de MouraNessuna valutazione finora
- Solucoes e Volumetria E1669386669Documento98 pagineSolucoes e Volumetria E1669386669Mariana Teixeira CheremNessuna valutazione finora
- 2010-Tratamiento de Tintes TextiklesDocumento6 pagine2010-Tratamiento de Tintes TextiklesEdúTiconaNessuna valutazione finora
- Manual de Preparo de SolucoesDocumento24 pagineManual de Preparo de SolucoesFranciele PereiraNessuna valutazione finora
- Experimento 5 - Determinacao Do Teor de Acido Acetilssalicilico em Comprimidos - 1 Bimestre 2015 - 2 SeriesDocumento3 pagineExperimento 5 - Determinacao Do Teor de Acido Acetilssalicilico em Comprimidos - 1 Bimestre 2015 - 2 Seriesclaudio alvesNessuna valutazione finora
- Indicador Inuversal YamadaDocumento3 pagineIndicador Inuversal YamadaeduenglerNessuna valutazione finora
- Relatorio Bromatologia - DanielaDocumento12 pagineRelatorio Bromatologia - DanielaDaniela MirandaNessuna valutazione finora
- NBR 13736Documento4 pagineNBR 13736francypbNessuna valutazione finora
- Construção de Curvas de TitulaçãoDocumento19 pagineConstrução de Curvas de TitulaçãoEliana AlvarengaNessuna valutazione finora
- Estudo Das Soluções Parte LLDocumento10 pagineEstudo Das Soluções Parte LLariadneNessuna valutazione finora
- Experimento 8 - Determinao de Ferro em Lmina de BarbearDocumento3 pagineExperimento 8 - Determinao de Ferro em Lmina de Barbeardeyvison100% (1)
- Determinação Da Dureza Da ÁguaDocumento8 pagineDeterminação Da Dureza Da ÁguaIsabella AvelarNessuna valutazione finora
- AdhbhskDocumento3 pagineAdhbhskKatia FonsecaNessuna valutazione finora
- Questoes - FQ - 2018 (1) - 1 PDFDocumento460 pagineQuestoes - FQ - 2018 (1) - 1 PDFjulioyjuliana2012Nessuna valutazione finora
- Acidez SulfuricaDocumento4 pagineAcidez SulfuricaRaniel Gomes AlexandreNessuna valutazione finora
- Guiao de Laboratorio ICB - TL1eTL2Documento17 pagineGuiao de Laboratorio ICB - TL1eTL2Nu Film CriticsNessuna valutazione finora
- Aula 6 Titulometria de Precipitação QUI094 2012.1Documento29 pagineAula 6 Titulometria de Precipitação QUI094 2012.1Izaias AiresNessuna valutazione finora
- Aula Ensaios de PurezaDocumento38 pagineAula Ensaios de PurezaMatheus SilvaNessuna valutazione finora
- Prática 1determinação Do Teor de Vitamina CDocumento9 paginePrática 1determinação Do Teor de Vitamina CAllanNessuna valutazione finora
- Determinação Do Teor de Cloreto Numa Amostra de SoroDocumento15 pagineDeterminação Do Teor de Cloreto Numa Amostra de SorobetoborNessuna valutazione finora
- Titulacao PDFDocumento20 pagineTitulacao PDFSaymon SiqueiraNessuna valutazione finora
- Metodos - Analiticos I245Documento218 pagineMetodos - Analiticos I245UdiFlavyNessuna valutazione finora
- Determinação Espectrofotométrica de Ferro em Uma Amostra de Minério de FerroDocumento4 pagineDeterminação Espectrofotométrica de Ferro em Uma Amostra de Minério de FerroDanielle AlkmimNessuna valutazione finora