Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Modulo 3 Quimica PDF
Caricato da
juan_pcnTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Modulo 3 Quimica PDF
Caricato da
juan_pcnCopyright:
Formati disponibili
ARTICULACIN QUMICA - MDULO III Teora
UNIVERSIDAD DE BUENOS AIRES
PROGRAMA DE EDUCACIN A DISTANCIA UBA XXI
Proyecto de Articulacin con Enseanza Media
Curso:
NOCIONES BSICAS DE QUMICA
PATRICIA SUSANA MORENO LETICIA ZUCCARO 2006 Derechos reservados. Ley 11723.
ARTICULACIN QUMICA - MDULO III Teora
Recomendaciones
Comiencen por leer el contenido terico de cada mdulo. Presten suma atencin a las aclaraciones, ya sea en los conceptos o en la resolucin de problemas tipo. Resuelvan las actividades propuestas utilizando los conocimientos que ya poseen y los nuevos adquiridos en cada mdulo. No se apresuren con las respuestas, la primera opcin no siempre es la correcta, es vlido probar y cambiar hasta convencerse de que es el camino adecuado. Vuelvan a leer las explicaciones tericas y la bibliografa o visiten los sitios web recomendados, tantas veces como consideren necesario para resolver los ejercicios propuestos. Consulten a su tutor. Una vez que el ejercicio est resuelto, cotjenlo con la solucin que les proponemos. Recuerden que no hay un nico camino, y les estamos dando slo uno de ellos. No se hagan trampa acudiendo a las resoluciones antes de terminar. Eso no los ayuda, les crea la falsa sensacin de que entienden cuando en realidad no es as. Deben llegar al resultado, en lo posible sin ayuda externa y luego analizar, en caso de que no coincidan sus resultados con los que nosotras proponemos, dnde estuvo el error y en qu consisti. Organicen su tiempo teniendo en cuenta el cronograma presentado. Resuelvan las autoevaluaciones. stas les ayudarn a decidir si pueden avanzar o volver un paso atrs y revisar algunas cuestiones antes de proseguir el camino.
Esperamos que este curso les resulte ameno y til y los ayude a superar la barrera que suele levantarse entre ustedes y la universidad. Les deseamos xito en la tarea que van a emprender y cuenten con nuestro apoyo ante cualquier dificultad.
Patricia Susana Moreno - Leticia Zuccaro
ARTICULACIN QUMICA - MDULO III Teora
MDULO III TEORA ATMICA Y MAGNITUDES ATMICO-MOLECULARES
ARTICULACIN QUMICA - MDULO III Teora
Mdulo III: TEORA ATMICA Y MAGNITUDES ATMICO-MOLECULARES TEMARIO
1 Introduccin Retomando el mdulo 1: El mundo que nos rodea 2 Evolucin de la teora atmica 2.a.- Teora atmica de Dalton 2.b.- Teora atmica moderna 3 Estructura atmica 3.a.- Nmero atmico, nmero msico 3.b.- Istopos 3.c.- Isbaros 3.d.- Iones 3.e.- Para que practiques solo/a 4- Magnitudes atmico-moleculares 4.a.- Masa atmica 4.b.- Masa molecular 4.c.- El concepto de mol masa molar 4.d.- Volumen molar y volumen molar normal 4.e.- Problemas resueltos 4.f.- Para que practiques solo/a 5 Configuracin electrnica y tabla peridica 5.a.- Configuracin electrnica 5.b.- Tabla peridica de los elementos 5.c.- Para que practiques solo/a 6 Para saber un poco ms 7 - Solucionario
ARTICULACIN QUMICA - MDULO III Teora
1.- INTRODUCCIN
Retomando el mdulo 1: El mundo que nos rodea. En el primer mdulo, hemos mencionado los modelos cientficos que usa la ciencia; y mostramos los distintos modelos atmicos. En este mdulo desarrollaremos sintticamente cada uno, para introducirlos al conocimiento de la estructura de la materia. La qumica es una ciencia experimental que se basa en el estudio de las reacciones, de las cuales se obtiene informacin cualitativa y cuantitativa. La primera nos indica la clase de sustancias que participan (tanto reactivos como productos). En cambio, la informacin cuantitativa est relacionada con la cantidad (masa, volumen, n de partculas, etc.) de las sustancias (tomos, molculas e iones) que entran en juego. En este mdulo, conocers las magnitudes atmicas y moleculares que te permitirn resolver problemas numricos y conceptuales relacionados con la qumica cuantitativa. El contenido de este mdulo te ayudar a vincular nuevos conceptos con los anteriores, comprenderlos y poder aplicarlos. Composicin de la materia. Haciendo un poco de historia
John Dalton (ingls, 1766-1844)
Ernest Rutherford (neozelands, 1871-1937)
Demcrito (griego, 460 a.C.)
Desde tiempos remotos, el hombre se ha visto impulsado a examinar y a tratar de descubrir la estructura de la materia y comprender todos los fenmenos que se relacionan con ella. Entre los siglos VI y V a.C. los filsofos Leucipo y Demcrito concibieron la materia como discontinua, suponindola formada por pequeas partculas indestructibles a las que llamaron TOMOS, que significa indivisible o inseparable (del griego, a: privativo tomo: cortar o dividir). Para Demcrito haba un tipo de tomo diferente para cada sustancia y cada uno tena un peso caracterstico, distinto del tomo de otra sustancia. El concepto de tomo le permiti interpretar fenmenos cotidianos como la evaporacin y la difusin entre otros. Tiempo despus Platn y Aristteles (dos grandes filsofos griegos) negaron las ideas atomistas de Demcrito, lo que llev a olvidar este modelo de la estructura de la materia durante dos mil aos. En la revolucin cientfica del siglo XVII, Galileo Galilei (italiano, 1564-1642), Francis Bacon (ingls, 15611626), Isaac Newton (ingls, 1643-1727) y Robert Boyle (irlands, 1627-1691), retoman nuevamente la concepcin atomista.
ARTICULACIN QUMICA - MDULO III Teora
2.- EVOLUCIN DE LA TEORA ATMICA
2.a.- Teora atmica de Dalton
En el siglo XIX, con John Dalton, comenzaron a surgir las nuevas ideas acerca de la composicin de la materia, cuando propuso la teora atmica y revolucion el incipiente mundo de la qumica. En el libro Un nuevo sistema de filosofa qumica (1808), Dalton expuso su teora atmica. El mrito de este autor fue el de incorporar al mundo fsico un concepto filosfico, como el de tomo. Dalton y Antoine Laurent Lavoisier (francs,1743-1794) son considerados los fundadores de la Qumica moderna. La teora atmica de Dalton se fundament en diversos hechos experimentales y puede resumirse en los siguientes postulados: 1. Los elementos estn formados por partculas muy pequeas llamadas tomos. Los tomos de un mismo elemento son idnticos entre s y los de distintos elementos son diferentes. 2. Los compuestos estn formados por tomos de ms de un elemento. En cualquier compuesto la relacin entre el nmero de tomos de cualquier par de elementos presentes es un nmero entero o se puede expresar como una fraccin simple. 3. Una reaccin qumica implica solo una separacin, combinacin o nueva disposicin de tomos, pero stos no se crean ni se destruyen. El concepto de tomo de Dalton es ms detallado y especfico que el concepto de tomo indivisible de Demcrito, como lo explican los postulados anteriores. Esta idea tuvo validez menos de un siglo ya que nuevos hechos experimentales contribuyeron al desarrollo de la teora atmica moderna.
2.b.- Teora atmica moderna
Las experiencias que ampliaron el desarrollo de la teora atmica postulada por John Dalton, dieron origen a los siguientes modelos atmicos: 1. El descubrimiento de la naturaleza elctrica de la materia y de la naturaleza del electrn (1900). Modelo atmico de Thomson En 1833 Michael Faraday (ingls, 1791-1867) realiz la electrlisis del agua que consista en hacer pasar una corriente elctrica a travs de una solucin acuosa, en la cual se produca una reaccin qumica y el resultado de esta experiencia fue la clave ms importante para interpretar y entender la naturaleza elctrica de los tomos. Este fsico concluy diciendo que Los tomos de materia estn de alguna manera dotados o asociados con poderes elctricos a los que les deben sus cualidades ms llamativas. En 1874, George Johnstone Stoney (irlands, 1826-1911) reconoci el contenido de los experimentos de Faraday, y fue el primero que propuso el trmino electrn para describir la unidad fundamental de la carga elctrica. Pero hasta 1897, no se encontr ninguna evidencia sobre la existencia y propiedades de dicha partcula. En ese ao, Joseph John Thomson realizando experiencias en tubos de descarga descubri que las partculas que constituan los rayos catdicos tenan carga elctrica negativa. Aos ms tarde las llam ELECTRONES, cuya naturaleza no depende del gas ni del material del electrodo, por consiguiente se tratara de una partcula constituyente de toda la materia. La televisin es un ejemplo de ello, ya que est compuesta por un tubo de rayos catdicos cuyos rayos se bombardean sobre una pantalla. Thomson encontr que la masa del electrn es muy pequea con respecto a la del tomo y de carga negativa y pudo medir la relacin carga y masa del electrn.
ARTICULACIN QUMICA - MDULO III Teora Las experiencias realizadas en tubos de descarga permiten llegar a la conclusin de que los rayos catdicos son electrones, es decir, fragmentos corpusculares del tomo, y no tomos electrificados. Robert Andrews Millikan (estadounidense, 1868-1953) determin en 1913 la carga del electrn con la experiencia de la gota de aceite. Aos mas tarde, los cientficos pensaron en un modelo electrnico del tomo constituido por partculas negativas (electrones) y predijeron la existencia de partculas positivas ya que la materia es elctricamente neutra (no tiene carga elctrica neta, por lo tanto, debe haber igual nmero de cargas positivas y negativas). Realizando experiencias nuevamente en tubos de rayos catdicos, Eugen Goldstein (alemn, 1850 - 1930), descubri una corriente de partculas positivas a las que denomin rayos canales, luego los llam PROTONES. Para ello realiz la siguiente experiencia: coloc un ctodo agujereado, mientras las partculas negativas eran atradas por el nodo, las cargadas positivamente eran atradas por el ctodo; esto explicaba la luminosidad que apareca detrs del ctodo. La experiencia realizada se muestra en el siguiente grfico.
(+)
(-)
a) Los electrones viajan del ctodo hacia el nodo.
b)
Los iones positivos viajan hacia el ctodo o electrodo negativo.
c)
Como el ctodo est conectado a una placa agujereada, algunas partculas positivas atraviesan dicha placa y forman los rayos canales que se detectan en la pared del tubo como un brillo tenue.
De esta manera, se consideraba al tomo formado por partculas positivas y negativas; la dificultad consista en saber como estaban distribuidas las mismas. A partir de estos experimentos surgi el modelo atmico de Thomson, llamado de uvas en gelatina o budn de pasas, un modelo de tomo compacto.
Modelo atmico de Thomson (1903)
ARTICULACIN QUMICA - MDULO III Teora
2. El tomo est constituido por un ncleo positivo rodeado de electrones (1911). Modelo atmico de Rutherford En 1910, Ernest Rutherford utilizando el fenmeno de la radiactividad en sus investigaciones, hizo incidir partculas alfa (, masa y carga similar a los ncleos de los tomos de helio, 42He2+) sobre una lmina delgada de oro y observ con gran sorpresa que la mayora de ellas pasaban a travs de la lmina, mientras que slo algunas se desviaban e incluso regresaban hacia la fuente emisora por la misma trayectoria (como se muestra en a). Esto permiti refutar el modelo de Thomson (tomo compacto) ya que la carga positiva del tomo era muy difusa . Esta experiencia sirvi para demostrar cmo estn distribuidas las partculas elctricas dentro del tomo. Adems constituy una etapa decisiva en el conocimiento del mismo. A partir de esto, Rutherford postul que la carga positiva del tomo est concentrada en un punto llamado ncleo. Cuando una partcula alfa se acerca al ncleo, acta una fuerza de repulsin (cargas del mismo signo se repelen) y sufre una gran desviacin por tener carga del mismo signo. Supuso entonces, que la mayor parte de un tomo debe ser espacio vaco ya que la mayora de las partculas pasaron a travs de la lmina de oro con muy poca o ninguna desviacin (como se muestra en b).
Rutherford concluy diciendo que la mayor parte de la masa del tomo se encuentra concentrada en el ncleo, donde se ubican las partculas positivas. El radio del ncleo es 10.000 veces ms pequeo que el radio atmico. Dado que los tomos son neutros, cada tomo deber tener igual nmero de cargas positivas y negativas para mantener la electroneutralidad. Los electrones se encuentran a gran distancia del ncleo. La masa del electrn es despreciable (o sea, insignificante, muy pequea) con respecto a la masa del ncleo.
ARTICULACIN QUMICA - MDULO III Teora
Dimensiones aproximadas de radio atmico y radio del ncleo 10-8 el radio atmico 10-12 el radio del ncleo atmico
El modelo de Rutherford era semejante al sistema planetario y totalmente diferente al modelo compacto de Thomson.
1911- Modelo de Rutherford
Por qu se cambi este modelo? Se dej de lado este modelo porque era incompatible con los conocimientos (bien corroborados) que existan en ese momento sobre electricidad. Toda carga elctrica en movimiento, emite energa. Por lo tanto, si los electrones se movan alrededor de un ncleo positivo, y perdan energa continuamente, terminaran chocando contra el ncleo. Es decir, a medida que el electrn perda energa, la atraccin que ejerca el ncleo (con carga de signo contrario) aumentaba.
Como esto no ocurre en la realidad, ya que si no, no existira la materia, el modelo propuesto debe estar equivocado. 3. Las ecuaciones de la mecnica cuntica explican el comportamiento de los electrones en los tomos (1925). Modelo atmico de Bohr y modelo atmico actual Modelo atmico de Bohr Los fsicos saban que los tomos estaban formados por protones y electrones y que estos ltimos giraban alrededor del ncleo a altas velocidades en rbitas circulares. Niels Bohr (dans, 1885-1962) propuso un modelo atmico que permita explicar el movimiento de los electrones sin caer dentro del ncleo. Las bases del modelo de Bohr fueron las siguientes: Los electrones en los tomos solo presentan ciertos estados energticos estables. As, no cualquier rbita
del modelo planetario estara permitida para el electrn.
ARTICULACIN QUMICA - MDULO III Teora
Los electrones son partculas cargadas, pero no emiten radiacin en su viaje alrededor de ncleo, sino solamente cuando cambia el radio de su rbita.
1913 Modelo de Bohr o de Rutherford-Bohr
Cuando todos los electrones de un tomo se encuentran en su estado de mnima energa, se dice que el tomo est en estado fundamental. Y los electrones ocupan los niveles energticos ms cercanos al ncleo. Cuando un electrn absorbe energa, se aleja del ncleo; salta a niveles de mayor valor energtico. Este estado es slo temporal y el electrn libera esa energa absorbida en forma de luz, regresando al nivel del que parti. El color de la luz emitida depende de la cantidad de energa liberada. Un tomo se dice que est en estado excitado cuando uno o ms electrones (a los que les correspondera estar en un determinado nivel, por ejemplo, 1 2 3) absorbieron energa y saltaron a un nivel de energa superior.
Modelo atmico actual El modelo atmico de Bohr se ajustaba muy bien a los espectros, observados en el tomo de hidrgeno, pero no poda explicar las caractersticas de los tomos con mayor nmero de electrones. En 1900 Max Karl Planck (alemn, 1858-1947), creador de la teora cuntica, explic que la energa se radia en unidades pequeas separadas, denominadas cuantos. As se inicia para la fsica la etapa conocida como mecnica cuntica y proporciona los cimientos para la investigacin en lo referente a la energa atmica. Los tomos absorben o emiten luz de distintas longitudes de onda, los experimentos espectrales indicaban que la energa de los electrones no podan tomar cualquier valor; Plank, explicaba por qu los cuerpos calientes emitan radiacin electromagntica y lleg a la siguiente conclusin: los electrones slo absorben o emiten luz en pequeos paquetes de energa (cuantos de energa, deriva del latn quantum, que significa cantidad elemental). Surge as el nombre de teora cuntica o teora de los cuantos. Plank calcul que la mnima cantidad de energa luminosa que puede absorber o emitir un cuerpo depende de la frecuencia de la luz que emite o absorbe La frmula que interpreta este hecho es la siguiente:
10
ARTICULACIN QUMICA - MDULO III Teora
E = h .v
E= energa de un cuanto h= constante de Planck v= frecuencia de la radiacin medida en oscilaciones por segundo Las ecuaciones de la mecnica cuntica introducen cuatro nmeros cunticos que describen los estados de energa posible para los electrones y por lo tanto, la probabilidad de encontrarlos en una zona del espacio alrededor del ncleo atmico. A esta regin del espacio donde es probable encontrar al electrn, se la llama
orbital.
n= nmero cuntico principal l= nmero cuntico secundario m= nmero cuntico magntico s= nmero cuntico spin
Si pudiramos fotografiar al electrn de un tomo en un instante dado y tomsemos varias fotografas sucesivas, observaramos al superponerlas que las posiciones del electrn nos dan una imagen de nube electrnica difusa, sin lmites definidos, que nos indica que el electrn no gira en rbitas determinadas y slo podemos encontrar al mismo en el orbital. En las siguientes figuras, se observa lo explicado: Ubicacin de un electrn en el tomo
11
ARTICULACIN QUMICA - MDULO III Teora
3.- ESTRUCTURA ATMICA
El modelo actual del tomo postula que ste se encuentra formado por tres partculas fundamentales: protones, neutrones y electrones. Los protones y los neutrones, a su vez, estn formados por partculas ms pequeas denominadas quarks. En la zona central o ncleo se encuentran los protones y neutrones. La masa de los protones y los neutrones es similar. Los protones poseen carga positiva (+) y los neutrones carecen de carga elctrica. Los electrones se encuentran en continuo movimiento en una zona, alrededor del ncleo, llamada nube extranuclear. Tienen carga negativa y su masa es 1840 veces menor que la de los protones. Esto se sintetiza en el siguiente cuadro:
tomo
formado por
ncleo protones masa 1 carga (+) neutrones masa 1 carga 0
nube extranuclear electrones masa 1 1840 carga (-)
3.a.-Nmero atmico, nmero msico
En la tabla peridica los elementos se encuentran ordenados de acuerdo con un nmero creciente, ese nmero recibe el nombre de nmero atmico o nmero de orden y se representa con la letra Z. Identifica a los distintos elementos. Este nmero indica la cantidad de protones que un tomo de un elemento tiene en su ncleo. Por lo tanto, en los tomos (ya que son elctricamente neutros) ese nmero indica tambin la cantidad de electrones. En el ncleo adems de protones hay neutrones. La suma del nmero de protones y neutrones recibe el nombre de nmero msico y se simboliza con la letra A. La forma aceptada para anotar el nmero atmico y el nmero de masa (msico) de un elemento X es la siguiente:
Nmero de masa = Nmero de protones + Nmero de neutrones A = Z + Nmero de protones El nmero de neutrones se puede calcular as: N de neutrones = A - Z
12
ARTICULACIN QUMICA - MDULO III Teora
3.b.-Istopos
Se llaman as a los tomos que tienen el mismo nmero atmico pero diferente nmero de masa. Por lo tanto, podemos decir que por tener el mismo Z, pertenecen al mismo elemento pero se diferencian en el nmero de neutrones. Del hidrgeno se conocen estos tres istopos...
Propio 1p+ 1e-
Deuterio 1p+ 1e- 1n
Tritio 1p+ 1e- 2n
El agua pesada que se utiliza en los reactores nucleares lleva ese nombre porque la molcula de agua est formada por un istopo pesado del hidrgeno, el deuterio. Su frmula suele escribirse, D2O. En medicina se utilizan radioistopos (istopos radiactivos), como por ejemplo el Co-60, para la destruccin de tumores y otros en el estudio del funcionamiento de ciertas glndulas. El carbono-14 (istopo radiactivo del C) se utiliza para determinar la antigedad de objetos (datacin); siendo muy til en investigaciones arqueolgicas, antropolgicas o paleontolgicas.
3.c.-Isbaros
Son tomos que tienen el mismo nmero msico y distinto nmero atmico. Por lo tanto, pertenecen a distintos elementos (por tener distinto nmero atmico). Ejemplo:
3.d.-Iones
Los iones son partculas con carga elctrica. Es decir que el nmero de protones no es igual al nmero de electrones. Esto puede deberse a una prdida o ganancia de electrones. Si un tomo pierde electrones, se transforma en ion positivo llamado catin, y queda con tantas cargas positivas como electrones haya perdido. Si un tomo gana electrones, se transforma en in negativo llamado anin, y queda con tantas cargas negativas como electrones haya ganado. Veamos los siguientes ejemplos:
13
ARTICULACIN QUMICA - MDULO III Teora Na Na+ + 1e-
El tomo de Na es neutro y cuando pierde un electrn se transforma en catin Na+. Cl + 1 eCl-
En este caso el tomo de cloro neutro gana un electrn y se transforma en anin cloruro.
Record que siempre son los electrones los que se ganan o pierden y no los protones. La modificacin en el nmero de protones en un tomo significa la transformacin de un elemento en otro. Esto ocurre durante las reacciones nucleares, en las estrellas, en los reactores nucleares o durante una explosin atmica.
En el cuadro se indica la composicin atmica del catin sodio y del anin fosfuro
11 protones 12 neutrones 10 electrones
15 protones 16 neutrones 18 electrones
4.- MAGNITUDES ATMICO-MOLECULARES
En la introduccin de este mdulo dijimos que la qumica es una ciencia cuantitativa. Esto es porque estudia las relaciones de masas entre los tomos, iones o molculas que participan en los procesos fisicoqumicos. Al observar una muestra de agua, un alambre de cobre o un trozo de metal, no podemos ver los tomos o las molculas que componen cada una de estas sustancias. Las partculas que las forman son infinitamente pequeas y nos resultara muy difcil medir su tamao y su masa. En el siguiente cuadro pods observar la masa y carga de cada partcula subatmica.
Partcula Electrn Protn Neutrn
Masa (g) 9.1095.10-28 1,67252.10-24 1,67495.10-24
Carga en coulomb -1,6022.10-19 +1,6022.10-19 0
Carga Unitaria -1 +1 0
Las masas de los tomos son muy pequeas comparadas con las masas que se manejan habitualmente. Esto hace imposible medirlas con las balanzas convencionales y en las unidades habituales como kg, g e incluso mg que resultan demasiado grandes para que sean de utilidad. Observando en el cuadro anterior, la masa de un protn, un electrn y un neutrn expresados en gramos, podemos decir que son poco prcticas para indicar la
14
ARTICULACIN QUMICA - MDULO III Teora masa de un elemento dado. Si quisiramos indicar en gramos la masa del uranio (elemento ms pesado que contiene la corteza terrestre), obtendramos un valor de 3,9.10-22 g. Uranio Z: 92 A: 238
1p+ 238 *
1,67.10-24g X
X=
1,67.10-24 . 238 1
= 3,97.10-22g
*238 partculas que hay dentro del ncleo (protones y neutrones) considerando que los valores de ambas son iguales.
Si los tomos son tan pequeos, cmo se puede determinar su masa?
No es posible pesar un solo tomo, pero existen mtodos experimentales a partir de los cuales se puede determinar la masa de un tomo en relacin con la de otro. El primer paso consiste en asignar un valor a la masa de un tomo de un elemento dado, de tal forma que se pueda utilizar como PATRN. En las masas de protn, neutrn y electrn se requiere escribir frecuentemente factores de 10-21 cuando las expresamos en gramos. Debido a esta dificultad, Dalton sugiri tomar la masa del tomo de hidrgeno como unidad para expresar la masa de los tomos de los otros elementos. Dndole el valor 1, a la masa del tomo de H (que es el elemento ms liviano), resultaban valores superiores a la unidad para la masa de tomos de los elementos restantes. Con el correr del tiempo se presentaron dificultades que hicieron modificar el elemento tomado como unidad (patrn) para comparar la masa de los otros elementos. Fue en 1961 que se eligi como patrn de referencia al istopo ms abundante del carbono asignando a su masa un valor de doce unidades de masa atmica (uma). La uma se representa simplemente con la letra u.
12
Por definicin, la u es la 1/12 parte de la masa de un tomo de
C.
1u=
Masa de un tomo de carbono(12C) 12
= 1,66.10-24 g
Como el ncleo de este istopo presenta doce partculas en total, de las cuales seis son protones y seis neutrones, y adems la masa de estas partculas son similares, podra decirse que la masa de 1 u es aproximadamente igual a la de un protn o un neutrn y vale:
15
ARTICULACIN QUMICA - MDULO III Teora
1 u = 1,66. 10-24 g
Calculemos la masa de un tomo de hidrgeno expresada en u: 1,66.10-24 g 1,67.10-24 g * 1u 1,006 u (aprox. 1 u)
* 1,67.10-24 g es el equivalente a la masa de un tomo de hidrgeno en gramos
4.a.- Masa atmica
Si en lugar de expresar los valores en gramos de la masa atmica, se utiliza esta unidad como referencia, se puede hablar de masa atmica relativa (Ar). Debemos aclarar que no es la masa de un tomo en particular, sino el promedio de la masa de los distintos istopos que se encuentran en la naturaleza, y deberamos denominarla masa atmica promedio, aunque se utiliza masa atmica. As, la masa atmica del oxgeno es 15,994, es decir que un tomo de oxgeno es 15,9994 veces ms pesado que 1 u.
4.b.- Masa molecular (Mr)
Si hacemos referencia a una sustancia formada por molculas, hablamos de la Masa molecular relativa (Mr). Esta magnitud es un nmero abstracto que indica cuntas veces es mayor la masa de una molcula con respecto a la u; se sigue utilizando la misma unidad. Se puede calcular la masa molecular (Mr) de la siguiente manera:
Agua:
Mragua = 2. ArH + ArO Mragua = 2. 1 + 16 = 18
Molcula de agua formada por 2 tomos de hidrgeno
+
1 tomo de oxgeno
16
ARTICULACIN QUMICA - MDULO III Teora
Dixido de carbono:
Molcula de dixido de carbono
Mrco2 = Arc + 2 ArO Mrco2 = 12 + 2 .16 = 44
formada por 2 tomos de oxgeno
+
1 tomo de carbono
Como vimos en los ejemplos anteriores para obtener la masa molecular se procede de la siguiente manera: La masa molecular relativa es un nmero sin unidades, que se obtiene al multiplicar cada masa atmica del elemento que interviene en la frmula por su subndice y, luego, sumar dichos productos.
4.c.- El concepto de mol masa molar
Tanto en nuestra vida diaria como en el laboratorio usamos muestras de sustancias que contienen enorme cantidad de tomos, molculas o iones. Como ya dijimos, estas partculas tienen masas muy pequeas y no existen balanzas que puedan pesarlas en forma individual. Por lo tanto, es conveniente utilizar una unidad especial que sirva para describir una cantidad de tomos muy grande. Podemos citar varios ejemplos que te servirn para entender esta unidad: 1 decena ----1 docena ---10 unidades 12 unidades 1 centena ----- 100 unidades 1 millar --1000 unidades
Utilizamos estas unidades para indicar una cantidad determinada de objetos. Por ejemplo, si decimos una docena de lpices o una docena de sandas, nos referimos a 12 unidades de cada uno de esos objetos. En qumica la unidad que se utiliza es el MOL. Un mol es la cantidad de sustancia que contiene tantas partculas elementales (tomos, molculas, iones, electrones, etc.) como tomos hay exactamente en 12 g de 12C. El valor aceptado es: 1 mol => (contiene) 6,022045.1023 partculas. Aunque lo usamos redondendolo a 6,02.1023. Esta cifra se llama constante (o nmero) de Avogadro en honor al cientfico italiano Amadeo Avogadro (17761856). 1 mol de tomos de 12C tiene una masa de 12 g y contiene 6,02.1023 tomos.
17
ARTICULACIN QUMICA - MDULO III Teora
Masa molar
Es la masa de un mol de una sustancia. Es numricamente igual al Mr (o Ar), pero lleva unidad, gramos. Por lo tanto, la masa molar del C es 12 g. Esta masa de C contiene 6,02.1023 tomos de C.
Ar K = 39 Mr H2O = 18
Masa molar = 39 g-Masa molar = 18 g --
contiene 6,02.1023 tomos de C contiene 6,02.1023molculas de H2O
Un mol de iones K+ contiene 6,02.1023 iones K+. Un mol de molculas de agua contiene 6,02.1023 molculas de agua. La forma prctica de calcular la masa de un mol de tomos o un mol de molculas es a partir de las masas atmicas (Ar) y masas moleculares (Mr). Por ejemplo... La masa atmica (Ar) del sodio es 23, por lo tanto, la masa de un mol de tomos de Na es igual a 23 g. Conociendo este valor es posible calcular la masa en gramos de un solo tomo de cualquier elemento, como por ejemplo, del 23Na. Sabemos que... 6,02 . 1023 tomos de Na 1 tomo de Na x= 1 tomo de Na . 23 g
23
23 g x = 3,82.10-23g
6,02 . 10 tomos de Na De la misma manera podemos calcular la masa en gramos de una sola molcula de cualquier sustancia, como por ejemplo: La Ar del oxgeno es 16, la Mr de dicho elemento es 32. Por lo tanto, un mol de molculas de oxgeno tiene una masa de 32 gramos. 6,02 . 1023 molculas de oxgeno 1 molcula de oxgeno 32 g
x = 5,315.10-23g
x=
1 molcula de O2 . 32 g 6,02 . 10
23
molculas de O2
18
ARTICULACIN QUMICA - MDULO III Teora
18 g de agua 1 mol de molculas 6,02.1023 molculas
342 g de azcar 1 mol de molculas 6,02.1023 molculas
56 g de hierro 1 mol de tomos 6,02.1023 tomos
Record: Si se sabe la masa atmica (Ar) de un elemento, tambin se conoce su masa molar (M). Si se conoce la masa molecular (Mr) de una sustancia, se sabe su masa molar (M).
4.d.- Volumen molar y volumen molar normal
Se llama volumen molar de una sustancia gaseosa (a una cierta presin y temperatura) al volumen que ocupa un mol de dicho gas en esas condiciones de presin y temperatura. De acuerdo con la hiptesis formulada por Avogadro: Volmenes iguales, de gases cualesquiera, en iguales condiciones de presin y temperatura, contienen igual nmero de molculas. Como en 1 mol de sustancia hay 6,02.1023 molculas, podemos afirmar que: 6,02.1023 molculas de O2 6,02.1023 molculas de N2 6,02.1023 molculas de H2 6,02.1023 molculas de CO2 tienen el mismo volumen
El volumen correspondiente a ese nmero de molculas es el mismo, siempre que los gases se encuentren en las mismas condiciones de presin y temperatura y admitiendo para dichos gases un comportamiento ideal en esas condiciones. Cuando el volumen molar se mide en condiciones normales de presin y temperatura (CNPT), es decir: 1 atm (760 mm de Hg y 273 K, 0 C), lo denomina volumen molar normal y es igual a 22,4 litros dm3.
Ejemplos
Una masa de gas desconocido ocupa un volumen de 50 dm 3, en CNPT, cuntas molculas contiene? Sabemos que en 22,4 dm3 de gas existen 6.02.1023molculas por ser el volumen de un mol en CNPT, por lo tanto, para saber el nmero de molculas que hay en 50 dm3, se procede de la siguiente manera:
19
ARTICULACIN QUMICA - MDULO III Teora
22,4 dm3------------ 6,02.1023 molculas 50 dm3 --------------x x=
------------------------------------------------------------------=
50 dm3 . 6.02.1023 molculas 22,4 dm
3
1,3437.1024 molculas
Si quisiramos saber el nmero de moles que existen: 6,02.1023 molculas------------------1 mol 1,3437.10 24 molculas------------x 1,3437.1024 molculas .1mol x = -------------------------------------------= 2,23 moles 6,02.1023 molculas
4.e.- Problemas resueltos
Con los contenidos tericos vistos, ests en condiciones de resolver las siguientes actividades. Resolucin de problemas relacionados con los conceptos de masa atmica y mol de tomos Datos: Masa atmica de los elementos de la tabla peridica. Nmero de Avogadro: 6,02.1023 I-Una muestra de azufre (S) tiene una masa de 10 g y se quiere saber: a. Cuntos moles de tomos se encuentran en la muestra? b. Cuntos tomos de este elemento contiene? Solucin: Teniendo en cuenta que la masa atmica de azufre es de 32, se puede realizar el siguiente clculo: a) Si tomamos una masa numricamente igual a su masa atmica expresada en gramos, tendremos: 32g 10g x= 1mol x 10g. 1mol tomos 32g = 0,3125 moles de tomos de S
b) Sabemos que en un mol de tomos, hay 6,02.1023 tomos de S; podemos calcular la cantidad de tomos que hay en 0,3125 moles de tomos de azufre de la siguiente manera: 1mol de tomos 0,3125 moles de tomos 6,02.1023 tomos x
20
ARTICULACIN QUMICA - MDULO III Teora
x=
0,3125moles de tomos . 6,02.1023 tomos 1 mol de tomos
=1,88.1023 tomos de S.
II- Una muestra de nitrgeno gaseoso tiene 4,63.1022 tomos. a. Cuntos moles de tomos de N hay? b. Cul es la masa en gramos de 1 tomo de N? a) 6,02.1023 tomos 4,63.1022 tomos 1 mol de tomos de N x
X=
4,63.1022 tomos . 1mol de tomos 6,02.1023 tomos
= 0,0769 moles de tomos de N
b)
6,02.1023 tomos 1 tomo x= 1 tomo . 14g 6,02.10
23
14g x = 2,32.10-23g.
tomos
Resolucin de problemas relacionados con el concepto de masa molecular de una sustancia y masa molar.
Record: Las sustancias pueden estar formadas por tomos, molculas o iones; en este caso resolvers ejercicios que tienen que ver con molculas que forman sustancias. Las frmulas moleculares que usaremos en los ejercitacin estn escritas para que no tengas dificultad y puedas resolverlos (en el mdulo IV aprenders a escribir dichas frmulas). En el mdulo I se explic el concepto de frmula molecular, record que es un conjunto de smbolos con subndices que indica qu clase de elementos interviene y cuntos tomos de cada elemento hay en dicha frmula.
I. En a. b. c. un recipiente cerrado se encuentra una masa de oxgeno gaseoso igual a 50g. Se quieren saber: Cuntos moles de molculas de oxgeno hay? A cuntas molculas de oxgeno corresponde? Cuntos tomos del mismo elemento se pueden encontrar?
21
ARTICULACIN QUMICA - MDULO III Teora
Solucin:
a) Sabemos que la masa atmica del oxgeno es igual a 16 (Ar: 16). El oxgeno es una sustancia simple y sus molculas estn formadas por dos tomos iguales, por lo tanto, para obtener el valor de su masa molecular, se procede de la siguiente manera: Mr O2 = 2 . Ar O2 Mr O2 = 2 . 16 = 32 Si tomamos una masa numricamente igual a su Mr, como es masa, lo medimos en gramos, tendremos 32g que corresponden a la masa de 1 mol de molculas, por lo tanto: 32g 50g X= 1 mol de molculas de O2 x 50g . 1 mol de molculas de O2 32g a. Sabemos que: 1 mol de molculas 1,56 moles de molculas X= 6,02.1023 molculas x = 9,40.1023 molculas = 1,56 moles de molculas de O2
1,56 moles de molculas . 6,02.1023 molculas 1 mol de molculas de O
b) . Sabiendo que la molcula de oxigeno es diatmica: 1 molcula de O2 9,40.1023 molculas X= 2 tomos de O x = 18,80.1023 tomos de O
9,40.1023 molculas . 2 tomos de O 1 mol de molculas de O
En notacin cientfica es conveniente dejar un nmero entero, por lo tanto, si dividimos por 10 y multiplicamos por 10 no vara el resultado y expresamos el mismo de la siguiente manera: 18,80.1023 . 10 10 = 1,88.1024 tomos de oxgeno
22
ARTICULACIN QUMICA - MDULO III Teora Un recipiente contiene 20 moles de molculas de agua. Se desea saber: d. Cuntos gramos de agua se encuentran en la muestra? e. Cuntas molculas? f. Cuntos moles de tomos de oxgeno y cuntos tomos? g. Cuntos moles de tomos de hidrgeno? Resolucin: a) Se debe calcular la masa molecular del agua. Mr H2O = 2 . ArH + Ar0 Mr H2O = 2 . 1 + 16 Mr H2O = 18 1 mol de molculas 20 moles de molculas X= 20 moles de molculas . 18 g 1 mol de molculas 18g X = 360 g II.
El recipiente contiene 360 gramos. b) Calcular en nmero de molculas. 1 mol de molculas 20 moles de molculas X= 20 moles de molculas . 6,02.1023 1 mol de molculas 6,02.1023 molculas X = 12,12.1023 molculas
12,12 . 1023 . 10 = 1,212.1024 molculas 10 Siempre conviene trabajar con los datos del problema y no con los resultados obtenidos. c) Primero calculamos el nmero de moles de tomos de O.
1 molcula de H2O est formada por
2 tomos de H
1 tomo de O
Si en lugar de trabajar con molculas, nos referimos a moles de molculas, podrs ver en el siguiente cuadro dnde se utiliza el concepto de mol de tomos.
23
ARTICULACIN QUMICA - MDULO III Teora
1 mol de molculas de H2O est formado por
2 moles de tomos de H
1 mol de tomos de O
1 mol de molculas de H2O 20 moles de molculas de H2O
1 mol de tomos de O X
X=
20 moles de molculas de H2O. 1 mol de tomos de O 1 mol de molculas de H2O
= 20 moles de tomos de O
Luego calculamos el nmero de tomos de O. 1 mol de tomos de O 20 moles de tomos de O 6,02.1023 tomos de O X
X=
20 moles de tomos de O. 6,02.1023 tomos de O 1 mol de tomos de O
= 1,212.1024 tomos de O
d) Calculemos el nmero de moles de tomos de H. Como la cantidad de tomos de H es el doble por cada molcula de H2O, obtendremos: 1 mol de molculas de H2O 20 moles de molculas de H2O 2 moles de tomos de H X
X=
20 moles de molculas de H2O . 2 moles de tomos de H 1 mol de molculas de H2O
= 40 moles de tomos de H
24
ARTICULACIN QUMICA - MDULO III Teora En el mdulo II (tema soluciones) se aplica el concepto de molalidad y molaridad. Con lo estudiado en este mdulo ests en condiciones de resolver los problemas de aplicacin. Molaridad: Es la concentracin de una solucin expresada en moles de soluto por litro de solucin o moles de soluto por dm3 de solucin Molalidad: Es la concentracin de una solucin expresada en moles de soluto por Kg de disolvente.
--------------------------------------------------------------------------------------------------------------------------
5.-CONFIGURACIN ELECTRNICA Y TABLA PERIDICA
5.a.- Configuracin electrnica
La configuracin electrnica de un tomo indica como estn distribuidos los electrones alrededor del ncleo.
Nmeros cunticos
Los electrones se encuentran movindose alrededor del ncleo atmico, en la llamada nube o zona extranuclear. Su distribucin en este espacio, no se da de cualquier manera, sino en determinados niveles y subniveles y est ntimamente relacionada con muchas propiedades de los tomos. A partir de la resolucin de las llamadas ecuaciones de onda (cuyo estudio excede este curso), se determinan tres de los cuatro nmeros cunticos que se usan para caracterizar los electrones de un tomo. Estos nmeros cunticos son los siguientes:
n: nmero cuntico principal: indica el nivel de energa al que pertenece el electrn y se encuentra relacionado con la distancia promedio al ncleo. Toma valores desde 1 hasta infinito. l: nmero cuntico secundario: indica el subnivel de energa al que pertenece el electrn y describe la forma de la nube electrnica. Sus valores dependen de los n, partiendo de 0 toma todos los valores posibles hasta (n 1), pero generalmente se representa por medio de letras, as cuando l vale:
0 se le asigna la letra s 1 se le asigna la letra p 2 se le asigna la letra d 3 se le asigna la letra f
m: nmero cuntico magntico: indica la orientacin de la nube electrnica. Determina el orbital al que pertenece el electrn. Puede tomar valores desde 1 hasta +1. s: nmero cuntico spin: indica el sentido de rotacin del electrn sobre s mismo respecto a un eje
imaginario. Este giro puede ser en sentido horario o antihorario y, por lo tanto, slo existen dos valores, uno negativo y otro positivo. Como adems, la probabilidad de que tome uno u otro valor es la misma, dichos valores son + y .
25
ARTICULACIN QUMICA - MDULO III Teora A continuacin se dan los posibles valores para los primeros nmeros cunticos.
n
1 2
l
0 0 1
m
0 0 -1 0 +1 0 -1 0 +1 -2 -1 0 +1 +2 0 -1 0 +1 -2 -1 0 +1 +2 -3 -2 -1 0 +1 +2 +3
s
+1/2 1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2 +1/2 ; -1/2
3 3 3
0 1 2
4 4 4
0 1 2
Las ecuaciones que permiten hallar los valores de los nmeros cunticos, slo se han resuelto en forma completa para el tomo de hidrgeno. Las configuraciones electrnicas de los dems elementos se construyen a partir del que les precede, teniendo en cuenta ciertos criterios, que bsicamente pueden resumirse de la siguiente manera: Los electrones no excitados ocupan los niveles y subniveles de menor energa disponibles. No pueden asignarse los mismos valores para los cuatro nmeros cunticos de dos electrones, de un mismo tomo, lo que significa que no puede haber ms de dos electrones en un mismo orbital. Los dos electrones que ocupan el mismo orbital deben diferenciarse en su spin.
26
ARTICULACIN QUMICA - MDULO III Teora
5.b.-Tabla peridica de los elementos
En el siglo XIX los qumicos tenan una idea vaga de los tomos y molculas y no conocan como estaban formados los tomos. Las primeras tablas peridicas fueron construidas usando como base las estimaciones hechas sobre los pesos atmicos (ahora se denomina masa atmica). John A. Newlands (britnico, 1837-1898), orden los elementos de acuerdo con sus pesos atmicos, y vio que cada ocho elementos se repetan las propiedades. Por ejemplo, el octavo elemento, tena propiedades similares al primero; el segundo al noveno y as sucesivamente. Las octavas de Newlands, parecan indicar una relacin entre los elementos similar a la que se da entre las notas musicales. Este ordenamiento result inadecuado para aquellos elementos que tenan peso atmico mayor que el del calcio y esta investigacin no fue aceptada por la comunidad cientfica.
En el ao 1869, el qumico ruso Dimitri Mendeliev (1834-1907) y el qumico alemn Julius Lothar Meyer (18301895) propusieron cada uno por su cuenta un ordenamiento de los elementos teniendo en cuenta sus pesos atmicos crecientes y dispuestos de tal manera que sus propiedades qumicas eran semejantes entre dichos elementos. La confianza de Mendeleiev en su trabajo, lo llev a predecir las propiedades de varios elementos que an no se haban descubierto. stos deban ocupar los huecos que quedaban en su tabla luego de acomodar los elementos conocidos en su poca. Por ejemplo, propuso la existencia de un elemento llamado EKA SILICIO (eka significa primero, proviene del snscrito). Cuando se descubri el germanio en 1866 sus propiedades coincidan con las indicadas por Mendeleiev para el eka silicio. Tambin predijo las propiedades del escandio (Sc), al que llam eka boro. Esta tabla fue modificada en diversas oportunidades. A medida que se descubran nuevos elementos, deban irse incorporando. Pero hubo otras modificaciones mucho ms trascendentes. En un principio, los elementos se agrupaban de acuerdo con su peso atmico creciente.
27
ARTICULACIN QUMICA - MDULO III Teora
La Tabla peridica actual ordena los elementos por nmero atmico (Z) creciente
Los distintos elementos qumicos se encuentran ordenados y clasificados de acuerdo con su numero atmico (Z) en la tabla peridica. Cada elemento difiere del que le sigue en su ubicacin peridica en solo un protn, y por lo tanto, en un electrn. Ese electrn que diferencia a cada elemento se denomina electrn diferenciante. La siguiente tabla resume la distribucin de los electrones en niveles y subniveles: n 1 2 3 4 l 0s 0s 1s 0s 1p 2d 0s 1p 2d 3f Nmero mximo de electrones por subnivel 2 2 6 2 6 10 2 6 10 14 Nmero mximo de electrones por nivel 2 8 18 32
Para evitar confusiones entre el nivel y el subnivel, solo se usa para este ltimo la notacin con letras. El valor del nmero cuntico magntico no se indica en la notacin. As la notacin cuntica para la configuracin electrnica (C.E.) del hidrgeno es:
28
ARTICULACIN QUMICA - MDULO III Teora
1s1 que debe leerse: uno ese uno e indica que hay un electrn (el indicado como suprandice) en el subnivel s del primer nivel de energa.
Nivel de energa
1s1
Nmero de electrones Subnivel de energa
Veamos cmo se escriben las configuraciones electrnicas para otros tomos: 1s2 1s2 2s1 3Li 1s2 2s2 4Be 1s2 2s22p1 5B 1s2 2s22p2 6C 1s2 2s22p3 7N 1s2 2s22p4 8O 1s2 2s22p5 9F 2 2 6 10 Ne 1s 2s 2p 2 2 1s 2s 2p63S1 11Na
2He
A partir del elemento 19 se produce una alteracin en el orden de llenado y los electrones ingresan en un nivel de energa superior a pesar de que an no se ha completado el nivel anterior, por ejemplo, la configuracin electrnica del potasio es:
19K
1s2 2s2 2p6 3s2 3p6 4s1
Como pods observar, el electrn diferenciante ocupa el subnivel 4s y no el 3d. Teniendo en cuenta que la C.E. del argn es 1s2 2s2 2p6 3s2 3p6, se puede escribir de manera simplificada la C.E. del potasio como [Ar] 4s1. Se escribe entre corchetes el smbolo del gas noble que precede al elemento considerado y se agrega la configuracin de los restantes electrones. En este caso, el Ar tiene 18 e- y el K tiene 19 e-, por lo tanto, adems del corchete se indica la ubicacin de ese electrn. Para el caso del 12Mg es [Ne] 3s2. De esta forma encontrars escritas las configuraciones electrnicas en las tablas peridicas. Los elementos se pueden clasificar en: Representativos: Son aquellos que ubican su electrn diferencial en los subniveles s p. De transicin: El electrn diferenciador ingresa en un subnivel d del nivel anterior. De transicin interna: En ellos el electrn diferencial entra en el subnivel f del antepenltimo nivel de energa.
29
ARTICULACIN QUMICA - MDULO III Teora En la tabla peridica pueden distinguirse dieciocho columnas verticales, llamados GRUPOS y siete filas horizontales denominados PERODOS. Una regla que ayuda a escribir las configuraciones electrnicas de los elementos es la Regla de las diagonales: 1s 2s 3s 4s 5s 6s 7s Se llama Configuracin electrnica externa (C.E.E) a la que corresponde a los electrones con capacidad para participar en las reacciones qumicas. En los elementos representativos la C.E.E. corresponde a los electrones del mayor nivel energtico y coincide con el nmero del grupo A al cual pertenece. Sabemos que la C.E. del Al es la siguiente: 1s2 2s2 2p6 3s2 3p1, entonces la C.E.E. es 3s2 3p1. Es decir, lo que estamos escribiendo es la distribucin de los electrones que entran en juego en las reacciones qumicas. Como el Al es uno de los elementos representativos (su e- diferencial est en el subnivel p), en su mximo nivel de energa tiene tantos electrones como indica el grupo al cual pertenece III A ( 13), es decir, 3 electrones. Los electrones de valencia para el elemento Al son 3. Este elemento pertenece al Bloque p, Grupo 3A y Perodo 3. Bloque p, por incorporar el electrn diferencial en el subnivel p. Grupo 3A, por tener 3 electrones en su ltimo nivel. Perodo 3, por tener 3 niveles de energa. C.E. del Cl es la siguiente: 1s2 2s2 2p6 3s2 3p5 C.E.E. del Cl es la siguiente: 3s2 3p5 2p 3p 4p 5p 6p 3d 4d 5d 6d 4f 5f
Los electrones de valencia para el elemento Cl son 7. Este elemento pertenece al Bloque p, Grupo 7A y Perodo 3. Bloque p, por incorporar el electrn diferencial en el subnivel p. Grupo 7A, por tener 7 electrones en su ltimo nivel. Perodo 3, por tener 3 niveles de energa. C.E. del Rb es la siguiente: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 C.E.E. del Rb es la siguiente: 5s1
El electrn de valencia para el elemento Rb es 1. Este elemento pertenece al Bloque s, Grupo 1A y Perodo 5. Bloque s, por incorporar el electrn diferencial en el subnivel s. Grupo 1A, por tener 1 electrn en su ltimo nivel. Perodo 5, por tener 5 niveles de energa.
30
Potrebbero piacerti anche
- Guia N°1 Grado 7 - Modelos Atomicos PDFDocumento4 pagineGuia N°1 Grado 7 - Modelos Atomicos PDFArturo RojasNessuna valutazione finora
- INTRODUCTORIA Ciencia y Tec de Los Alimentos 2019-2020Documento97 pagineINTRODUCTORIA Ciencia y Tec de Los Alimentos 2019-2020milyb89100% (2)
- Experiencia Gateway (Traducción Al Castellano)Documento31 pagineExperiencia Gateway (Traducción Al Castellano)Car SinclairNessuna valutazione finora
- Fritjof Capra, Punto Crucial, Cap. 3 La Nueva FísicaDocumento25 pagineFritjof Capra, Punto Crucial, Cap. 3 La Nueva FísicaravenegaNessuna valutazione finora
- Notas Clase Quimica Unidad1 IscDocumento32 pagineNotas Clase Quimica Unidad1 IscMOISES GARCIA AGUILARNessuna valutazione finora
- La Teoria Atomica Moderna PDFDocumento11 pagineLa Teoria Atomica Moderna PDFAndry MuñozNessuna valutazione finora
- Ensayo Modelos AtomicosDocumento7 pagineEnsayo Modelos Atomicosana moralesNessuna valutazione finora
- Módulo 2 - Estructura Atómica-FRBA-Versión 2011Documento27 pagineMódulo 2 - Estructura Atómica-FRBA-Versión 2011alecap12100% (1)
- Guia #4 EL ATOMO PDFDocumento14 pagineGuia #4 EL ATOMO PDFnidia diaz muñozNessuna valutazione finora
- Atomo y Sus Particulas Sub AtomicasDocumento8 pagineAtomo y Sus Particulas Sub AtomicasErik Tomas Nah PucNessuna valutazione finora
- Teoria AtomicaDocumento24 pagineTeoria AtomicaKevin MendozaNessuna valutazione finora
- Modulo II - Estructura Atomica Parte A - 2013Documento23 pagineModulo II - Estructura Atomica Parte A - 2013Juan Silva DamianiNessuna valutazione finora
- Teoría AtómicaDocumento12 pagineTeoría AtómicaDaniiel CxNessuna valutazione finora
- 1° PARTE - TEORIA ATÓMICA - PPSXDocumento18 pagine1° PARTE - TEORIA ATÓMICA - PPSXJOHN DENNIS ARANCIBIA PACHECONessuna valutazione finora
- La Materia y Sus TransformacionesDocumento7 pagineLa Materia y Sus TransformacionesMelissa JuaresNessuna valutazione finora
- Investigacion Documental Quimica (Kevin Cruz)Documento11 pagineInvestigacion Documental Quimica (Kevin Cruz)Kevin Imanol Cruz CotoNessuna valutazione finora
- Folleto CuanticaDocumento39 pagineFolleto CuanticaCliffor Jerry Herrera CastrilloNessuna valutazione finora
- Unidad 2.estructura Atómica-2020Documento18 pagineUnidad 2.estructura Atómica-2020Eric LeonardoNessuna valutazione finora
- Teoria AtomicaDocumento16 pagineTeoria AtomicaJosé GilNessuna valutazione finora
- Taller 1 QuimicaDocumento5 pagineTaller 1 QuimicaYeisson F Barragan MachadoNessuna valutazione finora
- Clase 2 Teorias AtomicasDocumento17 pagineClase 2 Teorias AtomicasBenja SNessuna valutazione finora
- Quimica General - Eje 1.Documento14 pagineQuimica General - Eje 1.dymmx59x2wNessuna valutazione finora
- El AtomoDocumento25 pagineEl AtomoAntuan RomeroNessuna valutazione finora
- Secuencia Didáctica Modelos Atómicos Samudeo-MigottiDocumento10 pagineSecuencia Didáctica Modelos Atómicos Samudeo-MigottiEstela MigottiNessuna valutazione finora
- Ctmclase 1-2018-2 PDFDocumento36 pagineCtmclase 1-2018-2 PDFJulio GiraldoNessuna valutazione finora
- Monografia Estructura AtomicaDocumento30 pagineMonografia Estructura AtomicacarlosNessuna valutazione finora
- Historia de La Teoría AtómicaDocumento5 pagineHistoria de La Teoría Atómicaana moralesNessuna valutazione finora
- Tarea 1. Desarrollo Histórico de Los Modelos AtómicosDocumento22 pagineTarea 1. Desarrollo Histórico de Los Modelos AtómicosPerez GilNessuna valutazione finora
- Teoría Atómica Cuestionario PrevioDocumento6 pagineTeoría Atómica Cuestionario PrevioromarioNessuna valutazione finora
- VentoresDocumento35 pagineVentoresdiego fernando vera valcarcelNessuna valutazione finora
- Primer Periodo FisicaDocumento38 paginePrimer Periodo FisicaPatryNessuna valutazione finora
- QUIMICA12GUIA1Documento11 pagineQUIMICA12GUIA1marcela anguloNessuna valutazione finora
- Modelos AtomicosDocumento7 pagineModelos AtomicosJAIR HdezNessuna valutazione finora
- 2da Guia Pedagógica 4to Año QuímicaDocumento6 pagine2da Guia Pedagógica 4to Año QuímicaLuz MendezNessuna valutazione finora
- QUIMICA EJE 1 (1) Solucion TallerDocumento17 pagineQUIMICA EJE 1 (1) Solucion Talleriramirez38Nessuna valutazione finora
- Guia Teorias y Modelos Atomicos 1º MedioDocumento8 pagineGuia Teorias y Modelos Atomicos 1º MedioElias LeivaNessuna valutazione finora
- Guia Didactica de Aprendizaje 3 Quimica de Sexto 2021Documento17 pagineGuia Didactica de Aprendizaje 3 Quimica de Sexto 2021Yoana mejiaNessuna valutazione finora
- Tema 1 A PDFDocumento45 pagineTema 1 A PDFEsNessuna valutazione finora
- Guía - 9 - Modelos AtómicosDocumento37 pagineGuía - 9 - Modelos AtómicosMatteo AdrielNessuna valutazione finora
- Folleto Física CuánticaDocumento39 pagineFolleto Física CuánticaCliffor Jerry Herrera CastrilloNessuna valutazione finora
- Modelos AtómicosDocumento4 pagineModelos AtómicosMicaNessuna valutazione finora
- GUÍA RESUMEN 1ro MedioDocumento3 pagineGUÍA RESUMEN 1ro MedioAndresFloresNessuna valutazione finora
- Monografia Estructura AtomicaDocumento30 pagineMonografia Estructura Atomicacarlos100% (1)
- Naturaleza Ondulatoria de La MateriaDocumento14 pagineNaturaleza Ondulatoria de La MateriaAntonio Bañuelos0% (1)
- Umm f1 b1 Ep1 1,1 2Documento12 pagineUmm f1 b1 Ep1 1,1 2German MartinezNessuna valutazione finora
- FISICA 2 DoDocumento210 pagineFISICA 2 DoKEVIN PAUL DOMINGUEZ VALENCIANessuna valutazione finora
- Clase Nº1 Quimica General I, Estructura AtomicaDocumento36 pagineClase Nº1 Quimica General I, Estructura Atomicaengel martinezNessuna valutazione finora
- Clase 2 Primeras Teorías Atómicas Octavo Básico OnlineDocumento5 pagineClase 2 Primeras Teorías Atómicas Octavo Básico OnlineMarylaProfeNessuna valutazione finora
- GUIA INFORMATIVA 1 Octavo - Historia Del AtomoDocumento5 pagineGUIA INFORMATIVA 1 Octavo - Historia Del AtomoQuimica SebastianaNessuna valutazione finora
- Ensayo Del Descubrimiento de La Estructura AtómicaDocumento6 pagineEnsayo Del Descubrimiento de La Estructura AtómicaGalilea Ramírez0% (1)
- Actividad Del AtomoDocumento5 pagineActividad Del AtomoJosue Emanuel De la florNessuna valutazione finora
- TI-2 Teoría AtómicaDocumento10 pagineTI-2 Teoría AtómicaMax Perez LealNessuna valutazione finora
- FM 28 2007Documento22 pagineFM 28 2007Mauricio LiraNessuna valutazione finora
- 8°A B Ciencias TeóricoDocumento5 pagine8°A B Ciencias TeóricocatfuentesNessuna valutazione finora
- Estructura AtomicaDocumento24 pagineEstructura AtomicaZahidEntertaimentNessuna valutazione finora
- B3 Modelo Atómico y Aplicaciones PDFDocumento30 pagineB3 Modelo Atómico y Aplicaciones PDFLidiaPachecoNessuna valutazione finora
- 8 Biología Modelos AtómicosDocumento15 pagine8 Biología Modelos AtómicosVicho PeñaNessuna valutazione finora
- QUIMICA GENERAL (Modelo Atómico)Documento24 pagineQUIMICA GENERAL (Modelo Atómico)Shamira Geydi Mamani AucapinoNessuna valutazione finora
- Modelos AtómicosDocumento22 pagineModelos AtómicosAbraham1960100% (1)
- Modelos Atómicos MAQUETADocumento14 pagineModelos Atómicos MAQUETAPablo CobosNessuna valutazione finora
- Constitucion Del AtomoDocumento18 pagineConstitucion Del AtomoMario HernandezNessuna valutazione finora
- La aventura de la física de partículas: Un viaje de un siglo para construir el modelo estándarDa EverandLa aventura de la física de partículas: Un viaje de un siglo para construir el modelo estándarNessuna valutazione finora
- Practica LaboDocumento39 paginePractica Labojuan_pcnNessuna valutazione finora
- 02 Rubrica CuestionarioDocumento3 pagine02 Rubrica Cuestionariojuan_pcnNessuna valutazione finora
- Trabajo en Clase 5Documento4 pagineTrabajo en Clase 5juan_pcnNessuna valutazione finora
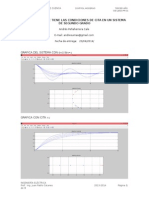
- Resultados Del SistemaDocumento3 pagineResultados Del Sistemajuan_pcnNessuna valutazione finora
- TrabajoDocumento9 pagineTrabajojuan_pcnNessuna valutazione finora
- PracticasDocumento16 paginePracticasjuan_pcnNessuna valutazione finora
- Práctica #5Documento5 paginePráctica #5juan_pcnNessuna valutazione finora
- Clase 2 Ing. CaceresDocumento5 pagineClase 2 Ing. Caceresjuan_pcnNessuna valutazione finora
- Función MonótonaDocumento3 pagineFunción Monótonajuan_pcnNessuna valutazione finora
- Practicas Matlab 5Documento4 paginePracticas Matlab 5juan_pcnNessuna valutazione finora
- Practica 1Documento6 paginePractica 1juan_pcnNessuna valutazione finora
- PracticasDocumento16 paginePracticasjuan_pcnNessuna valutazione finora
- Trabajo MatlabDocumento6 pagineTrabajo Matlabjuan_pcnNessuna valutazione finora
- Cumbe Luis 3 ADocumento8 pagineCumbe Luis 3 Ajuan_pcnNessuna valutazione finora
- Práctica #5Documento5 paginePráctica #5juan_pcnNessuna valutazione finora
- Practica 1 MATLABDocumento8 paginePractica 1 MATLABjuan_pcnNessuna valutazione finora
- Ejemplo 2Documento4 pagineEjemplo 2juan_pcnNessuna valutazione finora
- Practica 1Documento6 paginePractica 1juan_pcnNessuna valutazione finora
- Christian CondoDocumento3 pagineChristian Condojuan_pcnNessuna valutazione finora
- Formato Hoja Control Prácticas MioDocumento2 pagineFormato Hoja Control Prácticas Miojuan_pcnNessuna valutazione finora
- Asignaturas GeneralesDocumento22 pagineAsignaturas Generalesjuan_pcnNessuna valutazione finora
- Matlab Practica 2Documento9 pagineMatlab Practica 2juan_pcnNessuna valutazione finora
- Manual Octave 2Documento34 pagineManual Octave 2Camilo BorgognoNessuna valutazione finora
- Procesos Del Area de Lengua y LiteraturaDocumento2 pagineProcesos Del Area de Lengua y Literaturajuan_pcnNessuna valutazione finora
- Normas APA ActualizadasDocumento12 pagineNormas APA ActualizadasJessica MasenNessuna valutazione finora
- No Men Cla Tura Inorganic ADocumento56 pagineNo Men Cla Tura Inorganic Ajuan_pcnNessuna valutazione finora
- 67 Proteccion Direccional de Sobrecorriente de CADocumento4 pagine67 Proteccion Direccional de Sobrecorriente de CAjuan_pcn100% (3)
- 1 Basic As ControlDocumento22 pagine1 Basic As ControlLorv MLNessuna valutazione finora
- Manual de UsuarioDocumento14 pagineManual de Usuariojuan_pcnNessuna valutazione finora
- Normas APA ActualizadasDocumento12 pagineNormas APA ActualizadasJessica MasenNessuna valutazione finora
- HORTA - Pensar El Diseño - KOZAK-Técnica y PoéticaDocumento35 pagineHORTA - Pensar El Diseño - KOZAK-Técnica y PoéticaEloisa Sofia Rodriguez CardonaNessuna valutazione finora
- Clases Virtuales Qca IDocumento18 pagineClases Virtuales Qca IRitt SonNessuna valutazione finora
- Fonseca Villarreal Gian Carlo Quimica InorganicaDocumento3 pagineFonseca Villarreal Gian Carlo Quimica InorganicaVayne ShaunaNessuna valutazione finora
- Teoria Basica de La ElectricidadDocumento13 pagineTeoria Basica de La ElectricidadJulioSanchezJimenezNessuna valutazione finora
- La Fisica de La NaturalezaDocumento26 pagineLa Fisica de La NaturalezaJuan Pablo OsorioNessuna valutazione finora
- Evaluacion de QuimicaDocumento2 pagineEvaluacion de Quimicajorge ortizNessuna valutazione finora
- ENSAYO Historia de La QuimicaDocumento2 pagineENSAYO Historia de La QuimicaMaria Jose Olivero Carrascal100% (1)
- Qui MicaDocumento136 pagineQui MicaNilton Bautista DiazNessuna valutazione finora
- Taller 1 2022-1Documento3 pagineTaller 1 2022-1Yerson Yutmar Vargas HuamanNessuna valutazione finora
- Juega Dios A Los DadosDocumento13 pagineJuega Dios A Los DadosGoakofNessuna valutazione finora
- Plan Reforzamiento QuimicaDocumento9 paginePlan Reforzamiento QuimicaJuanhis Lo TravNessuna valutazione finora
- Guia 4 Electivo QuimicaDocumento13 pagineGuia 4 Electivo QuimicaGlealmary SilvaNessuna valutazione finora
- UnisónDocumento4 pagineUnisónFermin DelgadoNessuna valutazione finora
- Tema 38Documento23 pagineTema 38Victor PereaNessuna valutazione finora
- SsssDocumento2 pagineSsssAngele's Olivos SanchezNessuna valutazione finora
- Prueba N°1 Química 1° Medio PDFDocumento4 paginePrueba N°1 Química 1° Medio PDFTiany arroyoNessuna valutazione finora
- Pract. 02. QuimicaDocumento7 paginePract. 02. QuimicaErik Apec CeoNessuna valutazione finora
- Preguntas de RadiactividadDocumento14 paginePreguntas de RadiactividadFamilia Solis SobarzoNessuna valutazione finora
- Ciencias d.14Documento10 pagineCiencias d.14Paulita MejiaNessuna valutazione finora
- Propiedades Del AtomoDocumento12 paginePropiedades Del Atomojessica plataNessuna valutazione finora
- Actividad 06 Estructura AtómicaDocumento3 pagineActividad 06 Estructura AtómicaDanny Daniel ValenciaNessuna valutazione finora
- Experimento Con El Tubo de Rayos Catodicos de ThomsonDocumento3 pagineExperimento Con El Tubo de Rayos Catodicos de ThomsonJesus HernándezNessuna valutazione finora
- Guía Naturales Grado 7°Documento4 pagineGuía Naturales Grado 7°Geiner Luis Guzmán CorbachoNessuna valutazione finora
- Quimica Tarea 5Documento1 paginaQuimica Tarea 5Sebastián da SilvaNessuna valutazione finora
- Fisica Fundamental ElectricidadDocumento120 pagineFisica Fundamental ElectricidadAriel Amaro Beatriz100% (5)
- Todo Es Cuestion de Quimica - Deborah Garcia BelloDocumento236 pagineTodo Es Cuestion de Quimica - Deborah Garcia BelloAlbamarkor100% (2)
- El Universo Es Un Inmenso VacíoDocumento2 pagineEl Universo Es Un Inmenso VacíoArturo NavarroNessuna valutazione finora