Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Relatório 1 FQ Exp
Caricato da
Renan Faria GuerraTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Relatório 1 FQ Exp
Caricato da
Renan Faria GuerraCopyright:
Formati disponibili
0
UNIVERSIDADE FEDERAL DE UBERLNDIA
INSTITUTO DE QUMICA
GQB044 FSICO QUMICA EXPERIMENTAL
PROFESSORA: Dra. SHEILA CRISTINA CANOBRE
PRTICA 1 LEI DE BOYLE
MARCELA NUNES FERREIRA (11011QID020)
RAFAELA GONALVES MACHADO (11011QID030)
RENAN FARIA GUERRA (11011QID032)
ROBERTA DE CASTRO SOUZA (11011QID035)
UBERLNDIA MG
2013
1
SUMRIO
1. Introduo............................................................................................................02
2. Objetivos..............................................................................................................04
3. Procedimento Experimental................................................................................04
4. Resultados e Discusso........................................................................................05
5. Concluso............................................................................................................07
6. Referncias Bibliogrficas..................................................................................08
2
1. INTRODUO
Em 1662, Robert Boyle publicou um trabalho chamado "The Spring and Weight of
the Air no qual apresenta uma srie de experimentos onde media o volume de gases em
funo da presso exercida sobre estes, para temperaturas distintas [1].
Boyle usou um tubo longo de vidro moldado em forma de J, com o lado menor
lacrado, no qual verteu mercrio, prendendo ar no lado menor do tubo. Quanto mais
mercrio ele adicionava, mais o gs era comprimido, conforme representado na Fig. 1.
Ele concluiu que o volume de uma quantidade fixa de gs (o ar neste caso) diminui
quando a presso sobre ele aumenta [2].
Figura 1 - (a) Aparato utilizado por Boyle na execuo dos experimentos; (b) Variao
no volume de gs mediante adio de mais lquido no tubo aberto [3].
Na Fig. 2 a) se encontra representada a variao da presso de uma amostra de
gs quando o volume se altera. Cada curva chamada de isoterma (termo geral para um
grfico que mostra a variao de uma propriedade temperatura constante). De acordo
com a Lei de Boyle as isotermas dos gases so hiprboles. Outra representao grfica,
com a presso contra o inverso do volume na qual se obtm uma linha reta, aparece na
Fig. 2 b) [3].
3
a) b)
Figura 2 - a) A lei de Boyle resume o efeito da presso sobre o volume de uma
quantidade fixa de gs, em temperatura constante. Quando a presso da amostra de gs
aumenta, o volume diminui; b) Em um grfico da presso contra o inverso do volume,
obtm-se uma linha reta [3].
Sendo assim, de acordo com a lei de Boyle, o produto PV uma constante.
Chamemos esta constante de a:
PV = a (para n e T constantes)
A presso de um gs no interior de um recipiente medida com um manmetro.
Na sua verso mais simples, um manmetro um tubo em U cheio com um liquido
pouco voltil. Se uma boca do tubo for aberta, a presso, p, da amostra gasosa equilibra
com a soma das presses exercidas pela coluna do lquido mais a presso externa (p
ext
).
Desse modo, em um manmetro de tubo aberto, a presso do gs, P, a soma da
presso atmosfrica com a presso da coluna de mercrio:
(P
atm
+ P
Hg
) . V
gs
= a
(P
atm
+ P
Hg
) . V
gs
= a
O volume do gs, V, o produto da altura, h, pela rea da seo transversal do tubo, A,
em que o gs estava contido (V = rea x Altura):
(P
atm
+ P
Hg
) . A. h
gs
= a
Como A constante, pode-se combinar a constante a com A definindo a = a/A:
4
(P
atm
+ P
Hg
) . h
gs
= a/A
(P
atm
+
Hg
. h
Hg
. g) h
gs =
a
Rearranjando os termos, obtm-se a seguinte equao:
g
P
h g
a
h
Hg
atm
gs Hg
Hg
|
|
.
|
\
|
=
1
As variveis so as duas alturas enquanto que os demais termos so constantes.
Assim, lanando h
Hg
em funo de 1/h
gs
deve-se obter uma reta cuja tangente a/(
Hg
g) e cuja interseco P
atm
/(
Hg
g).
O significado de a obtm-se da equao dos gases ideais: nRT PV = , ou seja,
a = nRT pois n constante, R a constante real dos gases e a temperatura foi
aproximadamente constante durante o experimento.
2. OBJETIVOS
Os objetivos do presente experimento foram verificar se os dados experimentais se
ajustam Lei de Boyle, atravs da verificao do comportamento grfico desses dados,
e determinar a acelerao gravitacional a partir dos mesmos dados experimentais de
modo que para tanto se utilizou a Eq. 1 descrita anteriormente realizando ajuste dos
mnimos quadrados (linearizao da reta) e interpretao fsica dos coeficientes da
equao de reta obtida.
3. PROCEDIMENTO EXPERIMENTAL
I) Leu-se a presso atmosfrica com o auxlio de um barmetro;
II) Mediu-se a temperatura ambiente com auxlio de um termmetro;
III) No aparelho adequado, ajustou-se os nveis de mercrio nos dois lados do
barmetro e efetuou-se a leitura de h
gs
(ar atmosfrico);
IV) Repetiu-se o procedimento variando h. Variou-se os valores de h
Hg
desde
valores positivos at valores negativos. Efetuando-se as medidas de h
gs
e
h
Hg
.
Equao 1
5
4. RESULTADOS E DISCUSSO
Os dados experimentais de presso atmosfrica e temperatura ambiente obtidos
foram, respectivamente, 915 hPa (915x10 Pa) e 23 C (296,15 K).
Os valores referentes s medidas de h
gs
e h
Hg
coletados durante a execuo do
procedimento experimental, alm do valores de 1/ h
gs
utilizados na regresso linear,
esto apresentados na Tab. 1:
Tabela 1 Dados experimentais de h
gs
e h
Hg
e valores de 1/ h
gs
h
gs
(m) 1/h
gs
(m
-1
) h
Hg
(m)
0,208 4,81 0,200
0,235 4,25 0,130
0,240 4,17 0,092
0,245 4,08 0,065
0,250 4,00 0,042
0,265 3,77 0
0,270 3,70 -0,006
0,275 3,64 -0,017
0,278 3,60 -0,024
0,283 3,53 -0,031
0,290 3,45 -0,038
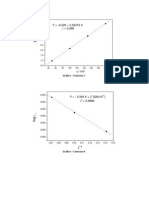
Utilizou-se os dados experimentais da Tab. 1 e a frmula descrita acima (Eq. 1)
para a construo do grfico de h
Hg
(Y) em funo de 1/h
gs
(X)
.
Os pontos foram
ajustados pelo Mtodo dos Mnimos Quadrados para que se obtenha a reta que melhor
se ajuste aos mesmos e para posterior anlise do significado fsico dos coeficientes da
equao de reta de modo a obter o valor da acelerao gravitacional. Tanto os pontos
plotados quanto a linearizao so mostrados na Fig. 3:
6
3,4 3,6 3,8 4,0 4,2 4,4 4,6 4,8 5,0
-0,05
0,00
0,05
0,10
0,15
0,20
Y = -0,70104 + 0,18894 X
r = 0,98844
h
H
g
/
m
1/h
gs
/ m
-1
Pontos Experimentais
Linear Fit
Figura 3 Grfico de h
Hg
em funo de 1/h
gs
e a linearizao dos pontos
experimentais
.
Conforme pode ser observado no grfico acima, os pontos experimentais no
formam uma linha totalmente reta, no entanto, apresentam uma tendncia a isso
indicando que os mesmos se ajustam a Lei de Boyle que vlida para gases ideias, mas
tambm uma boa aproximao para gases reais (como o caso do ar atmosfrico
utilizado no experimento), desde que a temperatura mantenha constante durante todo
experimento.
Comparou-se a Eq. 1 com a equao de uma reta, da forma de y = a+ bx, e assim
tem- se que, o coeficiente linear da equao obtido igual a
.
Sendo assim, de posse do valor do coeficiente linear (a) os dados de densidade
do mercrio e gravidade foram coletados na literatura e algumas converses de unidade
so necessrios para se obter o valor da acelerao gravitacional.
Tabela 2 - Dados coletados da literatura.
Parmetros Valor
Densidade do Mercrio (23 C) [4] 13, 5389 g.cm
-3
Gravidade em Uberlndia* 9,79 m.s
-2
*O valor da gravidade em Uberlndia foi fornecido pelo Instituto de Geografia da
Universidade Federal de Uberlndia (IGUFU) e repassado pela professora.
Converses de unidades:
Densidade do mercrio a 23 C foi 13, 5389 g/cm
3
= 13538,9 Kg/m
3
7
Presso atmosfrica foi igual a 915 hPa = 91500 Pa = 91500 Kg/m.s
2
Como e
()
Calcula-se ento o erro percentual relativo:
Erro (%) = Valor Verdadeiro Valor Experimental x 100
Valor Verdadeiro
Erro (%) = 9,79 9,64 x 100
9,79
Erro (%) = 1,53 %
As possveis fontes de erro relacionadas procedimento experimental podem estar
ligadas ao operador, ou seja, erros grosseiros (erros de medio, no caso, na leitura dos
valores de altura) e sistemticos ligados a problemas na preciso ou montagem dos
equipamentos (escala do equipamento no muito precisa) ou mesmo a temperatura que
possivelmente variou durante a execuo do procedimento e que de acordo com a Lei de
Boyle deve ser constante durante todo experimento.
5. CONCLUSO
Com a realizao do experimento, conclui-se que os dados coletados referentes s
medidas da altura do gs (h
gs
) e altura do mercrio (h
Hg
) se ajustam a Lei de Boyle
desde que a temperatura permanea constante durante o experimento fornecendo uma
boa aproximao para um gs real na medida em que ele se comporta como ideal. Alm
disso, o valor da acelerao da gravidade pode ser calculada com um erro relativo de
1,53 % consideravelmente baixo.
8
6. REFERNCIAS BIBLIOGRFICAS
[1] As leis empricas e a Equao de Estado dos Gases Ideais. Disponvel em:
<http://www.qmc.ufsc.br/quimica/pages/aulas/gas_page2.html> Acesso em: 30 de maio
de 2013.
[2] ATKINS, P.; PAULA, J. Atkins: Fsico Qumica. v.1. 7 ed. Rio de Janeiro: LTC,
2002. p. 8.
[3] ATKINS, P.; JONES, L. Princpios de Qumica: Questionando a Vida Moderna e o
Meio Ambiente. Vol. nico. 3 ed. So Paulo: Bookman, 2007. p.239.
[4] WEAT, R C. Handbook of Chemistry and Physics. 57
th
edition. Ed.CRC Press,
1976-1977. p.F-7.
Potrebbero piacerti anche
- Relatório 2 FQ ExpDocumento15 pagineRelatório 2 FQ ExpRenan Faria GuerraNessuna valutazione finora
- Gabarito 2Documento1 paginaGabarito 2Renan Faria GuerraNessuna valutazione finora
- Solicitação Matrícula TCCDocumento1 paginaSolicitação Matrícula TCCRenan Faria GuerraNessuna valutazione finora
- Relatório 1 FQ ExpDocumento9 pagineRelatório 1 FQ ExpRenan Faria GuerraNessuna valutazione finora
- ProvaDocumento14 pagineProvasibeleNessuna valutazione finora
- Gabarito DefinitivoDocumento4 pagineGabarito Definitivorutelopes1223Nessuna valutazione finora
- FQE1 EXP5 TensaoSuperficialGotaDocumento8 pagineFQE1 EXP5 TensaoSuperficialGotaLuciano Costa CavalcanteNessuna valutazione finora
- Seminário AmbientalDocumento21 pagineSeminário AmbientalRenan Faria GuerraNessuna valutazione finora
- Seminário Ambiental 3Documento24 pagineSeminário Ambiental 3Renan Faria GuerraNessuna valutazione finora
- Trabalho Corpo Negro e Princípio IncertezaDocumento16 pagineTrabalho Corpo Negro e Princípio IncertezaRenan Faria GuerraNessuna valutazione finora
- Relatório 1 FQ ExpDocumento9 pagineRelatório 1 FQ ExpRenan Faria GuerraNessuna valutazione finora
- Seminário AmbientalDocumento21 pagineSeminário AmbientalRenan Faria GuerraNessuna valutazione finora
- ConteúdoDocumento7 pagineConteúdoRenan Faria GuerraNessuna valutazione finora
- Lista de Exercícios Introdução A Cromatografia e CGDocumento3 pagineLista de Exercícios Introdução A Cromatografia e CGRenan Faria GuerraNessuna valutazione finora
- Gráficos Lista EletroquimicaDocumento1 paginaGráficos Lista EletroquimicaRenan Faria GuerraNessuna valutazione finora