Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Resumo Analise Geral Dos Metais
Caricato da
Luana VieiraCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Resumo Analise Geral Dos Metais
Caricato da
Luana VieiraCopyright:
Formati disponibili
ANLISE GERAL DOS METAIS 1 CARACTERSTICAS Os elementos qumicos so classificados em metlicos e em metaloides ou no metlicos.
Os metais apresentam as caractersticas a seguir: a) Estrutura cristalina. Todos os metais possuem geralmente estrutura cristalina e, apresentam uma disposio regular e ordenada dos seus tomos. b) Brilho tpico. Os metais possuem elevada capacidade de reflexo luz. c) Opacidade. Mantm essa propriedade at que sejam reduzidos a lminas muito finas, com espessura inferior a 0,001 mm. d) Elevada condutividade eltrica e trmica. Os metais com condutividades eltricas elevadas apresentam tambm condutividades trmicas elevadas. Os no metais e as ligas de metais com metaloides apresentam, temperatura ambiente, condutividade eltrica to baixa que so classificados como isolantes. Tais corpos ainda possuem uma variao da resistncia em funo da temperatura, inversa dos metais: estes elevam sua resistncia com elevao da temperatura, apresentando, por isso, um coeficiente de temperatura da resistncia positivo. e) So geralmente slidos. Tomando como referncia a temperatura ambiente, todos os metais, com exceo do mercrio, so slidos. f) Capacidade de deformao e moldagem. Perante elevao de temperatura e aplicando esforos mecnicos por meio de prensas e laminadoras os metais so transformados em suas sees transversais. g) Encruamento. Metais deformados a frio endurecem e reduzem sua condutividade eltrica. Essa caracterstica pode ser eliminada por um recozimento. h) Transformam-se em derivados metlicos, quando expostos a certos ambientes. Perante o oxignio do ar, formam-se xidos, em cidos sob a ao de sais. i) Pela capacidade de se combinarem entre si, podem formar ligas metlicas. 2 CLASSIFICAO Os metais podem ser classificados em: a) Metais leves, que so todos aqueles com peso especfico abaixo de 4 g/cm3, como no caso de Al, Mg, Be, Na e Ca. b) Metais pesados, aqueles com peso especfico igual ou maior que 4 g/cm3. Estes podem ser dos tipos: de baixo ponto de fuso, os que apresentam um ponto de fuso at 1 000 C, como o caso de Sn, Pb, Zn, Sb; de ponto de fuso mdio, no caso de a fuso ocorrer entre 1 000 e 2 000 C, por exemplo, Cu, Fe, Ni e Mn; de alto ponto de fuso, para valores acima de 2 000 C; como exemplos, W, Mo, Ta.
3 OBTENO As matrias-primas bsicas so os minrios, ou seja, as ligaes do metal com oxignio, enxofre, sais, cidos etc. Na natureza, encontramos no estado puro apenas os metais nobres, como o ouro e a platina. Em cada caso, o processo de obteno do metal conta com particularidades, redutores e processos de purificao. Exemplo de obteno dos metais de maior uso eltrico. 3.1 Obteno do Cobre Os processos de obteno se classificam em processo seco e por via mida. a) Processo seco Aps a eliminao parcial do enxofre, efetua-se uma reduo em fornos de fuso, atravs de carbono e aditivos cidos, os quais iro absorver grande parte do ferro. Obtm-se, assim, dois lquidos de peso especfico diferente, ficando, na parte superior, com menor densidade, um concentrado ferroso e, na parte de baixo, um composto de cobre, contendo cerca de 45% desse metal. b) Por via mida Minrios pobres em cobre so industrializados por um processo mido. Aplicando-se ao minrio uma soluo de enxofre, obtm-se uma soluo de sulfato de cobre, da qual o cobre deslocado pela ao do ferro. Esse basicamente o processo eletroltico de se obter o cobre, representado por mais de 90% de todo o cobre obtido mundialmente. 3.1.1 Purificao do Cobre A pureza do cobre para fins eltricos deve atingir valores de 99,9%. Como os processos mencionados no atinge esses valores h necessidade de purificao. O cobre de pureza de 94 a 97% fundido com certos aditivos, com o que a pureza se eleva a 99%. Esse cobre transformado em placas andinas e inserido num processo eletroltico, onde todo o cobre do anodo se transfere ao catodo, ficando as impurezas, retidas no eletrlito. Havendo, entre as impurezas, metais nobres como Ag, Au e Pt, estes se depositam no fundo da cuba eletroltica, fazendo parte da chamada lama do anodo. 3.2 Obteno de Chumbo, Zinco e Nquel Esses metais tambm podem ser refinados por processos de reduo. No caso particular do zinco, o processo de reduo se torna mais complexo, pelo fato de a temperatura de fuso ser de 907 C e a de reduo de 1 100 C. Com isso, na fase de reduo, o zinco j est no estado de vapor, o que exige fornos fechados para o processo. preferencialmente utilizado o processo eletroltico onde o minrio de nquel inicialmente convertido em NiO. Reduzido na presena de vapor de gua a 400 C obtm-se nquel, que, na presena de gs carbnico, a 80 C, forma um gs com composio de Ni(CO) 4, havendo, posteriormente, a decomposio do Ni e do CO, obtendo-se nquel com pureza de 99,9%.
3.3 Obteno de Tungstnio Os minrios so inicialmente tratados com soda, do que resulta um wolframato de sdio, e que fornece xido de tungstnio (WO3). Aps uma secagem a 300 C, o xido reduzido a p. A refrigerao deve ser efetuada em ambiente controlado. Os gros do p metlico sero tanto maiores quanto mais elevado temperatura e mais longo o tempo de reduo. 3.4 Obteno do Alumnio Parte-se do xido de alumnio (Al2O3) puro, como minrio para onde eliminamos o xido de ferro e outros cidos, por diversos processos. Pelo processo de Bayer, a bauxita, colocada numa soluo concentrada de sdio sob presso e a uma temperatura de 160 a 170 C. O alumnio do minrio se transforma em aluminato de sdio, e assim eliminando o ferro e outros aditivos na forma de uma lama. Porem quando obtido Al(OH)3 feita a filtragem, sendo depois a soluo do aluminato vacinada com hidrxido de alumnio puro cristalizado, quando ento o alumnio dissolvido se separa na forma de Al(OH)3, que, aps um tratamento trmico ao rubro, resulta em Al2O3 puro. Este dissolvido a 950 C em fluorito de alumnio e sdio (Na3AlF6), para, em seguida, aplicar o processo eletroltico. O alumnio que se deposita no catodo pouco mais pesado que o eletrlito em fuso, o que faz com que se deposite no fundo.
4 CONSTITUIO DOS METAIS PUROS Os metais se caracterizam por possuir uma constituio cristalina. Esse cristal apresenta uma determinada disposio de tomos, tanto em termos de afastamentos interatmicos quanto na forma geomtrica que resulta ao se unirem esses tomos, pois cada elemento cristalino ou slido tem sua forma cristalina particular. Nos cristais, podemos sempre estabelecer a grade cristalina que os caracteriza, particularmente pelo uso de raios Roentgen (raios X). Os tomos individuais respeitam entre si determinados afastamentos, evitando, assim, que se choquem. Em alguns casos, porm, esse afastamento to pequeno que algumas camadas e eltrons se interpenetram. Por isso, normal que os metais sejam representado graficamente s pelos seus ncleos atmicos, para tornar a representao mais clara.
Figura 1 Estrutura cristalina plana bidimensional.
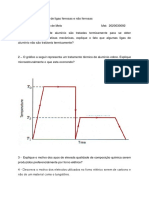
4.1 Sistemas de Ligao Atmica dos Metais Lembrando que um tomo formado de prtons, nutrons e eltrons e que essas partculas ocupam posies definidas num tomo, caber aos eltrons o processo de ligaes atmicas por serem os elementos externos que faro o contato com tomos adjacentes. As diferentes probabilidades de interligao so: a) Ligao inica- Corresponde ligao entre um tomo com um numero de eltrons superior a quatro com outro, inferior a quatro, perfazendo, nessa ligao, os oito eltrons mximos. b) Ligao atmica- Aparece quando dois elementos eletronegativos se combinam. c) Ligao metlica- Os metais pertencem ao grupo dos elementos eletropositivos, ou seja, seus tomos tendem a perder ou ligar os eltrons da camada de valncia. 4.2 O Processo de Resfriamento 4.2.1 As Curvas de Resfriamento Durante a fuso, o metal recebe uma determinada quantidade de calor, sem que com isso a temperatura se eleve. Os tomos assim adquirem, na fuso, uma movimentao prpria, instantnea. A energia necessria para isso o calor de fuso. No ciclo inverso essa quantidade de calor liberada durante o ciclo de esfriamento (ver figura 2). Tendo-se o esfriamento de um chumbo em fuso partindo de 380C, nota-se que a 327C essa temperatura caracterstica do chumbo a sua temperatura de solidificao. Esse comportamento se justifica pela liberao da quantidade de calor de fuso, sem elevao da temperatura na fuso e, consequentemente, sem reduo de temperatura na solidificao. Se ocorrer um esfriamento acelerado, o desenvolvimento das curvas de solidificao ser o das figuras 2 c e d.
Figura 2 - Curvas de Aquecimento e Esfriamento de chumbo puro
4.2.2 Formao e Crescimento dos Cristais O cristal se forma no esfriamento de um metal em fuso, assim que alguns tomos estabelecem entre si distncias definitivas, sendo assim os germens cristalinos. Seu crescimento gradativo se faz presente pela ao de foras entre os cristais, fazendo com que, tomo aps tomo, ocupe seu lugar no sistema ou grade cristalina.
Pois o nmero desses germens varia com a velocidade de esfriamento, notando-se que quanto maior essa velocidade, maior o nmero de germens, levando a uma solidificao simultnea em diversas posies. Portanto, quanto mais rpido ocorrer o esfriamento, mais fina a estrutura cristalina, o que mais vantajoso, porque assim resultam propriedades eltricas (condutividade) e mecnicas (dobramento, laminao e outras) mais apropriadas. 4.2.3 Modificaes Estruturais Aps a solidificao ainda pode se modificar alguns metais aplicando um novo esfriamento. Isso possvel fazendo uma mudana de posio de tomos do cristal, que ir alterar a estrutura cristalina e consequentemente suas propriedades tambm sofreram modificaes sensveis. Essas modificaes cristalinas liberam-se pequenas quantidades de calor, que so indicadas no grfico (ver figura 3) de aquecimento e esfriamento como pequenos patamares horizontais. Esse comportamento demonstra a origem de diferentes formas de ferro (, , ...).
Figura 3 Curvas de Aquecimento e Esfriamento de ferro puro
4.3 Anisotropia Cristalina Um cristal anisotrpico quando suas caractersticas eltricas, mecnicas variam de acordo com o eixo cristalino em que so medidas. A anisotropia cristalina tambm funo do tamanho do gro ou cristal, sendo mais destacada em gros cristalinos grandes do que nos pequenos. Portanto, certas caractersticas do material eltrico podem ficar condicionadas escolha do correto ngulo de aplicao de esforos. Por isso, comum em certos casos, como o de metais magnticos, o conhecimento preliminar dos ngulos de anisotropia cristalina, para ento se dar ao material a configurao mais prpria ao seu uso no componente eltrico. 4.4 Processo de Solidificao de Ligas Duplas As ligas aparecem quando dois ou mais metais se misturam e se ligam estruturalmente, no estado lquido ou no de fuso, permanecendo assim quando solidificam.
Os processos de solidificao podem ser apresentados das seguintes maneiras: a) Ligas com formao euttica- O grupo representado por dois metais, que, no estado de fuso, so totalmente misturveis entre si, mas que, ao se solidificarem, se separam novamente. b) Ligas com estruturas cristalinas mistas- Numa estrutura desse tipo participam dois tipos diferentes de tomos identicamente na construo da estrutura cristalina. Pois so perfeitamente combinveis tanto no estado slido quanto no lquido. Para que tais estruturas possam ser obtidas, necessrio que ambos os metais tenham a mesma grade cristalina e no apresentem sensveis diferenas nas distncias interatmicas, na sua valncia, na sua posio na Tabela Peridica dos Elementos e na seria de tenses galvnicas. 4.5 Principais Defeitos Tcnicos na Solidificao a) Bolhas e Poros- Metais em fuso absorvem grande quantidade de gs, como oxignio, nitrognio, gs carbnico e outros. Esses gases podem se separar novamente dos metais ou serem absorvidos pelos mesmos na solidificao podendo assim tornar as peas defeituosas e mesmo inutilizadas. b) Fissuras- Podem ser internas ou externas. A depender de um esfriamento rpido ou a presena de quantidades significativas de materiais que no se combinam com o metal, leva a formao de fissuras, devido ao processo de contrao metlica durante o esfriamento. c) Impurezas- So diversas as impurezas que se podem apresentar, sejam essas provenientes de transformaes do prprio metal, sejam do ambiente em que o processo se realiza. Assim para minimizar esses efeitos negativos o processamento deve ser feito em ambiente controlado livre de impurezas.
Potrebbero piacerti anche
- Tecn MateriaisDocumento49 pagineTecn MateriaisMário Brás BrásNessuna valutazione finora
- Materia de Tratamentos TermicosDocumento27 pagineMateria de Tratamentos TermicosFrancisco PedroNessuna valutazione finora
- CEM I ResumosDocumento68 pagineCEM I ResumosMartim Moreirinhas MouraNessuna valutazione finora
- Metalurgia de Soldagem - OKDocumento24 pagineMetalurgia de Soldagem - OKcunharufinoluizNessuna valutazione finora
- Ensaio de Oxidação de AçosDocumento20 pagineEnsaio de Oxidação de AçosGuilherme Dias zarurNessuna valutazione finora
- Metais Parte 2Documento11 pagineMetais Parte 2Bts SvtNessuna valutazione finora
- A produção do aço: das matérias-primas ao produto finalDocumento9 pagineA produção do aço: das matérias-primas ao produto finaligortrogoNessuna valutazione finora
- 2 - Estrutura Atômica OkDocumento59 pagine2 - Estrutura Atômica Okjaelson silvaNessuna valutazione finora
- Ferros, aços e seus constituintes estruturaisDocumento20 pagineFerros, aços e seus constituintes estruturaisFábio Máximo RutkoskiNessuna valutazione finora
- Propriedades e Estruturas Cristalinas dos MetaisDocumento33 paginePropriedades e Estruturas Cristalinas dos MetaisNikolas OliveiraNessuna valutazione finora
- Cerâmicas - Lista 1Documento6 pagineCerâmicas - Lista 1Roberto Henrique NevesNessuna valutazione finora
- Capitulo 1 Metalurgia Geral Da SoldagemDocumento34 pagineCapitulo 1 Metalurgia Geral Da SoldagemFabiano CaldasNessuna valutazione finora
- Aços Carbono EutetoideDocumento4 pagineAços Carbono EutetoideLe JungNessuna valutazione finora
- Weslei Santana Damiao - MIND I (1)Documento5 pagineWeslei Santana Damiao - MIND I (1)Weslei SantanaNessuna valutazione finora
- Aula 2 - Ligas Ferro-CarbonoDocumento27 pagineAula 2 - Ligas Ferro-CarbonoAline FariaNessuna valutazione finora
- Parte 04 - Fabricacao Do ACODocumento24 pagineParte 04 - Fabricacao Do ACOHalleyWeltherJacquesDiasNessuna valutazione finora
- Nos Primórdios Da Humanidade Os Métodos de Fabricação de MateriaisDocumento8 pagineNos Primórdios Da Humanidade Os Métodos de Fabricação de MateriaisMelanie SanchezNessuna valutazione finora
- Tratamento Térmico - Cap. 02Documento8 pagineTratamento Térmico - Cap. 02Adriano BritoNessuna valutazione finora
- 1687062155120+introdução TeoricaDocumento5 pagine1687062155120+introdução TeoricaLuan MoraesNessuna valutazione finora
- Tratamentos Trmicos 110303170607 Phpapp02Documento139 pagineTratamentos Trmicos 110303170607 Phpapp02André BrusiusNessuna valutazione finora
- Materiais e TecnologiaDocumento35 pagineMateriais e TecnologiaAnderson SantosNessuna valutazione finora
- Cobre e Suas LigasDocumento67 pagineCobre e Suas Ligasfnahas_bh100% (1)
- QUESTIONARIO 7 Materias de ConstruçãoDocumento4 pagineQUESTIONARIO 7 Materias de ConstruçãoMylenna LimaNessuna valutazione finora
- Alumínio e Suas LigasDocumento15 pagineAlumínio e Suas LigasAirton SouzaNessuna valutazione finora
- Soldagem e metais: propriedades e aplicaçõesDocumento96 pagineSoldagem e metais: propriedades e aplicaçõesFranqui FernandesNessuna valutazione finora
- PiroNF Aula 07 Processos de Refino 2015-01Documento24 paginePiroNF Aula 07 Processos de Refino 2015-01Carlos CarvalhalNessuna valutazione finora
- Processo Do Alto FornoDocumento16 pagineProcesso Do Alto FornoAbinadab Dos Santos AraújoNessuna valutazione finora
- Ligas metálicas e suas aplicaçõesDocumento40 pagineLigas metálicas e suas aplicaçõesMarcos ViniciusNessuna valutazione finora
- Produção do aço emDocumento68 pagineProdução do aço empatrickymelottiNessuna valutazione finora
- FerrosDocumento12 pagineFerrosorea1Nessuna valutazione finora
- Aço Inox Duplex e Aço Maraging (GISELLY BASILIO E GILBERTO PDocumento27 pagineAço Inox Duplex e Aço Maraging (GISELLY BASILIO E GILBERTO PEdis KuznierNessuna valutazione finora
- Resumo de Tecnologia Dos MateriaisDocumento8 pagineResumo de Tecnologia Dos MateriaisldmoreiraNessuna valutazione finora
- Cap 09 - O Diagrama de Equilíbrio Fe3CDocumento7 pagineCap 09 - O Diagrama de Equilíbrio Fe3CYasmin MachadoNessuna valutazione finora
- Trabalho de FundiçãoDocumento11 pagineTrabalho de FundiçãoJoão MoutaNessuna valutazione finora
- Tratamento térmico de aços: estrutura cristalina e constituintesDocumento72 pagineTratamento térmico de aços: estrutura cristalina e constituintesJustin Hernandez80% (5)
- LigaMetalicas 054907Documento12 pagineLigaMetalicas 054907Henriques Sebastiao0% (1)
- Corrosão e revestimentosDocumento53 pagineCorrosão e revestimentosBruno HerdyNessuna valutazione finora
- Lista de Exerccios 2 - ResolvidaDocumento4 pagineLista de Exerccios 2 - ResolvidaGiovanna centenaroNessuna valutazione finora
- CapaDocumento9 pagineCapaVanderley GoncalvesNessuna valutazione finora
- Modulo 6 PreparadoDocumento34 pagineModulo 6 PreparadoGilberto BadeNessuna valutazione finora
- Apostila Aço e Ferro FundidoDocumento48 pagineApostila Aço e Ferro FundidoMauricio CamargoNessuna valutazione finora
- Aula 3 - Tipos de CorrosaoDocumento17 pagineAula 3 - Tipos de CorrosaoGuilherme Mendes0% (1)
- Materiais e Tipos de Tratamento PDFDocumento11 pagineMateriais e Tipos de Tratamento PDFEriberto NunesNessuna valutazione finora
- Tratamento Térmico e Tratamento de Superfície PDFDocumento162 pagineTratamento Térmico e Tratamento de Superfície PDFgiovanne_torres5884Nessuna valutazione finora
- Tratamento TérmicoDocumento72 pagineTratamento TérmicoMarcos Antonio JardimNessuna valutazione finora
- Aços e Seus Tratamentos TérmicosDocumento90 pagineAços e Seus Tratamentos TérmicosAngelo LeãoNessuna valutazione finora
- Tratamentos térmicos dos aços: alterando propriedades mecânicasDocumento58 pagineTratamentos térmicos dos aços: alterando propriedades mecânicasAline FariaNessuna valutazione finora
- Trabalho sobre propriedades do cobreDocumento17 pagineTrabalho sobre propriedades do cobreJoao Pedro TanajuraNessuna valutazione finora
- Aula Nassau - Materiais CerâmicosDocumento25 pagineAula Nassau - Materiais CerâmicosBruno GuedesNessuna valutazione finora
- 03 - Alto Forno - Obtenção Do Ferro Gusa - Processo Siderúrgico - Aço - Processos de Fabricação - Aços & Ligas - InfometDocumento7 pagine03 - Alto Forno - Obtenção Do Ferro Gusa - Processo Siderúrgico - Aço - Processos de Fabricação - Aços & Ligas - InfometCristianeNessuna valutazione finora
- Os Elementos Metais Alcalinos TerrososDocumento23 pagineOs Elementos Metais Alcalinos Terrososmarco_santos3079Nessuna valutazione finora
- Cobre e Suas LigasDocumento36 pagineCobre e Suas LigasThiago CurvoNessuna valutazione finora
- 1 - Materiais MecânicaDocumento37 pagine1 - Materiais MecânicaricardoNessuna valutazione finora
- Alto Forno e Aciaria 08 2018Documento17 pagineAlto Forno e Aciaria 08 2018IsadoraNessuna valutazione finora
- Aços Inoxidáveis - Corrosão E Métodos Para DetecçãoDa EverandAços Inoxidáveis - Corrosão E Métodos Para DetecçãoNessuna valutazione finora
- A Estranha Natureza Dos Núcleos AtômicosDa EverandA Estranha Natureza Dos Núcleos AtômicosNessuna valutazione finora
- Sketchup CompletaDocumento22 pagineSketchup CompletaCássia PereiraNessuna valutazione finora
- Manual Usuario Notebook PositivoDocumento36 pagineManual Usuario Notebook PositivoLuana VieiraNessuna valutazione finora
- RegulamentoDocumento25 pagineRegulamentoLuana VieiraNessuna valutazione finora
- Grafico de Leitura Livro de MormonDocumento1 paginaGrafico de Leitura Livro de MormonJosue TrindadeNessuna valutazione finora
- Convite Meninos e Meninas PDFDocumento2 pagineConvite Meninos e Meninas PDFLuana VieiraNessuna valutazione finora
- Grafico de Leitura Livro de MormonDocumento1 paginaGrafico de Leitura Livro de MormonJosue TrindadeNessuna valutazione finora
- Apostila - Sketchup 5 - Avançado - PortuguesDocumento13 pagineApostila - Sketchup 5 - Avançado - PortuguesDebora Herbert EmilyNessuna valutazione finora
- Convite Meninos e MeninasDocumento2 pagineConvite Meninos e MeninasLuana VieiraNessuna valutazione finora
- Tabela Etiqueta - LuanaDocumento1 paginaTabela Etiqueta - LuanaLuana VieiraNessuna valutazione finora
- Manual Usuario Notebook PositivoDocumento36 pagineManual Usuario Notebook PositivoLuana VieiraNessuna valutazione finora
- Grafico de Leitura Livro de MormonDocumento1 paginaGrafico de Leitura Livro de MormonJosue TrindadeNessuna valutazione finora
- Quadros de Distribuição Ver4Documento9 pagineQuadros de Distribuição Ver4Luana VieiraNessuna valutazione finora
- Buscando Milagres Daniel e SamuelDocumento1 paginaBuscando Milagres Daniel e SamuelLuana VieiraNessuna valutazione finora
- Grafico de Leitura Livro de MormonDocumento1 paginaGrafico de Leitura Livro de MormonJosue TrindadeNessuna valutazione finora
- Manual Usuario Notebook PositivoDocumento36 pagineManual Usuario Notebook PositivoLuana VieiraNessuna valutazione finora
- Apresentação EletronicaDocumento10 pagineApresentação EletronicaLuana VieiraNessuna valutazione finora
- Resumo II Unidade Componentes SemicondutoresDocumento3 pagineResumo II Unidade Componentes SemicondutoresLuana VieiraNessuna valutazione finora
- Pavê de BrigadeiroDocumento2 paginePavê de BrigadeiroLuana VieiraNessuna valutazione finora
- Regulamento OfertaDocumento10 pagineRegulamento OfertaLuana VieiraNessuna valutazione finora
- ValvulaDocumento8 pagineValvulaLuana VieiraNessuna valutazione finora
- EletromagDocumento7 pagineEletromagLuana VieiraNessuna valutazione finora
- Torta de Cremosa de BananaDocumento2 pagineTorta de Cremosa de BananaLuana VieiraNessuna valutazione finora
- Instrumentacao e Controle2Documento10 pagineInstrumentacao e Controle2Luana VieiraNessuna valutazione finora
- Venha Ser Um TIM BETADocumento1 paginaVenha Ser Um TIM BETALuana VieiraNessuna valutazione finora
- Instrumentacao e Controle2Documento10 pagineInstrumentacao e Controle2Luana VieiraNessuna valutazione finora
- TIPOS de Revestimento Do NTC Vidro e EpoxiDocumento2 pagineTIPOS de Revestimento Do NTC Vidro e EpoxiLuana VieiraNessuna valutazione finora
- EletromagDocumento1 paginaEletromagLuana VieiraNessuna valutazione finora
- EleromagDocumento2 pagineEleromagLuana VieiraNessuna valutazione finora
- Bolinho de ChuvaDocumento1 paginaBolinho de ChuvaLuana VieiraNessuna valutazione finora
- Avaliação NR20Documento3 pagineAvaliação NR20Jean Luiz86% (7)
- Catalogo 7225JDocumento644 pagineCatalogo 7225JRafael Gonçalves63% (8)
- A Energia e A HistóriaDocumento49 pagineA Energia e A HistóriaEdivaldo FerreiraNessuna valutazione finora
- Transformação de pneus em dormentes ferroviáriosDocumento29 pagineTransformação de pneus em dormentes ferroviáriosGabriel AtaideNessuna valutazione finora
- Corrosão mecânica em 40Documento44 pagineCorrosão mecânica em 40Marco Aurélio SouzaNessuna valutazione finora
- Universidade Federal Do Ceará-Relatorio QuimDocumento10 pagineUniversidade Federal Do Ceará-Relatorio QuimGisely RodriguesNessuna valutazione finora
- Controlador digital para refrigeração e degeloDocumento3 pagineControlador digital para refrigeração e degeloMarcos Correia100% (1)
- CatalogoVentiladores IBRAM 2011Documento36 pagineCatalogoVentiladores IBRAM 2011RobmixNessuna valutazione finora
- Banho Free Níquel: Processo alcalino cianídrico para depósitos de liga de estanho e cobreDocumento2 pagineBanho Free Níquel: Processo alcalino cianídrico para depósitos de liga de estanho e cobreCicero Gomes de SouzaNessuna valutazione finora
- Exercicio de Consolidacao (Processos de Fabricacao II)Documento3 pagineExercicio de Consolidacao (Processos de Fabricacao II)Zeca Boaventura NhachungueNessuna valutazione finora
- Telecurso 2000 - Química - Gabaritos 01 A 25Documento26 pagineTelecurso 2000 - Química - Gabaritos 01 A 25QuimicaTC100% (1)
- Pedro Marques Coelho Matricula - 2021214868 - Atividade3 - Ensaio de Durez e TermicosDocumento6 paginePedro Marques Coelho Matricula - 2021214868 - Atividade3 - Ensaio de Durez e Termicospedromarquescoelho20Nessuna valutazione finora
- Polia Ferro Trapezoidal C PDFDocumento3 paginePolia Ferro Trapezoidal C PDFSebastião Barbosa da Silva0% (1)
- Planilha de preços unitários para serviços de construção civilDocumento27 paginePlanilha de preços unitários para serviços de construção civilgatojabaquaraNessuna valutazione finora
- Catalog Tvhdnamica EatonDocumento27 pagineCatalog Tvhdnamica EatonAlfredo Tar100% (1)
- Relatório (Argamassa) - Lab. de MateriaisDocumento15 pagineRelatório (Argamassa) - Lab. de MateriaisMelissa de LavorNessuna valutazione finora
- NB 1344 - 1991 - Dosagem de Brita Graduada Tratada Com Cimento PDFDocumento2 pagineNB 1344 - 1991 - Dosagem de Brita Graduada Tratada Com Cimento PDFmichelemelocintraNessuna valutazione finora
- Lista Exercicios InjecaoDocumento4 pagineLista Exercicios InjecaoNei Rodrigues de FreitasNessuna valutazione finora
- Postos de Manaus em Excel 100 Atualizado Versao FinalDocumento44 paginePostos de Manaus em Excel 100 Atualizado Versao FinalWendel AlvesNessuna valutazione finora
- Polímeros tecnologia transformação reciclagemDocumento1 paginaPolímeros tecnologia transformação reciclagemManthnehaNessuna valutazione finora
- Reforço Questões CFC Mai-22Documento5 pagineReforço Questões CFC Mai-22Vinicius Eduardo MoroginskiNessuna valutazione finora
- Controle empresarialDocumento27 pagineControle empresarialAlexandreNessuna valutazione finora
- Condutores, semicondutores e isolantes: características elétricasDocumento13 pagineCondutores, semicondutores e isolantes: características elétricasMessias Sousa Karoline MilhomemNessuna valutazione finora
- Dissertação - Gilmara Martins de Oliveira - 2022Documento87 pagineDissertação - Gilmara Martins de Oliveira - 2022Babugi Ernesto Antonio ObraNessuna valutazione finora
- Traço de concreto C15 com A/C 0,65Documento26 pagineTraço de concreto C15 com A/C 0,65Elaine CrisNessuna valutazione finora
- 11L-PM - TEC - M04 - Manual de Processos de Fabrico - AlunoDocumento83 pagine11L-PM - TEC - M04 - Manual de Processos de Fabrico - Alunominasgamer6Nessuna valutazione finora
- Argumentos Armazenadora (1) SilosDocumento39 pagineArgumentos Armazenadora (1) SilosDAVIDSONNessuna valutazione finora
- Techdata Pre KlenzDocumento3 pagineTechdata Pre KlenzengenhariahabNessuna valutazione finora
- Manual do Relematic Intermediário CF20Documento24 pagineManual do Relematic Intermediário CF20Zabbres ArtsNessuna valutazione finora
- Guia de costura SINGERDocumento15 pagineGuia de costura SINGERLauro Besn100% (1)