Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Problemas Del Cap. 2 - Levenspiel
Caricato da
Emilio Tafur EspinozaDescrizione originale:
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Problemas Del Cap. 2 - Levenspiel
Caricato da
Emilio Tafur EspinozaCopyright:
Formati disponibili
PROBLEMAS DEL CAPITULO 2 CINETICA DE LAS REACCIONES HOMOGENEAS
2.18) Demostrar que e siguiente esquema:
Propuesto por R. Off, J. Chem. Phys., 15, 337 es consistente con, y puede explicar, la descomposicin de primer orden observaba para el N2O5.
SOLUCIN: Realizando la siguiente operacin con las ecuaciones enumeradas 2(1)+(2)+(3) se obtiene
De la expresin anterior se observa que la descomposicin de N2O5 es de primer orden.
2.19) La descomposicin de un reactivo A a 400C para presiones comprendidas entre 1 y 10 atmosferas sigue una ecuacin cintica de primer orden. a) Demostrar que un mecanismo similar al de la descomposicin del azometano,
Es consistente con la cintica observada. Para explicar la cintica de primer orden es posible proponer varios mecanismos. Para afirmar que este mecanismo es el correcto a pesar de las otras posibilidades, es necesario aportar otras pruebas o argumentos.
b) Para este propsito, Qu experimentos adicionales sugiere realizar el lector y que resultados esperara?
SOLUCIN: a) Las ecuaciones estequiomtricas se pueden escribir La velocidad de formacin de A* seria:
La velocidad de formacin de R seria:
Con () y ()
Si la concentracin de A es mucho mayor que K3 entonces, K2CAK3
b) Para poder corroborar el mecanismo planteado se deben realizar experimentos para que se establezca la reaccin a concentraciones altas de A, y a la vez a diferentes condiciones de operacin.
2.21) Por la influencia de agentes oxidantes, el acido hipofosforoso se transforma en acido fosforoso. La cintica de esta transformacin presenta las caractersticas siguientes. A concentraciones bajas dl agente oxidante, [ ][ ]
Para explicar los datos cinticos, se ha sugerido que con los iones hidrogeno actuando como catalizador, y el H3PO2 que normalmente no es reactivo, se transforma reversiblemente en una forma activa, cuya naturaleza se desconoce. Este producto intermedio reacciona luego con el agente oxidante para dar H3PO3. Demostrar que este esquema explica la cintica observada.
SOLUCIN: Haciendo H3PO2 = A ; H+ = B ; Forma activa = C ; Agente oxidante = D ; H3PO3 = E
Adems
[ ]
La velocidad de E seria: [ ][ ] La velocidad de C seria: [ ][ ] Pero rc=0 [ ][ ] [ ] [ ] De () en () [ ] [ ] [ ][ ] [ ] [ ][ ] [ ][ ] [ ] [ ][ ]
[ ] Remplazando por la nomenclatura establecida [ [ [ ]
[ ][ ] [ ]
[ [ ] ] [ ][
][
] ]
Debido a que el agente oxidante s encuentra a elevadas concentraciones, este puede despreciarse y considerarse a su concentracin cte. Agrupando [ [ Se tiene finalmente [ ][ ] ] ]
2.23) Mecanismo para las reacciones catalizadas enzimticamente. Para explicar la cintica de las reacciones entre una enzima y el sustrato, Michaelis y Menten (1913) sugirieron el siguiente mecanismo, que implica un supuesto de equilibrio:
[] [][ ]
, [ ]
[ ]
[]
Y donde [E ] representa la cantidad total de enzima y [E] representa la cantidad de enzima libre no enlazada. Por otra parte, G. E. Bridges y J. B. S. Haldane, Biochem J., 19, 338 emplearon un supuesto de estado estacionario, en lugar del de equilibrio
[]
, [ ]
[ ]
[]
Cul es la forma final de la ecuacin de velocidad rA en trminos de [A], [E], K1, K2 y K3, segn a) El mecanismo sugerido por Michaelis-Menten? b) El mecanismo sugerido por Briggs-Haldane?
SOLUCIN: a) Se tiene
Adems: y
[E ]=[E]+[X]
[] [][ ]
La expresin de la velocidad para R es [ ] Tenemos
En el equilibrio se tiene [ ] [ ][ ] [ ] [ ][ ] [ ][ ] [ ]
Del balance del catalizador se tiene [ ] De () y () [ ] [ ] [ ][ ] [ ][ ] [ ] [ ] [ ][ ] [ ] [ ] [ ] [ ] [ ] [ ]
[ ][ ] [ ]
De () y () [ ][ ] [ ] La expresin cintica seria de la siguiente forma [ ][ ] [ ]
b)
Adems [E]=[E]+[X] y
[]
La expresion de la velocidad para A seria [ ] La expresion de la velocidad para el producto intermedio
[ ]
[ ][ ] [ ][ ]
[ ]
[ ]
[ ] Del balance de masa para el catalizador [ ] De () y () [ ] [ ] [ ] La expresin cintica seria: [ ]
[ ]
[ ]
[ ] [ ] [ ][ ] [ ]
[ ]
[ ][ ] [ ][ ]
[ ][ ] [ ]
Potrebbero piacerti anche
- Ley de Dalton y HenryDocumento62 pagineLey de Dalton y HenryLaura ReyesNessuna valutazione finora
- Produccion Del Acido SulfuricoDocumento52 pagineProduccion Del Acido SulfuricoJenny Ojeda Castillon100% (1)
- Dimensionado de la malla en cribadoDocumento3 pagineDimensionado de la malla en cribadoEmilio Tafur EspinozaNessuna valutazione finora
- Dimensionado de la malla en cribadoDocumento3 pagineDimensionado de la malla en cribadoEmilio Tafur EspinozaNessuna valutazione finora
- Practica 1 PDFDocumento18 paginePractica 1 PDFAlinne VillegasNessuna valutazione finora
- 4 HeuristicaDocumento36 pagine4 Heuristicazaibatsu fernandezNessuna valutazione finora
- Modelamiento de Un Reactor Batch en MatlabDocumento10 pagineModelamiento de Un Reactor Batch en MatlabDerly Tatiana Mendez HernandezNessuna valutazione finora
- Escoria SinteticaDocumento20 pagineEscoria SinteticaFelipe Cortés100% (1)
- Lubricación camiones mineros KomatsuDocumento57 pagineLubricación camiones mineros Komatsuroberth1991Nessuna valutazione finora
- Balance de Materia en Planta de Ácido Sulfúrico.Documento16 pagineBalance de Materia en Planta de Ácido Sulfúrico.Pedro TrejosNessuna valutazione finora
- Sesión 11 - Extraccion Por SolventesDocumento26 pagineSesión 11 - Extraccion Por SolventesBryan Claros FrancoNessuna valutazione finora
- P4Documento2 pagineP4Gabriel BarrigaNessuna valutazione finora
- Cativa proceso fabricación ácido acéticoDocumento3 pagineCativa proceso fabricación ácido acéticoAndrea Buendia MataNessuna valutazione finora
- Laboratorio de MoliendaDocumento8 pagineLaboratorio de MoliendaLuis Antony Lorenzo GonzalesNessuna valutazione finora
- Pirometalurgia de PlomoDocumento20 paginePirometalurgia de PlomoGerardo PortalesNessuna valutazione finora
- Pirometalurgia Hidrometalurgia ElectrometalurgiaDocumento7 paginePirometalurgia Hidrometalurgia ElectrometalurgiaSebaNessuna valutazione finora
- Flujo PistonDocumento15 pagineFlujo Pistonyolanda bermudezNessuna valutazione finora
- Balance EnergíaDocumento40 pagineBalance EnergíaNoel IbañezNessuna valutazione finora
- Teoria-Desorcion GaseosaDocumento14 pagineTeoria-Desorcion GaseosaSarita Mesias MNessuna valutazione finora
- Cinetica de La Hidrogenacion de Tolueno en Fase LiquidaDocumento14 pagineCinetica de La Hidrogenacion de Tolueno en Fase LiquidaSambya Naysa Cardenas CandiottiNessuna valutazione finora
- Exámen Final PI 826 A 2021-1 Con SolucionarioDocumento3 pagineExámen Final PI 826 A 2021-1 Con SolucionarioKatherine Ayala Cordova0% (1)
- Segundo Examen Parcial de Diseño de Procesos - 2021Documento3 pagineSegundo Examen Parcial de Diseño de Procesos - 2021Kenia Paola Betsabe Martinez GalvanNessuna valutazione finora
- Descripción del reactor de cama turbulenta en tostador de concentrado de zincDocumento18 pagineDescripción del reactor de cama turbulenta en tostador de concentrado de zincPercy Camarena SanchezNessuna valutazione finora
- Diseño de Reactores ElectroquimicosDocumento18 pagineDiseño de Reactores Electroquimicosmaysilee-katnissNessuna valutazione finora
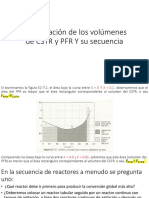
- Comparación de Los Volúmenes de CSTR y PFRDocumento3 pagineComparación de Los Volúmenes de CSTR y PFRJuan José Solano CastilloNessuna valutazione finora
- DIAGRAMA DE POURBAIX DEL H2O CuDocumento8 pagineDIAGRAMA DE POURBAIX DEL H2O CuJhuan Uchasara SihuayroNessuna valutazione finora
- Cinetica Química EjerciciosDocumento8 pagineCinetica Química EjerciciosJose LozanoNessuna valutazione finora
- Trabajo 3 - MasaDocumento1 paginaTrabajo 3 - MasaNelson Pezúa LujánNessuna valutazione finora
- Tercer Examen 98 PDFDocumento106 pagineTercer Examen 98 PDFDenys AlanyaNessuna valutazione finora
- Hidrogenacion Del BencenoDocumento7 pagineHidrogenacion Del BencenoPablo Albert Quispe CapquiqueNessuna valutazione finora
- Ingeniería de Las Reacciones HeterogéneasDocumento21 pagineIngeniería de Las Reacciones HeterogéneasGracielaGramyQH0% (1)
- Producción de Anhídrido MaleicoDocumento4 pagineProducción de Anhídrido MaleicoJonnathan Alexis Villafuerte100% (1)
- TALLER Ingeniería de Las Reacciones Químicas 1 PDFDocumento4 pagineTALLER Ingeniería de Las Reacciones Químicas 1 PDFAndres LlorenteNessuna valutazione finora
- Lou Ii-Parcial17-2Documento2 pagineLou Ii-Parcial17-2Monin Bernaola CamposNessuna valutazione finora
- PDF Produccion de Acido Acrilico A Partir de Propileno DDDocumento80 paginePDF Produccion de Acido Acrilico A Partir de Propileno DDKrugger CossioNessuna valutazione finora
- Planta Productora de Oxido de EtilenoDocumento10 paginePlanta Productora de Oxido de EtilenoWendolyn MartinezNessuna valutazione finora
- Pi415 PC1 2020-2Documento4 paginePi415 PC1 2020-2Ricardo HernandezNessuna valutazione finora
- Síntesis y usos del amoniacoDocumento35 pagineSíntesis y usos del amoniacoIvan TrigoNessuna valutazione finora
- Ácido Sulfúrico (Tostación de Blenda/Esfalerita)Documento76 pagineÁcido Sulfúrico (Tostación de Blenda/Esfalerita)Antonio Ros Moreno100% (3)
- Análisis cinético de reacciones químicas en reactores discontinuosDocumento82 pagineAnálisis cinético de reacciones químicas en reactores discontinuosdomingo osorio100% (1)
- Informe Fundicion LatonDocumento24 pagineInforme Fundicion LatonCamilo SanaNessuna valutazione finora
- Diapositivas G 2 HeurísticaDocumento29 pagineDiapositivas G 2 HeurísticaDanielaLópezNessuna valutazione finora
- Capitulo V Concentración y Purificación de Soluciones Con CobreDocumento47 pagineCapitulo V Concentración y Purificación de Soluciones Con CobreNicole Mercedes Chacon OnsyhuayNessuna valutazione finora
- AMONIACODocumento22 pagineAMONIACOAlvaro RiveraNessuna valutazione finora
- Reactores HeterogeneosDocumento22 pagineReactores HeterogeneosCeci GuillenNessuna valutazione finora
- Ingeniería de Procesos: Universidad Técnica Particular de LojaDocumento4 pagineIngeniería de Procesos: Universidad Técnica Particular de LojaGabbyRockaNessuna valutazione finora
- Reactor CSTRDocumento20 pagineReactor CSTRSofia Mac RodriNessuna valutazione finora
- Producción de acetona a partir de cumenoDocumento23 pagineProducción de acetona a partir de cumenoAngela Marcela Guevara DelgadoNessuna valutazione finora
- Proceso de Produccion de EtilbencenoDocumento44 pagineProceso de Produccion de EtilbencenoYaramy RestrepoNessuna valutazione finora
- Reactor CSTRDocumento88 pagineReactor CSTRmiriamNessuna valutazione finora
- Informe 2 - Chancado y Tamizado PT 1Documento12 pagineInforme 2 - Chancado y Tamizado PT 1Adorian FārNessuna valutazione finora
- 1universidad Nacional Del Centro Del PerúDocumento91 pagine1universidad Nacional Del Centro Del PerúJenny Ojeda CastillonNessuna valutazione finora
- Codeposición de CobreDocumento11 pagineCodeposición de CobrePercy Daniel Ocaña DiestraNessuna valutazione finora
- HeuristicasDocumento10 pagineHeuristicasFitoFuckNessuna valutazione finora
- Diseño para Reacciones MúltiplesDocumento6 pagineDiseño para Reacciones MúltiplesFRANS ROMONessuna valutazione finora
- Correccion Del Tercer Examen de Termodinamica IiDocumento4 pagineCorreccion Del Tercer Examen de Termodinamica IiBlady MblNessuna valutazione finora
- Síntesis de Dimetil Éter A Partir Del MetanolDocumento2 pagineSíntesis de Dimetil Éter A Partir Del MetanolKaren Flores50% (2)
- Problemas Tad 2018082154Documento5 pagineProblemas Tad 2018082154Jorge Gutierrez AranibarNessuna valutazione finora
- Diseño de reactores químicosDocumento39 pagineDiseño de reactores químicosALEXANDRA MERCEDES BARRIOS CASALINONessuna valutazione finora
- Informe 8 Reactores en Serie OficialDocumento16 pagineInforme 8 Reactores en Serie OficialJean LkNessuna valutazione finora
- Anhidrido Maleico y Ácido MaleicoDocumento13 pagineAnhidrido Maleico y Ácido MaleicoBenjamin López ChacaltanaNessuna valutazione finora
- Problemas Resueltos Capitulo II LevelspielDocumento9 pagineProblemas Resueltos Capitulo II LevelspielDennis Esquivel GarciaNessuna valutazione finora
- Mecanismos enzimáticos y cinética químicaDocumento13 pagineMecanismos enzimáticos y cinética químicaLyn Quinn MimNessuna valutazione finora
- Tarea de Cinetica QuimicaDocumento12 pagineTarea de Cinetica QuimicaLuz Angelica Vera ChavezNessuna valutazione finora
- Revista de Ing. Química Española - 2011Documento12 pagineRevista de Ing. Química Española - 2011Emilio Tafur EspinozaNessuna valutazione finora
- Site Layout and Plant LayoutDocumento2 pagineSite Layout and Plant LayoutEmilio Tafur EspinozaNessuna valutazione finora
- Aiche Journal 2012Documento29 pagineAiche Journal 2012Emilio Tafur EspinozaNessuna valutazione finora
- Informe Secado Grupo ADocumento39 pagineInforme Secado Grupo AEmilio Tafur EspinozaNessuna valutazione finora
- Site Layout and Plant LayoutDocumento2 pagineSite Layout and Plant LayoutEmilio Tafur EspinozaNessuna valutazione finora
- Precios de Los MneralesDocumento1 paginaPrecios de Los MneralesEmilio Tafur EspinozaNessuna valutazione finora
- Calculos MoliendaDocumento36 pagineCalculos MoliendaEmilio Tafur EspinozaNessuna valutazione finora
- Monografía - Mapa de Riesgo y MatrizDocumento27 pagineMonografía - Mapa de Riesgo y MatrizEmilio Tafur EspinozaNessuna valutazione finora
- Percy Flores Rojas: Registrador PúblicoDocumento108 paginePercy Flores Rojas: Registrador PúblicoAll Gong100% (1)
- Secado Grupo ADocumento36 pagineSecado Grupo AEmilio Tafur EspinozaNessuna valutazione finora
- Informe Final-Perdidas de Calor en La Camara de Sacado-Grupo DDocumento34 pagineInforme Final-Perdidas de Calor en La Camara de Sacado-Grupo DEmilio Tafur EspinozaNessuna valutazione finora
- Fil Traci OnDocumento6 pagineFil Traci OnEmilio Tafur EspinozaNessuna valutazione finora
- Fil Traci OnDocumento20 pagineFil Traci OnEmilio Tafur EspinozaNessuna valutazione finora
- Eficiencia ciclón partículasDocumento3 pagineEficiencia ciclón partículasEmilio Tafur EspinozaNessuna valutazione finora
- Filtro de MangasDocumento2 pagineFiltro de MangasEmilio Tafur EspinozaNessuna valutazione finora
- InformeDocumento104 pagineInformeEmilio Tafur EspinozaNessuna valutazione finora
- Eficiencia ciclón partículasDocumento3 pagineEficiencia ciclón partículasEmilio Tafur EspinozaNessuna valutazione finora
- Eficiencia Del CiclónDocumento4 pagineEficiencia Del CiclónEmilio Tafur EspinozaNessuna valutazione finora
- Eficiencia ciclón partículasDocumento3 pagineEficiencia ciclón partículasEmilio Tafur EspinozaNessuna valutazione finora
- Factores Que Afectan La Viscosidad de Un GasDocumento1 paginaFactores Que Afectan La Viscosidad de Un GasEmilio Tafur EspinozaNessuna valutazione finora
- Cálculo de La Altura de Una ChimeneaDocumento10 pagineCálculo de La Altura de Una ChimeneaEmilio Tafur EspinozaNessuna valutazione finora
- Problemas Ambientales BotaderosDocumento3 pagineProblemas Ambientales BotaderosWendy Tafur EspinozaNessuna valutazione finora
- Impactos Ambientales de La Industria PapeleraDocumento3 pagineImpactos Ambientales de La Industria PapeleraEmilio Tafur EspinozaNessuna valutazione finora
- Factores Que Se Requieren Conocer de UnDocumento3 pagineFactores Que Se Requieren Conocer de UnEmilio Tafur EspinozaNessuna valutazione finora
- Cálculo de La Altura de La ChimeneaDocumento2 pagineCálculo de La Altura de La ChimeneaEmilio Tafur EspinozaNessuna valutazione finora
- Eficiencia ciclón partículasDocumento3 pagineEficiencia ciclón partículasEmilio Tafur EspinozaNessuna valutazione finora
- Impactos Ambientales de La Industria PapeleraDocumento3 pagineImpactos Ambientales de La Industria PapeleraEmilio Tafur EspinozaNessuna valutazione finora
- ProblemaDocumento2 pagineProblemaEmilio Tafur EspinozaNessuna valutazione finora
- Guía #4 - Análisis Dimensional IIDocumento6 pagineGuía #4 - Análisis Dimensional IIWilmer Ramos MesaNessuna valutazione finora
- Demostracion de La Ley de Boyle y Volumen Gaseoso MolarDocumento22 pagineDemostracion de La Ley de Boyle y Volumen Gaseoso MolarederNessuna valutazione finora
- Toberias y DifusoresDocumento6 pagineToberias y DifusoresEdwin YugchaNessuna valutazione finora
- Calor de 500g de aguaDocumento11 pagineCalor de 500g de aguaAnibalNessuna valutazione finora
- Central MareomotrizDocumento12 pagineCentral MareomotrizCarlos GuaracaNessuna valutazione finora
- Tubo de Pared Delgada 1Documento4 pagineTubo de Pared Delgada 1Jorge Castro100% (2)
- Practica 5 - Recubrimientos ElectroliticosDocumento4 paginePractica 5 - Recubrimientos Electroliticosnaydelin martinezNessuna valutazione finora
- Bomba CalorimetricaDocumento9 pagineBomba CalorimetricaGonzalo HRNessuna valutazione finora
- Ley de HessDocumento7 pagineLey de HessAndres Camilo Moreno GarciaNessuna valutazione finora
- Guia de Momento PDFDocumento2 pagineGuia de Momento PDFAllan HernadezNessuna valutazione finora
- Pag 7Documento3 paginePag 7adrian marceloNessuna valutazione finora
- Tecnica RadiograficaDocumento16 pagineTecnica RadiograficaYenn GNessuna valutazione finora
- Taller Tipos de Reaccion y BalanceoDocumento4 pagineTaller Tipos de Reaccion y BalanceoACERO RODRIGUEZ JULIANANessuna valutazione finora
- PRACTICA 7 - EyMDocumento24 paginePRACTICA 7 - EyMOSCAR JOSUE VAZQUEZ GUZMANNessuna valutazione finora
- Placas 2 Direcciones Segundo CorteDocumento32 paginePlacas 2 Direcciones Segundo CortewreycarrilloNessuna valutazione finora
- Trabajo Colaborativo 1Documento4 pagineTrabajo Colaborativo 1Mario Alfonso Escudero100% (1)
- Informe de FisioquimicaDocumento24 pagineInforme de FisioquimicaSalinas Ampudia RoqueNessuna valutazione finora
- Comportamiento de Los Gases DMGDocumento2 pagineComportamiento de Los Gases DMGAzul GarciaNessuna valutazione finora
- Pandeo Lateral TorsionalDocumento3 paginePandeo Lateral TorsionalANDERSONNessuna valutazione finora
- Sol I Eval Operaciones I Paredes IqiDocumento3 pagineSol I Eval Operaciones I Paredes IqiMarlon ParedesNessuna valutazione finora
- Trabajo Encargado de PavimentosDocumento10 pagineTrabajo Encargado de Pavimentosjose pablo porras lejaboNessuna valutazione finora
- Procesos Que Cambian La Superficie Del Material.Documento11 pagineProcesos Que Cambian La Superficie Del Material.sugar25Nessuna valutazione finora
- Unidad IDocumento34 pagineUnidad IRosa Isela Martinez VelazquezNessuna valutazione finora
- Errores Con Receptores GpsDocumento2 pagineErrores Con Receptores Gpsana1516Nessuna valutazione finora
- Efecto Peltier PDFDocumento19 pagineEfecto Peltier PDFJosé Vergara PáezNessuna valutazione finora
- Practicas de Fisica Laboratorio 2 ALTO AZCDocumento92 paginePracticas de Fisica Laboratorio 2 ALTO AZCRenato MendozaNessuna valutazione finora
- DCR 2019 ElectricaDocumento32 pagineDCR 2019 ElectricaGaston Ezequiel RimbanoNessuna valutazione finora