Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Capitulo II Castellan
Caricato da
Léo AyolCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Capitulo II Castellan
Caricato da
Léo AyolCopyright:
Formati disponibili
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
1
II
PROPIEDADES EMPRICAS DE LOS GASES
2-1. Cinco gramos de etano se encuentran dentro de un bulbo de un litro de capacidad. El bulbo es tan dbil
que se romper si la presin sobrepasa las 10 atmsferas. A qu temperatura alcanzar la presin del
gas el valor de rompimiento?
Datos:
Masa Etano = 5g
Si P > 10 atm. el bulbo se romper
Solucin:
PV = nRT Ecuacin II - 1
Ecuacin II - 2
Despejando T de la Ecuacin II-1 y sustituyendo en la Ecuacin II-2, tenemos
2-2. Un gran cilindro para almacenar gases comprimidos tiene un volumen aproximado de 1.5 pies
3
. Si el gas
se almacena a un presin de 150 atm a 300K, cuntos moles de gas contiene el cilindro? Cul sera el
peso del oxgeno en un cilindro de esta naturaleza?
Datos:
V = 1.5 pies
3
P = 150 atm
T = 300 K
Solucin
a) Cuntos moles de gas contiene el cilindro?
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
2
a
b
b) Cul sera el peso del oxgeno en un cilindro de esta naturaleza?
Despejo m de la Ecuacin II-2
m = nM
m = (258.84 moles) (32 g/mol)
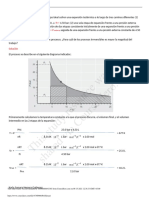
2-3. En el sistema ilustrado en la fig. 2-13 se halla contenido helio a 30.2C. El bulbo de nivelacin L se puede
levantar para llenar el bulbo inferior con mercurio y forzar la entrada del gas a la parte superior del
dispositivo. El volumen del bulbo 1 hasta la marca b es de 100.5 cm
3
y el del bulbo 2 entre las marcas a y
b es de 110.0 cm
3
. La presin del helio se mide por la diferencia entre los niveles del mercurio en el
dispositivo y en el brazo evacuado del manmetro. Cuando el nivel del mercurio est en a la presin es
20.14 mm de Hg. Cul es la masa de helio en el recipiente?
Datos:
mHe = 4g/mol
T = 30,2C = 303,35K
V
1
= 100,5 cm
3
V
2
= 110,0 cm
3
P
a
= 20,14mm Hg = 0,0265 atm
Fig. 2 - 13
Solucin:
V Total de He
V
1
+ V
2
= 100,5 + 110,0 = 210,5 cm
3
= 0,2105L
V2
V1
C
m = 8282,88g
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
3
Despejo m de la Ecuacin II-2 y sustituyendo en la Ecuacin II-1
2-4. Se emplea el mismo tipo de aparato usado en el problema anterior. En este caso no se conoce el volumen
V
1
, el volumen en el bulbo 2, V
2
, es 110.0 cm
3
. Cuando el nivel del mercurio est en a la presin es 15.42
mm de Hg. Cuando el nivel del mercurio se eleva a b la presin del gas es 27.35 mm Hg. La temperatura
es 30.2C.
a) Cul es la masa de helio en el sistema?
b) Cul es el volumen del bulbo 1?
Datos:
V
2
= 110.0 cm
3
= 0,11 L
P
a
= 15.42 mm de Hg = 0,020 atm
P
b
= 27.35 mm de Hg = 0,036 atm
T = 30.2 C = 303,35 K
Solucin:
a) Despejo m de la Ecuacin II-2 y sustituyendo en la Ecuacin II-1
b) P
a
V
a
= nRT
P
a
(V
1
+ V
2
) = PbV
1
0,020 atm (V
1
+ 0,11 L ) = 0,036 V
1
0,020 atm V
1
+ 2,23 10
3
= 0,036 V
1
2,23 10
3
= 0,016 V
1
2-5. Supongamos que al establecer las escalas de los pesos atmicos las condiciones de referencia escogidas
hayan sido Po. = 1 atm, Vo. = 30.000 litros y To =300.00 K. Calcular la "constante del gas", el "nmero
de Avogadro" y las masas de un "nmero de Avogadro" de tomos de hidrgeno y de oxgeno.
V
1
= 0,142 L
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
4
Datos:
P
0
= 1 atm
V
o
= 30.000 L
T
o
= 300.00 K
Solucin:
2
1 1
T
V P
R = Ecuacin II - 3
K mol
atm lt
01 . 0
K 300
lt/mol) (30 ) atm 1 (
= = R
2187 . 1
082057 . 0
100 . 0
0
1
1 0
1 1
= = = =
R
R
T R
V P
n
N
1
= (6.023 10
23
)(1.2187) = 7.34 10
23
molculas/mol
Para el Hidrgeno
6.023 10
23
0
H
M = 1 g/mol
7.34 10
23
0
H
M
Para el Oxgeno
6.023 10
23
0
O
M = 16 g/mol
7.34 10
23
1
O
M
g/mol 218 . 1
10 023 . 6
10 34 . 7
23
25
1
=
=
H
M
1
O
M mol g / 488 . 19 16
10 023 . 6
10 34 . 7
23
23
=
=
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
5
2-6. El coeficiente de expansin trmica est definido por = (1/V)( V/T)
P
. Aplicando la ecuacin de estado
calcular el valor de para un gas ideal.
p
nRT
V = Ecuacin II - 4
Derribo la Ecuacin (II-4) con respecto a la temperatura T manteniendo la presin constante
(
Ecuacin II - 5
(
) (
Ecuacin II - 6
Reemplazo la Ecuacin (II-5) en la Ecuacin (II-6)
p
nR
V
1
= o
Como la ecuacin de estado
T pV
nR 1
=
Por lo tanto
2-7. El coeficiente de compresibilidad est definido por ( )( )
T
P V V c c = / / 1 | Calcular el valor de |
para un gas ideal.
Derribo la Ecuacin (II-4) con respecto a la presin manteniendo la temperatura constante
(
Ecuacin II - 7
T
1
= o
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
6
(
) (
Ecuacin II - 8
Reemplazo la Ecuacin (II-7) en la Ecuacin (II-8)
(
) (
)
Segn la Ecuacin de estado
1 =
pV
nRT
Por lo tanto
2-8. Expresar la derivada (p/T)
V
de un gas en funcin de o y | .
De la ecuacin de estado se obtiene que
V
nR
T
P
=
c
c
T
p
V
nR
=
2-9. Un gramo de N
2
y 1 g de O
2
se colocan en un frasco de 2 litros a 27C. Calcular la presin parcial de cada
gas, la presin total y la composicin de la mezcla en moles por ciento.
Datos:
mN
2
= 1 g
mO
2
= 1 g
V = 2 L
P
1
= |
|
o
= = |
.
|
\
|
c
c
p
T T
P
V
1
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
7
T = 27C = 300,15 K
V
RT
n p
i i
= Ecuacin II - 9
pr x p
i i
= Ecuacin II - 10
r
i
i
n
n
x = Ecuacin II - 11
De la ecuacin (II-9) tenemos para el N
2
y para el O
2
06696 , 0
32
1
28
1
= + =
T
n
Utilizando la Ecuacin (II-11)
( )
466 . 0
06696 . 0
32 / 1
2
= =
o
x
( )
533 . 0
06696 . 0
28 / 1
2
= =
N
x
Composicin Molar
atm 4398 , 0
lt 2
) 15 , 300 (
K mol
atm lt
082057 . 0
gr/mol 28
gr 1
2
=
|
|
.
|
\
|
=
K
P
N
atm 3848 , 0
2
) 15 , 300 27 )( 082057 . 0 (
32
1
2
=
+
|
.
|
\
|
=
O
p
P
T
= PN
2
+ Po
2
= 0,4398 + 0,3848 = 0,8246 atm
% 6 . 46 100 %
2 2
= =
o o
x n
% 3 . 53 100 %
2 2
= =
N N
x n
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
8
2-10. Un gramo de H
2
y 1 g de 0
2
se colocan en una botella de dos litros a 27C. Calcular la presin parcial de
cada gas y la presin total al igual que la composicin de la mezcla en moles por ciento. Comparar estos
resultados con los del problema 2-9.
Datos:
mN
2
= 1 g
mO
2
= 1 g
V = 2 L
T = 27C = 300,15 K
5313 . 0
32
1
2
1
= + =
r
n
941 . 0
5313 . 0
) 2 / 1 (
2
= =
H
x 0588 . 0
5313 . 0
) 2 / 1 (
2
= =
o
x
Comparacin:
La diferencia con los resultados del problema anterior se debe a que tenemos las mismas masas pero diferentes
pesos moleculares, lo que hace que haya muchas ms moles de H
2
que de O
2
ya que es bastante ms ligero.
Entre N
2
y O
2
la diferencia no es tan fuerte.
15 . 6
2
) 15 . 300 )( 082054 . 0 (
2
= =
N
p atm
3848 . 0
2
) 15 . 300 )( 082054 . 0 (
2
= =
o
p atm
534 . 6
2 2
= + =
o N T
p p p atm
% 1 . 94 100 %
2 2
= =
H H
x n
% 88 . 5 100 %
2 2
= =
o o
x n
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
9
2-11. Le agrega una mezcla de nitrgeno y vapor de agua a un recipiente que contiene un agente secante
slido. Inmediatamente despus, la presin en el recipiente es de 760 mm Hg. Luego de algunas horas, la
presin alcanza un valor constante de 745 mm Hg
a) Calcular la composicin de la mezcla original en moles por ciento
b) Si el experimento se realiza a 20C y el agente secante aumenta su peso en 0.150 g, Cul es el
volumen del frasco? (se puede despreciar el volumen ocupado por el agente secante).
Datos:
mN
2
= 1 g
mO
2
= 1 g
V = 2 L
T
= 27C = 300,15K
Solucin:
a) El agente secante absorbe el vapor de agua y por eso es que, al cabo de un tiempo, la presin total
disminuye pues la presin del agua desaparece.
Pi = PN
2
+ PH
2
O
Pf = PN
2
Haciendo uso de las ecuaciones (II-10) y (II-11)
98 . 0
760
745
2
2
= = = =
i
f
T
N
N
p
p
p
p
x
02 . 0
760
745 760
2
2
=
= =
i
f i
T
O H
O N
p
p p
p
p
x
b) El aumento en peso del agente se debe al agua absorbida
Utilizando la ecuacin II-9
% 98 %
2
=
N
n
% 2 %
2
=
O H
n
156 . 10
) 760 / 15 (
) 15 . 273 20 )( 082054 . 0 (
18
15 . 0
2 2
2
=
+
|
.
|
\
|
=
|
|
.
|
\
|
=
O H O H
O H
p
RT
M
m
V L
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
10
2-12. Se analiza una mezcla de oxgeno e hidrgeno pasndola sobre xido de cobre caliente y por un tubo
secante. El hidrgeno reduce el CuO segn la ecuacin CuO + H
2
Cu + H
2
O; el oxgeno reoxidiza el
cobre formado: Cu + O
2
CuO. 100 cm
3
de la mezcla, medidos a 25C y 750 mm producen 84.5 cm
3
de oxgeno seco, medidos a una temperatura de 25C y 750 mm despus de su paso sobre el CuO y el
agente secante. Cul es la composicin original de la mezcla.
Datos:
V
T
= 100 cm
3
= 0.1 L
T = 25C = 298 K
P
T
= 750 mm Hg = 0.9868 atm
= 84.5 cm
3
= 0.0845 L
Solucin:
Segn la ley de Hez tenemos:
CuO + H
2
Cu + H
2
O
Cu + O
2
CuO
H
2
+ O
2
H
2
O
x + y
Ecuacin II - 12
n
T
= 4.034
moles
Moles de oxgeno que salen
Ecuacin II - 13
salen
= 3.408
moles
n
T
= x + y +
salen
n
T
= x + x/2 +
salen
n
T
= 3/2 x +
salen
3/2 x = n
T
-
salen
x = 2/3 (4.034
- 3.408
) moles
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
11
x = 4.173
= moles H
2
entran
= n
T
+ x
entran
= 4.034
- 4.173
entran
= 3.617
moles
Composicin original de la mezcla
Ecuacin II - 14
2-13. Demostrar que ( ) ( ) ( ) | | ... / / / /
2 2 1 1
+ + = M y M y M y x
i i i
, en donde
i
X
1
y y
i
M son la fraccin
molar, el porcentaje del peso y el peso molecular del componente i respectivamente.
i
i
i
M
m
n =
T
i
i
n
n
x =
100
T
i
i
m
m
y =
Combinando estas relaciones
...
2 1
+ + = n n n
T
i
i T
i
M
y m
n
100
=
= 10.34%
= 89.66 %
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
12
...
100 100
2
2 1
+ + =
M
y m
M
y m
n
T
i
T
T
=
+
= =
...
100 100
100
2
2 1
1
M
y m
M
y m
M
y m
n
n
x
T
i
T
i
T
T
i
i
|
|
.
|
\
|
+ + ...
100
100
2
2 1
1
M
y
M
y m
M
y m
i
T
i
T
2-14. Una mezcla de gases est compuesta de etano y butano. Se llena un bulbo de 200 cm
3
de capacidad con la
mezcla a una presin de 750 mm y 20C. Si el peso del gas en el bulbo es 0.3846 g, cul es el porcentaje
molar de butano en la mezcla?
Datos:
V = 200 cm
3
= 0.2 L
T = 20C = 293.15 K
P
= 750 mm Hg = 0.9868 atm
m
= 0.3846 g
= 30g/mol
= 58g/mol
Solucin:
Ecuacin II - 15
Ecuacin II - 16
Ecuacin II - 17
Ecuacin II - 18
....
2
2
1
1
+ +
=
M
y
M
y
M
y
i
i
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
13
Reemplazo la Ecuacin (II-18) en la Ecuacin (II-16)
Ecuacin II - 19
8.20
Reemplazo el valor de
en la Ecuacin (II-19)
0.3846 = 30(
0.3846 = 0.2461
= 0.1385
= 4.945
moles
De la Ecuacin (II-18) obtengo
3.255
moles
= 0.3970
= 0.6030
2-15. Un bulbo de 138.2 ml contiene 0.6946 g de gas a 756.2 mm y 100C. Cul es .el peso molecular del gas?
Datos:
V = 138.2 ml = 0.1382 L
m
= 0.6946 g
P
= 756.2 mm Hg = 0.995 atm
T = 100C = 373.15 K
= 39.70%
= 60.30%
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
14
Solucin:
2-16. Suponiendo que el aire tiene un peso molecular promedio de 28.8 y que la atmsfera es isotrmica a
25C, calcular la presin baromtrica en Guadalajara (Mxico), ciudad que se encuentra a 1567 m sobre
el nivel del mar; calcular la presin baromtrica en Cerro del Pasco (Per), 4259 m sobre el nivel del
mar. La presin a nivel del mar es de 760 mm.
Datos:
= 28.8 g/mol
T = 25C = 298 K
Solucin:
p =
RT Mg
o
e p
/ Z
Ecuacin II - 20
(p
0
presin a nivel del suelo)
) 15 . 298 10 3144 . 8 /( ) 10 1567 )( 980 )( 8 . 28 (
7 2
760
= e p
Guad
) 15 . 298 10 3144 . 8 /( ) 10 4259 )( 980 )( 8 . 28 (
7 2
760
= e p
pasco
M gr/mol 57 . 154 =
= 635.81 mm
= 467.97 mm
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
15
2-17.La composicin aproximada de la atmsfera a nivel del mar est dada por la siguiente tabla:
Gas Porcentaje en
moles
Nitrgeno 78,09
Oxgeno 20,93
Argn 0,93
Dixido de carbono 0,03
Nen 0,0018
Helio 0,0005
Criptn 0,0001
Hidrgeno 5 x 10
-5
Xenn 8 x IO
-6
Ozono 5 x IO
-5
Despreciando las cuatro ltimas componentes, calcular las presiones parciales del resto, la presin total y la
composicin de la atmsfera en moles por ciento a alturas de 50 y 100 km (t 25C).
Ecuacin II - 21
Ecuacin II - 22
Mi X
io
P
io
P
i
xi
N
2
28 0.7809 0.7809 3.1 10-
3
89.08
O
2
32 0.2093 0.2093 3.74 10
4
10.75
Ar 40 0.0093 0.0093 3.42 10
-6
0.10
C0
2
44 0.0003 0.0003 5.0 10-
8
0.0014
Ne 20 0.000018 0.000018 3.45 10-
7
0.0099
He 4 0.000005 0.000005 2.27 10-
6
0.652
50 Km
P
T
= 3.48 10
-3
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
16
2-18.Cul debe ser el peso molecular de un gas para que la presin del gas disminuya la mitad de su valor a
una distancia vertical de un metro? (t 25C) Qu tipos de molculas tienen pesos moleculares de esta
magnitud?
Datos:
T = 25C = 298 K
Solucin:
A partir de la Ecuacin (II-21) tenemos
2-19.Considerar un "gas ideal de papas" que tiene las siguientes propiedades: obedece la ley del gas ideal, las
partculas individuales pesan 100 g pero no ocupan volumen; es decir, son masas puntuales.
a) A 25 C, calcular la altura a la cual el nmero de papas por centmetro cbico disminuye a una
millonsima parte de su valor a nivel del suelo.
b) Sabiendo que las papas ocupan volumen, hay alguna correlacin entre el resultado del clculo en (a) y
la distribucin espacial observable de las papas en una bolsa de papel?
1.22
87.71
6.71
4.82
1.26
0.0091
8.38
0.0001
6.63
0.0477
1.03
7.4047
100 km
P
T
= 1.391 10
-5
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
17
b) S hay correlacin ya que la altura obtenida en a) es despreciable, lo que implica que todas las papas estn
en el suelo y esto es lo que observamos.
2-20.Expresar las presiones parciales en una mezcla de gases (a) en funcin de las concentraciones molares C
i
(b) en funcin de las razones molares r
i
.
Solucin:
P
n
n
P X P
T
i
i i
= = Ecuacin II - 23
De la ecuacin de estado se tiene
V
RT
n
P
T
= Ecuacin II - 24
Reemplazo la Ecuacin (II-24) en la Ecuacin (II-23)
RT
V
n
P
i
i
= Ecuacin II - 25
La concentracin se define como
V
n
C
i
i
= Ecuacin II - 26
Ecuacin II - 27
Las razones molares se definen como
1
n
n
r
i
i
= Ecuacin II - 28
RT C P
i i
=
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
18
Se tiene
1 1
1
n
n
n
n
r
T
i
i
= = +
Ecuacin II - 29
( )
i
T
i
i
i
X
n
n
r
r
= =
+
1
2-21. Si a una altura h dada, la presin de un gas es
h
P y la presin a z=0 es
0
P , demostrar que a cualquier
altura, z,
z
h
o
f P P = donde
0
P
P
f
z
=
Datos:
Demostrar:
z
h
o
f P P =
0
P
P
f
z
=
Solucin:
h
RT
Mg
RT
Mgh
h
e P e P P ) (
0 0
= = Ecuacin II - 30
Z
RT
Mg
z
e P P ) (
0
= Ecuacin II - 31
Z
z
RT
Mg
P
P
e
1
0
|
|
.
|
\
|
=
Ecuacin II - 32
( )
+
= =
i
i
i i
r
P X P
1
Pr
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
19
Reemplazo la Ecuacin (II-32) en la Ecuacin (II-31)
2.22.Al morir Julio Csar, su ltima exhalacin tena un volumen de 500 cm
3
aproximadamente. Esta cantidad
tena 1 mol % de argn. Supngase que la temperatura era de 300
o
K y que la presin a nivel del suelo era
1 atm. Supngase que la temperatura y la presin son uniformes sobre la superficie y aun tienen esos
valores. Si las molculas exhaladas por Csar han permanecido todas en la atmosfera terrquea y se han
esparcido completamente a travs de ella, cuntas inhalaciones de 500 cm
3
cada una debemos realizar en
promedio para inhalar una de las molculas de argn de Csar.
Datos:
V = 500 cm
3
T = 300
K
P = 1atm
JC
n
= 0.01
Solucin:
V
atm
= rea de la superficie terrestre x altura = z r
2
4t
dz r e n n
RT
Mgz
JC JC
2
0
0
4t
}
= Ecuacin II - 33
2 0
4 r
Mg
RT
n n
JC JC
t = Ecuacin II - 34
Despejando
0
JC
n tenemos
2
0
4 r RT
Mgn
n
JC
JC
t
= Ecuacin II - 35
4
10 * 031 . 2
) 300 )( 082 . 0 (
) 5 . 0 )( 1 (
01 . 0 01 . 0
= = =
RT
PV
n
JC
0
0 0
N n N
JC JC
= Ecuacin II - 36
Z
h
z
z
P
P
P P
|
|
.
|
\
|
=
0
0
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
20
Sustituyo la Ecuacin (II-36) en la Ecuacin (II-35)
0
2
0
4
N
r RT
Mgn
N
JC
JC
t
= Ecuacin II - 37
) 300 )( 10 * 314 . 8 )( 10 * 37 . 6 ( 4
) 10 * 023 . 6 )( 980 )( 948 . 39 (
7 8
23
0
t
=
JC
N
inhalacin
moleculas
inhalacin
cm
cm
molculas
N
JC
0188 . 0 500 *
3
3
0
=
Nmero de inhalaciones necesarias para aspirar una molcula de Julio Cesar, es decir
2-23.a) Demostrar que si calculamos el nmero total de molculas de un gas en la atmosfera aplicando la
formula baromtrica obtendramos el mismo resultado que al suponer que el gas tiene una presin a
nivel del suelo hasta una altura z=RT/Mg y que la presin es cero por encima de este nivel.
b) Demostrar que la masa total de la atmosfera terrestre est dada por Ap
0
/g, donde p
o
es la presin
total a nivel del suelo y A es el rea de la superficie terrestre. Ntese que este resultado no depende de
la composicin de la atmsfera. (Resolver este problema calculando primero la masa de cada
constituyente, fraccin molar Xi, peso molecular Mi, y sumar. Luego, examinando el resultado,
resolverlo de la manera ms fcil.)
c) Si el radio promedio de la tierra es 6.3710
8
cm, g=980 cm/seg
2
, y P
o
= 1atm, calcular la masa de la
atmosfera en gramos.
Datos:
a) Z = RT/Mg
b) M
T
= AP
0
/g
c) r = 6.37*10
8
cm
g = 980 cm/seg
2
Po = 1atm
Solucin:
a) Adz n dn
1
0
= Ecuacin II - 38
}
=
Z
Adz n n
0
1
0
Az n
1
0
=
Mg
RT
A n
1
0
= Ecuacin II - 39
molcula
es inhalacion
inhalacin
moleculas
31 . 53
0188 . 0
1
=
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
21
dz Ae n dn
RT
MgZ
=
1
0
Ecuacin II - 40
El nmero total de molculas en la atmsfera ser
}
=
0
1
0
dz e A n n
RT
MgZ
Ecuacin II - 41
Ecuacin II - 42
b) De acuerdo con la ley de distribucin baromtrica, la masa del componente i de la atmosfera en una
fraccin diferencial ser
Adz e dm
RT
Mgz
oi i
= Ecuacin II - 43
g M
RT
A Adz e m
i
oi
RT
Mgz
oi i
}
= =
0
Ecuacin II - 43
De la ecuacin de estado sabemos que
RT
P M
oi i
oi
= Ecuacin II - 44
Reemplazo la Ecuacin (II-44) en la Ecuacin (II-43)
g
A P
m
oi
i
= Ecuacin II - 45
Ecuacin II - 42
c) La superficie de la tierra es 4r
2
, por lo tanto,
Mg
RT
A n n
1
0
=
= = = =
o oi
oi
i T
P
g
A
P
g
A
g
A P
m m
g
seg cm
cm
cm
dinas
m
T
21
2
2 2 8
2
6
10 * 27 . 5
/ 980
) 10 * 37 . 6 ( 4 ) 10 * 01325 . 1 (
= =
t
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
22
2-24.Puesto que los gases atmosfricos se distribuyen diferentemente segn sus pesos moleculares, el
porcentaje promedio de cada gas es diferente del porcentaje a nivel del suelo; los valores, Xi, de las
fracciones molares a nivel del suelo se suministran a continuacin.
a) Deducir una relacin entre la fraccin molar promedio del gas en la atmosfera y las fracciones
molares a nivel del suelo
b) Si las fracciones molares de N2, O2 y Ar a nivel del suelo son 0.78 ; 0.21 y 0.01 respectivamente,
calcular las fracciones molares promedio de N2, O2 y A en la atmosfera.
c) Demostrar que la fraccin de peso promedio de cualquier gas en la atmosfera es igual a su fraccin
molar a nivel del suelo.
Datos:
b) X
N2
= 0.78
X
O2
= 0.21
X
Ar
= 0.01
Solucin:
a)
nT
ni
Xi = Ecuacin II - 43
Adz e n dn
RT
MgZ
i i
=
0
Ecuacin II - 44
g M
RTA
n n
i
i i
0
= Ecuacin II - 45
= = =
i
i
i
i i i
M
n
g
ART
g M
RTA
n n n
0
0 0
Ecuacin II - 46
Reemplazo la Ecuacin (II-45) y Ecuacin (II-46) en la Ecuacin (II-43)
g
ART
M
n
g
ART
M
n
X
i
i
i
i
i
= Ecuacin II - 47
0
0
T
i
n
n
Xi = Ecuacin II- 48
Ecuacin II - 49
= =
i
i
i
i
i
T i
i
T i
i
M
X
M
X
M
n X
M
n X
X
0
0
0 0
0 0
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
23
b) Aplicando la Ecuacin (II-49)
= + + = 03468 . 0
40
01 . 0
32
21 . 0
28
78 . 0
0
i
i
M
X
804 . 0
03468 . 0
28
78 . 0
2
= =
N
X
189 . 0
03468 . 0
32
21 . 0
2
= =
O
X
c) La fraccin de peso promedio
= =
T
iT
i
W
W
f Masa total de i en la atmosfera/ masa total en la atmosfera
De los resultados obtenidos en el inciso a), tenemos que,
i iT iT
M n W =
i i
i
M n
gM
ART
0
0
i
n
g
ART
Ecuacin II - 50
0 0 0
T i i iT T
n
g
ART
n
g
ART
n
g
ART
W W
= = = = Ecuacin II - 51
Por lo tanto
007 . 0
03468 . 0
40
01 . 0
= =
Ar
X
0
0
0
i
T
i
i
X
n
g
ART
n
g
ART
f = =
CAPTULO 2 PROPIEDADES EMPRICAS DE LOS GASES
24
Z
0
2-25.Considrese una columna de gas en un campo gravitatorio. Calcular la altura Z determinada por la
condicin de que la masa de la columna est situada debajo de Z.
Solucin:
Consideremos un rea transversal de 1cm
2
. La masa total en la seccin diferencial dz ser
dz e m dm
RT
MgZ
=
0
Ecuacin II - 52
Integrando hasta una altura Z, tenemos
m(Z)= -m
0
RT MgZ
e
Mg
RT
/
m(Z) = -m
0
| |
RT MgZ
e
Mg
RT
/
1
La masa total la obtendremos integrando hasta infinito,
mT= m(Z=) = m
0
Mg
RT
| |
RT MgZ
e
mT
Z m
/
1
) (
=
M(Z) = mT/2
RT MgZ
e
/
1
2
1
=
Z= 2 ln
Mg
RT
Potrebbero piacerti anche
- Actividad 4. TermodinámicaDocumento5 pagineActividad 4. TermodinámicaHola25% (8)
- Ejercicios de TransferenciaDocumento2 pagineEjercicios de TransferenciaVanessa Porco Flores50% (2)
- Formulación MagistralDocumento91 pagineFormulación Magistraljewi88% (8)
- Deber Final1Documento13 pagineDeber Final1Wilson Guachamin0% (2)
- Problemas Equilibrio QuimicoDocumento3 pagineProblemas Equilibrio QuimicoDani FPNessuna valutazione finora
- Ejerc Semana10Documento26 pagineEjerc Semana10ALEJANDRA LUCERO MEJ�A CRUZNessuna valutazione finora
- ProblemasDocumento2 pagineProblemasJoseph Sulca MartinezNessuna valutazione finora
- Informe 7. Determinación Del Porcentaje de Amoniaco en Una Sal de AmonioDocumento8 pagineInforme 7. Determinación Del Porcentaje de Amoniaco en Una Sal de AmonioIgnacio Tapia100% (2)
- Plancha Electrica de VaporDocumento12 paginePlancha Electrica de VaporSam C. CordovaNessuna valutazione finora
- Serie de Ecuación de Gases Reales 21-IDocumento6 pagineSerie de Ecuación de Gases Reales 21-IDaniela Gonzalez100% (2)
- Asiv Tarea 1Documento9 pagineAsiv Tarea 1Andrea Sarahi Izquiy VNessuna valutazione finora
- Definiciones termodinámicas básicasDocumento21 pagineDefiniciones termodinámicas básicasDiana AvilaNessuna valutazione finora
- Ejercicios PhotoshopDocumento127 pagineEjercicios PhotoshopEdwards León ParedesNessuna valutazione finora
- Jack Taller 3Documento7 pagineJack Taller 3Jack Fernandez Langs100% (1)
- Prueba 1Documento8 paginePrueba 1Samanta MeloNessuna valutazione finora
- Problemas de DaltonDocumento4 pagineProblemas de DaltonEduardo MariscalNessuna valutazione finora
- Calculo ErturkeDocumento10 pagineCalculo ErturkeSofía MartínezNessuna valutazione finora
- Trabajo Teoria 1 Quimica AnaliticaDocumento24 pagineTrabajo Teoria 1 Quimica AnaliticaJordan Heyner Rodriguez IparraguirreNessuna valutazione finora
- Fisicoquimica Parte 2Documento18 pagineFisicoquimica Parte 2melissa acostaNessuna valutazione finora
- Gases IdealesDocumento21 pagineGases Idealesraul medinaNessuna valutazione finora
- Informe 3. Determinación de La Constante Universal de Los GasesDocumento3 pagineInforme 3. Determinación de La Constante Universal de Los GasesveronicaNessuna valutazione finora
- Sustitución Electrofilica Aromática - Síntesis Acido M - NitrobenzoicoDocumento6 pagineSustitución Electrofilica Aromática - Síntesis Acido M - NitrobenzoicoEdwin Montenegro0% (3)
- Informe 4 - Grupo FDocumento8 pagineInforme 4 - Grupo FSmith MuenalaNessuna valutazione finora
- Ejercicios Química Orgánica Secuencia ReaccionesDocumento31 pagineEjercicios Química Orgánica Secuencia ReaccionesLuis CorderoNessuna valutazione finora
- Taller Propiedades PeriodicasDocumento12 pagineTaller Propiedades PeriodicasSandra NarváezNessuna valutazione finora
- Equilibrio termodinámico, constantes de actividad y equilibrio ácido-baseDocumento13 pagineEquilibrio termodinámico, constantes de actividad y equilibrio ácido-baseStiven AlvarezNessuna valutazione finora
- 2024-1 Serie de Problemas Restantes Unidad 3Documento10 pagine2024-1 Serie de Problemas Restantes Unidad 3gabriel.12zzaNessuna valutazione finora
- EJERCICIOSDocumento22 pagineEJERCICIOSYORDI ALDAIR LAVADO FLORESNessuna valutazione finora
- Guia Ley de Difusión de GrahamDocumento12 pagineGuia Ley de Difusión de GrahamErnesto Alejandro Colin HerreraNessuna valutazione finora
- Cálculo de la energía interna y el trabajo en una expansión isotérmica de un gas de Van der WaalsDocumento26 pagineCálculo de la energía interna y el trabajo en una expansión isotérmica de un gas de Van der WaalsKevin Peredo HidalgoNessuna valutazione finora
- Deberes Unidad 1 Modelo Lineal DANIELA ADocumento13 pagineDeberes Unidad 1 Modelo Lineal DANIELA ADaniela A QuezadaNessuna valutazione finora
- Informe #10 Fisicoquimica IiDocumento17 pagineInforme #10 Fisicoquimica IiMaría de los Ángeles Moreno Coronado100% (1)
- Informe #1 Peso Molecular de Un Líquido VolátilDocumento4 pagineInforme #1 Peso Molecular de Un Líquido VolátilDavid HernándezNessuna valutazione finora
- Ayuda AnaliticaDocumento21 pagineAyuda AnaliticaIvana Utreras100% (1)
- Tarea de QuimicaDocumento23 pagineTarea de QuimicaAbigail CortezNessuna valutazione finora
- INFORME 2. Determinación Del Porcentaje de Amoniaco en Una Sal de AmonioDocumento4 pagineINFORME 2. Determinación Del Porcentaje de Amoniaco en Una Sal de AmoniobyronNessuna valutazione finora
- Aporte Individual Fisicoquímica Angela Fernanda PerezDocumento4 pagineAporte Individual Fisicoquímica Angela Fernanda PerezJuan Camilo TamayoNessuna valutazione finora
- Variación de entropía reacciones químicasDocumento35 pagineVariación de entropía reacciones químicasBryan Calderon OcampoNessuna valutazione finora
- PRÁCTICA 2. Determinacion Del Punto de EbullicionDocumento27 paginePRÁCTICA 2. Determinacion Del Punto de EbullicionChristian Torres Chávez100% (1)
- Ejercicios de entropía y cambios de faseDocumento3 pagineEjercicios de entropía y cambios de faseRoosvel Soto DiazNessuna valutazione finora
- Tarea6 FQ DavidMolinaPerez M1G2 PDFDocumento43 pagineTarea6 FQ DavidMolinaPerez M1G2 PDFNach ScratchNessuna valutazione finora
- Refracción Molar de MezclasDocumento3 pagineRefracción Molar de MezclasJazmin ELNessuna valutazione finora
- Serie 1Documento3 pagineSerie 1Fernando GuzmanNessuna valutazione finora
- Tarea 4Documento7 pagineTarea 4Monserrat HernandezNessuna valutazione finora
- Nitración de la acetanilidaDocumento34 pagineNitración de la acetanilidaKathyCortezNuñezNessuna valutazione finora
- 4.4 Entropía Absoluta y 3 Ley de La TermodinámicaDocumento7 pagine4.4 Entropía Absoluta y 3 Ley de La TermodinámicaDario Pérez IslasNessuna valutazione finora
- Una Araña de Agua de 2Documento7 pagineUna Araña de Agua de 2Claudia BolijeNessuna valutazione finora
- Fisico QuimicaDocumento3 pagineFisico Quimicamarco antonioNessuna valutazione finora
- Guía 7. Equilibrio de Fases Monocomponente Y Diagramas de Fases. Competencias EspecíficasDocumento15 pagineGuía 7. Equilibrio de Fases Monocomponente Y Diagramas de Fases. Competencias EspecíficasAngie Belen ErreisNessuna valutazione finora
- Práctica 4 FisicoquímicaDocumento9 paginePráctica 4 FisicoquímicaFranco ZeligNessuna valutazione finora
- Taller 3cer CorteDocumento12 pagineTaller 3cer CorteLaura Carmona.Nessuna valutazione finora
- Estereoselectividad RegioselectividadDocumento11 pagineEstereoselectividad RegioselectividadMau OrtegaNessuna valutazione finora
- Ley de BoyleDocumento2 pagineLey de BoyleEnzoNessuna valutazione finora
- Sintesis de P-YodoanilinaDocumento12 pagineSintesis de P-YodoanilinaAlondra Vargas100% (1)
- Peróxidos en SolventesDocumento3 paginePeróxidos en Solventescristian lopezNessuna valutazione finora
- Síntesis de B-Nerolina mediante reacción de WilliamsonDocumento7 pagineSíntesis de B-Nerolina mediante reacción de WilliamsonEdwin TapiaNessuna valutazione finora
- Tarea4 ResoluciónPDF DMMMDocumento5 pagineTarea4 ResoluciónPDF DMMMDeysi M. MontoyaNessuna valutazione finora
- Problema 2Documento1 paginaProblema 2Daniel Melo100% (1)
- Quimica Analitica #1Documento13 pagineQuimica Analitica #1Jorge Angulo Gomez0% (1)
- Cap 10Documento25 pagineCap 10Jessy RamirezNessuna valutazione finora
- ECUACION de QuimicaDocumento2 pagineECUACION de QuimicaRoman Asto NaydaNessuna valutazione finora
- Primer EjercicioDocumento4 paginePrimer EjercicioXavier PilatuñaNessuna valutazione finora
- S10-Hteoría - GasesDocumento8 pagineS10-Hteoría - GasesDeysi Dorali Reyes InfantesNessuna valutazione finora
- Deber Final1Documento13 pagineDeber Final1Rodrigo LlaiquiNessuna valutazione finora
- Discusion 1 Energia LibreDocumento3 pagineDiscusion 1 Energia LibreCarlos E. Duarte0% (3)
- Patricio Castro FisikoquimikoDocumento27 paginePatricio Castro FisikoquimikoAndré Luzuriaga CarreraNessuna valutazione finora
- Deber 4 Termo IDocumento4 pagineDeber 4 Termo ILéo AyolNessuna valutazione finora
- P1. CuestionarioDocumento1 paginaP1. CuestionarioLéo AyolNessuna valutazione finora
- HojaGuia PsicrometriaDocumento3 pagineHojaGuia PsicrometriaLéo AyolNessuna valutazione finora
- Temas Primer Hemi Semestre PruebaDocumento12 pagineTemas Primer Hemi Semestre PruebaLéo AyolNessuna valutazione finora
- CADMIODocumento7 pagineCADMIOLéo AyolNessuna valutazione finora
- Frasco Dewar aislanteDocumento2 pagineFrasco Dewar aislanteLéo AyolNessuna valutazione finora
- HojaGuia P2Documento5 pagineHojaGuia P2Léo AyolNessuna valutazione finora
- Termodinámica I propiedadesDocumento1 paginaTermodinámica I propiedadesLéo AyolNessuna valutazione finora
- Termodinámica I propiedadesDocumento1 paginaTermodinámica I propiedadesLéo AyolNessuna valutazione finora
- Function Raiz (BISECCION)Documento1 paginaFunction Raiz (BISECCION)Léo AyolNessuna valutazione finora
- Progra (Clase 2 y 3)Documento11 pagineProgra (Clase 2 y 3)Léo AyolNessuna valutazione finora
- Actividades FTIIDocumento2 pagineActividades FTIILéo AyolNessuna valutazione finora
- Hoja de GasesDocumento9 pagineHoja de GasesLéo AyolNessuna valutazione finora
- P1. CuestionarioDocumento1 paginaP1. CuestionarioLéo AyolNessuna valutazione finora
- El Aspergillus Niger Es Productor deDocumento3 pagineEl Aspergillus Niger Es Productor deLéo AyolNessuna valutazione finora
- Practica 3Documento6 paginePractica 3Léo AyolNessuna valutazione finora
- Tu DestinoDocumento2 pagineTu DestinoLéo AyolNessuna valutazione finora
- LabioDocumento6 pagineLabioLéo AyolNessuna valutazione finora
- Prac14 0506Documento3 paginePrac14 0506los sabiosNessuna valutazione finora
- Tabla de Densidad para LiquidosDocumento18 pagineTabla de Densidad para LiquidospauloibarraNessuna valutazione finora
- Coef BrayanDocumento1 paginaCoef BrayanLéo AyolNessuna valutazione finora
- InformeDocumento15 pagineInformeIrma ChoqueNessuna valutazione finora
- Informe de Practicas PreprofesionalesDocumento6 pagineInforme de Practicas PreprofesionalesLéo AyolNessuna valutazione finora
- Bilogia Reinos y CelulasDocumento3 pagineBilogia Reinos y CelulasLéo AyolNessuna valutazione finora
- Hoja Guia TP1Documento3 pagineHoja Guia TP1Léo AyolNessuna valutazione finora
- Hoja Guia TP1Documento3 pagineHoja Guia TP1Léo AyolNessuna valutazione finora
- Malla 2009Documento1 paginaMalla 2009Ramiro ArcentalesNessuna valutazione finora
- Vero NotasDocumento1 paginaVero NotasLéo AyolNessuna valutazione finora
- Exoneracioningenieriaquimica2013 2013Documento2 pagineExoneracioningenieriaquimica2013 2013Léo AyolNessuna valutazione finora
- Ayudantía 10 PautaDocumento5 pagineAyudantía 10 PautaRuy PérezNessuna valutazione finora
- SistemaFotovoltaicoAisladoDocumento3 pagineSistemaFotovoltaicoAisladoJhoanBecerraNessuna valutazione finora
- Velocidades RelativasDocumento4 pagineVelocidades RelativasFrancisco Julio0% (2)
- Conservación TérmicaDocumento3 pagineConservación TérmicaAnita Espinosa80% (5)
- Norma Em. 100 Instalaciones de Alto Riesgo: Art. 6 Instalaciones para Fuentes DE Radiación IonizanteDocumento1 paginaNorma Em. 100 Instalaciones de Alto Riesgo: Art. 6 Instalaciones para Fuentes DE Radiación IonizanteRosend Pariona ParedesNessuna valutazione finora
- Ejercicios de Curso de Física y Química de 4º 1 PDFDocumento9 pagineEjercicios de Curso de Física y Química de 4º 1 PDFhousegrjNessuna valutazione finora
- Manual Basico Autocad 2011Documento65 pagineManual Basico Autocad 2011AbastecimientofdNessuna valutazione finora
- Introducción a la Microscopía ÓpticaDocumento26 pagineIntroducción a la Microscopía ÓpticaSILVIA LISETTE MARQUEZ VARGASNessuna valutazione finora
- Nanotecnologia - MonofrafíaDocumento33 pagineNanotecnologia - MonofrafíaYadhira Valenzuela LinoNessuna valutazione finora
- Luz y ColoresDocumento20 pagineLuz y ColoresCesar Antonio Rivera100% (1)
- Auxiliar No 2Documento10 pagineAuxiliar No 2Daniel Calderon EspindolaNessuna valutazione finora
- Mejora del sistema de agua potable de LacabambaDocumento3 pagineMejora del sistema de agua potable de LacabambaSarita Santiago MirandaNessuna valutazione finora
- Altitud y Sus consecuencias-RevE4Documento41 pagineAltitud y Sus consecuencias-RevE4Pedro Huerta SoajeNessuna valutazione finora
- Combustión de etinoDocumento91 pagineCombustión de etinoPruden HidalgoNessuna valutazione finora
- DM-LLA-05 Protocolo - PIE de REY - 2018 Rev AntiDocumento23 pagineDM-LLA-05 Protocolo - PIE de REY - 2018 Rev AntiPaul CruzNessuna valutazione finora
- Taller 4 PDFDocumento3 pagineTaller 4 PDFKelvin Parco FelicesNessuna valutazione finora
- Expresiones algebraicas fundamentalesDocumento2 pagineExpresiones algebraicas fundamentalesjkl316Nessuna valutazione finora
- Guia Via Lactea SextoDocumento6 pagineGuia Via Lactea SextoAlejandro CanoNessuna valutazione finora
- Valvula ReguladorDocumento10 pagineValvula ReguladorElena SoriaNessuna valutazione finora
- Aplicacion de Mediciones FasorialesDocumento160 pagineAplicacion de Mediciones FasorialesNando LópezNessuna valutazione finora
- Manual Nova 60 Informaciones Generales SDocumento28 pagineManual Nova 60 Informaciones Generales SEdgar Alonzo Bejarano PintoNessuna valutazione finora
- Ejercicios Seminario DERIVADADocumento2 pagineEjercicios Seminario DERIVADAKevin Nieto CobeñasNessuna valutazione finora
- 03 Transformacion de Esfuerzos y Carga EstáticaDocumento4 pagine03 Transformacion de Esfuerzos y Carga EstáticaErika Elizabeth100% (1)
- Consolidado Foro Calculo III Trabajo ColabDocumento20 pagineConsolidado Foro Calculo III Trabajo ColabWENDY RAMIREZNessuna valutazione finora