Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Liviana Gases Ideales y Modelo Cinetico 8° Liceo 2011 Noviembre
Caricato da
Johanna Vega FigueroaTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Liviana Gases Ideales y Modelo Cinetico 8° Liceo 2011 Noviembre
Caricato da
Johanna Vega FigueroaCopyright:
Formati disponibili
Liceo 1 Javiera Carrera Dpto. Biologa Prof. Danilo Parra l.
Nivel Octavo Bsico
GASES IDEALES Y MODELO CINTICO
Aprendizajes Esperados
Reconocer las caractersticas y propiedades de los gases y las variables que inciden en su comportamiento. Comprender las relaciones entre volumen, presin y cantidad de sustancia en el comportamiento de los gases Formular hiptesis y resolver problemas en situaciones ideales.. 1.- Caractersticas de los gases de acuerdo con la Teora Cintica Molecular. Los gases son uno de los tres estados de la materia y su comportamiento est sujeto a variables como la temperatura y presin. La investigacin durante los ltimos 3 siglos ha permitido a los qumicos formular una serie de leyes en relacin con los gases y su respuesta a cambios en estos parmetros. Propiedades de los gases. 1.- Difusin. Los gases se expanden en forma indefinida y uniforme para llenar todo el espacio en el que se encuentran.
2.- Forma y volumen indefinido. Una determinada muestra de gas no tiene forma ni volumen definidos, pero se puede ajustar al recipiente que los contiene.
3.- Compresibilidad. Los gases se pueden comprimir en gran medida. Por ejemplo en un tanque de buzo, a presin se puede comprimir un volumen muy grande de gas oxgeno. El efecto contrario, por disminucin de la presin, se denomina expansin.
4.- Baja densidad. La densidad representa cun juntos o separados se encuentran los tomos o las molculas de una determinada sustancia. Los slidos tienden a ser ms densos que los lquidos y estos ms densos que los gases. Esta regla general tiene ciertas excepciones como el mercurio lquido que tiene mayor densidad al a del hierro slido. La densidad se puede definir como la relacin que existe entre la masa de una sustancia y el volumen que esta ocupa, de manera que se puede calcular utilizando la frmula: Donde m es la masa de la sustancia (en gramo o kilogramo)
d
=
m
v
V
es
el
volumen
en
cc
o
litros.
d
es
la
densidad
de
la
sustancia.
La densidad es una propiedad intensiva esto quiere decir que no depende de la cantidad de sustancia que se est midiendo, por ejemplo 200cc o ml de agua tiene la misma densidad que 400 ml de agua.
5.- Miscibilidad. Normalmente dos o ms gases no reactivos se mezclan por completo de una manera uniforme cuando se ponen en contacto entre s. Por ejemplo las compaas de gas aprovechan esta propiedad para facilitar la deteccin de fugas en las tuberas de gas natural. El gas natural es una mezcla inodora de gases, principalmente metano, la compaa adiciona bajas dosis de un gas muy maloliente, el etil-mercaptano (C2 H6 S) al gas natural. El etil-mercaptano se difunde rapidez en el aire del ambiente y se puede detectar cuando existe una fuga desde una tubera.
2.-Teora Cintica Molecular
En esencia esta teora establece que el calor y el movimiento estn relacionados, que las partculas de toda la materia estn en movimiento hasta cierto punto y que el calor es una manifestacin de este movimiento. La Teora Cintica Molecular de los gases establece las siguientes suposiciones: 1.- Los gases estn compuestos por molculas. La distancia entre estas es muy grande si se la compara con su tamao y su volumen total solo es una pequea fraccin de todo el espacio que ocupa el gas. Por tanto, al considerar el volumen de un gas estamos tomando en cuenta en primer lugar un espacio vaco en ese volumen. Este postulado explica porqu de la alta compresibilidad y la baja densidad de los gases. 2.- No existen fuerzas de atraccin entre las molculas de un gas. Esto evita que un gas se convierta en lquido de manera espontnea. 3.- Las molculas de los gases se encuentran en un estado de movimiento rpido constante, chocando unas con otras y con loas paredes del recipiente que las contiene en una manera perfectamente aleatoria, al estilo de un pequeo auto chocador en un parque de diversiones. 4.- Todas estas colisiones son perfectamente elsticas. Es decir, como los autos chocadores, las molculas de un gas no se daan con las colisiones sino que continan su movimiento y chocan una y otra vez. Como resultado, el sistema, como un todo no experimenta ninguna prdida de energa cintica, la energa que se origina del movimiento de una partcula.
5.- La energa cintica promedio por molcula de un gas es proporcional a la temperatura en Kelvin, y la energa cintica promedio por molcula de todos los gases es igual a la misma temperatura. Las molculas de un gas poseen lmites de energa cintica; algunas molculas tienen ms energa (estn ms calientes) que la energa cintica promedio y algunas molculas tienen menor energa(estn ms fras). En teora, a 0 Kelvin no hay movimiento molecular y se considera que la energa cintica de cualquier partcula es cero. Temperatura en K = Temperatura en C + 273,15 6.- Dilatacin. Es el aumento de volumen de un gas debido al aumento de la temperatura. El efecto contrario corresponde a la contraccin, cuando se disminuye la temperatura.
Los gases que se ajustan a estas suposiciones se llaman gases ideales (helio argn, nen ) , y aquellos que no se adaptan son los gases reales como el hidrgeno, oxgeno, nitrgeno y otros. Se considera que un gas ideal tiene las siguientes caractersticas: El volumen de las molculas es despreciable comparado con el volumen que ocupa el gas. No hay fuerzas de atraccin o de repulsin entre molculas individuales. Las colisiones son perfectamente elsticas.
Bajo condiciones moderadas de temperatura y presin, los gases reales se comportan como gases nobles, pero si la temperatura es muy baja o la presin es muy alta, entonces las propiedades de los gases reales se desvan considerablemente de las propiedades de los gases ideales. Sin embargo si se evitan temperaturas extremadamente bajas o presiones extremadamente altas, se puede suponer que los gases reales se comportan como ideales y por lo tanto se le pueden aplicar las leyes fundamentales de los gases y sus ecuaciones. 3.- Presin de los gases Primero una explicacin general de presin. Es comn relacionar fuerza y presin y eso es correcto, pero no son lo mismo. Pregntale a tu mam qu ocurre cuando camina con zapatos de taco alto por el pasto o la arena, los tacos se entierran, por qu sucede esto?. Pensemos lo siguiente: cuando los zapatos estn vacos no se entierran, pero cuando alguien se los pone s lo hacen. Por lo tanto, el peso de la persona tiene que estar relacionado con lo que nos preguntamos, pero cuando tu mam camina por el pasto sin zapatos no se hunde, y pesa lo mismo. o sea no se trata solamente del peso. La diferencia entre andar con zapatos de taco alto y andar sin zapatos por el pasto est en que los tacos tienen un rea muy pequea para repartir el peso, en cambio los pies representan una superficie de apoyo mayor.
La presin es la relacin que existe entre la fuerza que se aplica y el rea o superficie en la que se reparte.
Matemticamente se calcula como:
P= F A
Donde F es la fuerza que se aplica, A es al rea en que la fuerza es aplicada y P es la presin producida. Por ejemplo, una persona puede llenar las llantas de su auto a 32 libras/pulg2 (libras(fuerza) por pulgada cuadrada (rea). Los lquidos y los gases actan de forma distinta a los slidos cuando se les aplica una presin. Por ser fluidos, para aplicar una fuerza sobre ellos y ejercer presin deben estar contenidos en un recipiente cerrado como un globo, un neumtico o en una bolsa. El impacto o choque de las molculas sobre las paredes del recipiente que contiene el gas es lo que origina la presin. El impacto o choque de las molculas sobre las paredes del recipiente que contiene el gas es lo que origina la presin. El impacto o choque de las molculas sobre las paredes del recipiente que contiene el gas es lo que origina la presin. A mayor frecuencia de colisiones, mayor presin del gas. A menor frecuencia de colisiones, menor presin del gas.
Todos los gases ejercen al menos una pequea presin. Aun los gases de la atmsfera( principalmente el nitrgeno, el oxgeno y otros gases) ejercen presin sobre su recipiente ( la atmsfera).
La presin atmosfrica se mide con un barmetro de mercurio, que fue diseado en 1643 por matemtico y fsico italiano Evangelista Torricelli. Su barmetro estaba formado por un tubo largo de vidrio cerrado en un extremo, lleno de mercurio e invertido por el extremo abierto sobre un recipiente con mercurio. Como es de esperar el mercurio comenz a salir, pero en un momento se detuvo y qued con una altura estable e inmvil de 76 cm. Torricelli dedujo que la presin atmosfrica aplastaba al mercurio en el recipiente era igual a la que ejerca una columna de mercurio de ese tamao. La presin que a nivel del mar sostiene una columna de mercurio con una altura de 76 cm a 0C, se llama presin normal. Esta presin puede expresarse en muchas unidades.
Presin normal medida en diversas unidades Nombre Valor Libras por pulgada cuadrada 14,7 lb/pulg2 Centmetros de mercurio 76 cm Hg Milmetros de mercurio 760 mm Hg torr 760 torr Pulgadas de mercurio 29,9 pulg de mercurio Atmsferas 1,00 atm pascales 101300 Pa milibares 1013 mbar Por ejemplo 1 atm = 760 mmHg = 760 torr = 1013 mbar. Presin atmosfrica. La atmsfera es la capa de gases que rodea a la Tierra, y por supuesto tiene peso. Nosotros nos encontramos dentro de ella y todo su peso lo recibimos sobre la cabeza. El aire que se encuentra sobre ti presiona tu cuerpo hacia abajo con su peso, es decir, te aplasta. La presin que ejerce la atmsfera sobre todos los objetos que se encuentran en la Tierra se llama presin atmosfrica. Si te encuentras en un lugar alto, hay menos aire sobre ti, por lo tanto la presin atmosfrica es menor. Si ests en la playa, la presin es mayor porque tienes ms aire ejerciendo una fuerza encima de tu cabeza. Presin manomtrica. Ya sabes lo que es la presin atmosfrica y cmo se mide. Tambin sabes que es la presin de un gas encerrado en un globo u otro recipiente, pero cmo se mide esta presin? Para medirla existe un instrumento llamado manmetro, que funciona de forma similar a un barmetro. Consiste en un tubo de vidrio curvo y graduado. Este tubo est cerrado en un extremo, y en el otro se encuentra abierto y se puede conectar a un recipiente cerrado que contiene un gas, al cual se le quiere medir la presin.
Mientras mayor sea la presin del gas, ms fuerza ejercer hacia abajo sobre el punto A. Si se aplasta el punto A, el mercurio se desplazar, subiendo por el otro lado, aumentando la columna sobre el punto A`. De esta
forma se puede calcular la presin a la que se encuentra un gas encerrado usando la altura de la columna de mercurio, desde el punto A hasta el punto ms alto. En este ejemplo, la columna de mercurio llega hasta 700mm y los puntos A y A se encuentran a unos 300mm. Por lo tanto la presin del gas ser equivalente al a de una columna de alrededor de 400 mm de mercurio (400 mmHg).
Los gases ejercen presin en todas las direcciones sobre el recipiente que los contiene como el caso del globo donde a medida que se agrega ms aire, el cual empuja las paredes del globo en todas direcciones hasta superar su capacidad de deformacin y se rompe.
3.- Leyes de los gases Como consecuencia del anlisis de distintos cientficos al comportamiento de los gases frente a variaciones en su volumen, presin o temperatura, se formularon tres leyes que describen su comportamiento. Cronolgicamente son: 3.1. Ley de Boyle: el efecto del cambio de presin sobre el volumen de un gas a temperatura constante. Ley formulada por el fsico y qumico britnico Robert Boyle cerca del ao 1660. A temperatura constante, el volumen de la masa fija de un gas es inversamente proporcional a la presin que este ejerce.
por ejemplo, si se duplica la presin de un cierto gas, el volumen se reducir a la mitad; si la presin se reduce a la mitad, el volumen se duplicar. De esta manera a menor presin, mayor volumen, a mayor presin, menos volumen.
Una demostracin de la ley de Boyle. Matemticamente se puede expresar como: Presin inicial x Volumen inicial = Presin final x Volumen final P1 x V1 = P2 x V2
Ejemplo:
El volumen de un gas, medido a presin normal, de 17, 4 litros. Calcule la presin del gas en torr si el volumen cambia a 20,4 litros y la temperatura permanece constante. Datos: P normal = 760 torr V inicial = 17,4 L P final = x V final = 20,4 L Nota: la presin normal es medida 0 C y puede expresarse en diferentes unidades. Reemplazar los datos en la ecuacin: P1 x V1 = P2 x V2 20,4 L
760 torr x
17,4 L = P2 x
760 torr x 17,4 L = P2 20,4 L 648 torr = P2
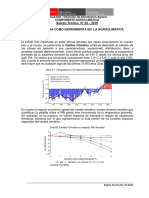
Anlisis: es importante notar que se produce un aumento del volumen, lo que concuerda con la disminucin de la presin. 3.2. Ley de Charles: el efecto del cambio de temperatura sobre el volumen de un gas a presin constante. Ley desarrollada por fsico francs Jacques Charles ( 1746 1823 ) Principio que establece que a presin constante, el volumen de una masa fija de un gas es directamente proporcional a la temperatura en grados Kelvin; por lo tanto cuando se duplica la temperatura Kelvin, tambin se duplica el volumen.
El grfico muestra que a presin constante, a medida que aumenta la temperatura, aumenta el volumen.
La figura es una demostracin de la Ley de Charles.
Matemticamente se expresa:
Volumen inicial = Volumen final Temperatura inicial Temperatura final
V1 T1
V2 T2
Ejemplo: Un gas ocupa un volumen de 4,5 litros a 27 C. A qu temperatura, en grados Celsius, el volumen ser 6 litros si la presin permanece constante? Datos: V inicial = 4,5 L T inicial = 27 C V final = 6 L T final = x Importante: esta ley siempre se trabaja con la temperatura expresada en grados Kelvin, por lo que es necesario realizar la conversin correspondiente. K = C + 273 K = 27 C + 273 300 K Reemplazar los datos en la ecuacin: V1 T1 4,5 L 300 K T2 T2 = = = = V2 T2 6L T2
6 L x 300 K 4,5 L 400 K 273 = 127 C
Respuesta : 400 K -
3.3. Ley de Gay Lussac: el efecto del cambio de temperatura sobre la presin de un gas a volumen constante. Esta fue la ltima de las tres leyes de los gases en ser formulada y la enunci Joseph Gay Lussac poco despus del ao 1800. Consiste en lo siguiente: Si un gas se encuentra a volumen constante (no cambia su cantidad) y se aumenta su temperatura absoluta (en K), su presin aumentar en la misma proporcin Matemticamente, la ley puede expresarse como P inicial = P final T inicial T final Donde P es la presin T es la temperatura en K Ejemplo: P1 = T1 P2 T2
La temperatura de un litro de un gas que inicialmente se encontraba en condiciones de temperatura y presin normales ( 1 atmsfera y 0 C ) cambia a 220 C y el volumen se mantiene constante. Calcule la presin final del gas en torr. Desarrollo: Datos: P inicial (P1) = 1 atm T inicial (T1) = 0 C P final (P2) = X torr T final (T2) = 220 C Importante: esta ley siempre se trabaja con la temperatura expresada en K, por lo que es necesario realizar la conversin correspondiente. 0 C + 273 = 273 K 220 C + 273 = 493 K Tambin es necesario transformar la presin de atm a torr: 1 atm = 760 torr Reemplazamos los datos en la ecuacin: P1 = P2 T1 T2 760 torr 273 K = P2 493 K 760 torr x 493 K = P2 = 1372,4 torr 273 K
Anlisis: el aumento de la presin concuerda con el aumento de la temperatura, ya que las partculas del gas aumentan su energa cintica y colisionan un mayor nmero de veces con las paredes del recipiente que las contiene y esto aumenta la presin. 3.4. Ley Combinada de los Gases: Esta ley relaciona las tres variables que ha aprendido anteriormente: presin, temperatura y volumen. Este trabajo lo hizo Clapeyron en 1834 y se denomina ley combinada de los gases ideales. Plantea que: La presin de un gas de masa determinada es directamente proporcional a su temperatura e inversamente proporcional a su volumen. Matemticamente: P1 x V1 T1 = P2 x V2 T2
Ejemplo: Dentro de un recipiente se tiene un gas a 100 C, que sometido a una presin de 150000Pa ocupa un espacio de 2 metros cbicos (2 M3). Dicho gas debiera poder expandirse libremente manteniendo su presin constante, sin embargo se calienta hasta una temperatura de 400 C y el mecanismo de expansin se traba, permitindole llegar solo a 3 M3. Determine la presin a la que queda sometido el gas. Datos: P1 = 1500000 Pa T1 = 100 C = 373 K V1 = 2 M3 P1 x V1 T1 P2 = ? T2 = 400 C = 673 K V2 = 3M3
= P2 x V2 = 1500000 Pa x 2M3 = P2 x 3M3 = 3000000 Pa M3x 673 K = P2 T2 373 K 673 K 373 K x 3 M3 180429 Pa = P2
Es decir, la presin aument como era de esperar, pasando de 1500000 a ms de 180000 Pa.
Potrebbero piacerti anche
- Guía de Actividades Hay Ahi AyDocumento3 pagineGuía de Actividades Hay Ahi AyJohanna Vega Figueroa88% (16)
- EJEMPLO 10-4 y 10-6 .Documento6 pagineEJEMPLO 10-4 y 10-6 .Alexa AnguloNessuna valutazione finora
- Informe 03 Cianuración en Botella - Padilla Fabian Jean PaulDocumento16 pagineInforme 03 Cianuración en Botella - Padilla Fabian Jean PaulAnonymous C0lBgO24iNessuna valutazione finora
- Pueblo y Soberania Nº3Documento28 paginePueblo y Soberania Nº3Georgina Jiménez100% (1)
- Ensayo Simce Lenguaje CuartoDocumento11 pagineEnsayo Simce Lenguaje CuartoJohanna Vega Figueroa100% (1)
- Evaluación Ciencias Naturales 7º Ciclos NaturalezaDocumento2 pagineEvaluación Ciencias Naturales 7º Ciclos NaturalezaJohanna Vega Figueroa100% (3)
- Prueba de Diagnóstico Cs. Naturales 5toDocumento3 paginePrueba de Diagnóstico Cs. Naturales 5toPamela Isabel Toro YañezNessuna valutazione finora
- Desalinizador CaseroDocumento2 pagineDesalinizador CaseroJohanna Vega FigueroaNessuna valutazione finora
- Los Colores ComplementariosDocumento14 pagineLos Colores ComplementariosJohanna Vega FigueroaNessuna valutazione finora
- Texto Aventura Con El TelevisorDocumento9 pagineTexto Aventura Con El TelevisorJohanna Vega FigueroaNessuna valutazione finora
- Guía de Experimento FotosíntesisDocumento1 paginaGuía de Experimento FotosíntesisJohanna Vega FigueroaNessuna valutazione finora
- El PehuenDocumento3 pagineEl PehuenJohanna Vega Figueroa100% (1)
- I02N Material S04.s1Documento18 pagineI02N Material S04.s1ramos valdan murcielagoNessuna valutazione finora
- Carpeta - 6 - de EDAFOLOGÍA 2023Documento41 pagineCarpeta - 6 - de EDAFOLOGÍA 2023Mariela RuizNessuna valutazione finora
- 387 - 17-ITE-001 Estudio Hidrologico 2017Documento177 pagine387 - 17-ITE-001 Estudio Hidrologico 2017Youl SilvaNessuna valutazione finora
- Hoja de Seguridad - Referi 200 SCDocumento6 pagineHoja de Seguridad - Referi 200 SCMARTHA ROJASNessuna valutazione finora
- Prontuario de Información Geográfica Municipal de Los Estados Unidos MexicanosDocumento9 pagineProntuario de Información Geográfica Municipal de Los Estados Unidos MexicanosChipo ChipNessuna valutazione finora
- Areas Naturales Protegidas ESDocumento22 pagineAreas Naturales Protegidas ESPedro AyalaNessuna valutazione finora
- Examen Aplazados de Ventilacion de Minas 2008Documento9 pagineExamen Aplazados de Ventilacion de Minas 2008NOENessuna valutazione finora
- Presentacion Dinamica Montaña RusaDocumento13 paginePresentacion Dinamica Montaña RusaHeriberto Reveles SalinasNessuna valutazione finora
- Laboratorio Porcentaje de Hidratacion de Un CompuestoDocumento7 pagineLaboratorio Porcentaje de Hidratacion de Un Compuestosebastian castillo castilloNessuna valutazione finora
- 6º Ciencias Semana30Documento14 pagine6º Ciencias Semana30Moises HernandezNessuna valutazione finora
- GasificaciónDocumento168 pagineGasificaciónraul_zamoraNessuna valutazione finora
- Articulo Importancia de Los Reactores PDFDocumento6 pagineArticulo Importancia de Los Reactores PDFCamilo Cortés100% (1)
- Portafolio-Ciencia y AmbienteDocumento27 paginePortafolio-Ciencia y AmbienteJhesuz Sernaque UrdialesNessuna valutazione finora
- El Secador SolarDocumento8 pagineEl Secador Solarcarisalex2Nessuna valutazione finora
- Monografia de ResponsabilidadDocumento14 pagineMonografia de ResponsabilidadArmando Guia HuamaniNessuna valutazione finora
- 1 1 Ingenieria Sistemas de Puesta A TierDocumento21 pagine1 1 Ingenieria Sistemas de Puesta A TierDIBOR,C.A DIBORNessuna valutazione finora
- Boletin02 DIA AgroclimaticaDocumento13 pagineBoletin02 DIA AgroclimaticaCaroline HuayllaNessuna valutazione finora
- Desafios Ambientales Primera ParteDocumento8 pagineDesafios Ambientales Primera ParteKevin Quiroga yañezNessuna valutazione finora
- Tecnicas en Analisis Geoquimicos en ExploracionDocumento5 pagineTecnicas en Analisis Geoquimicos en ExploracionNicolas GuzmanNessuna valutazione finora
- Examen Final de Energia Termica e Hidraulica Experimental............Documento6 pagineExamen Final de Energia Termica e Hidraulica Experimental............Mauricio Arteaga SalinasNessuna valutazione finora
- Quimica InorganicaDocumento111 pagineQuimica InorganicaBruno MelNessuna valutazione finora
- Ecologia FuncionalDocumento10 pagineEcologia Funcionalsergio stalinNessuna valutazione finora
- Taller 2 QuimicaDocumento3 pagineTaller 2 QuimicaDIEGO ALEJANDRO ANGARITA BALDEONNessuna valutazione finora
- Dúo 3 - IA Industria PetroleraDocumento12 pagineDúo 3 - IA Industria PetroleraJERÓNIMO CANALES MELANIE DINANessuna valutazione finora
- Ciclos de RefrigeracionDocumento16 pagineCiclos de RefrigeracionAngel Zevallos VeraNessuna valutazione finora