Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Solubilidade de fenol e água
Caricato da
Samara RaquelDescrizione originale:
Titolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Solubilidade de fenol e água
Caricato da
Samara RaquelCopyright:
Formati disponibili
UNIVERSIDADE FEDERAL DA PARABA CCEN CENTRO DE CINCIAS EXTAS E DA NATUREZA DEPARTAMENTO DE QUMICA
SOLUBILIDADE MTUA DE DOIS LQUIDOS
DISCIPLINA: FSICO QUMICA II EXPERIMENTAL PROFESSORA: CLAUDIA BRAGA ALUNA: SAMARA RAQUEL PEREIRA DE MOURA MATRICULA: 10911464 24/04/2012
INTRODUO
Dois lquidos so totalmente miscveis quando as molculas de um se dispersam homogeneamente nas do outro. A miscibilidade dos lquidos est relacionada com a sua estrutura qumica. Quanto mais semelhante for a polaridade, tanto maior ser a solubilidade pois as molculas dos dois lquidos originariam campos elctricos anlogos. A miscibilidade a propriedade de duas ou mais substncia lquida misturarem entre si com maior ou menor facilidade, formando uma ou mais fases. Dois lquidos, ou seja, um sistema binrio pode ser a totalmente miscveis ou imiscveis. Exemplos bem conhecidos desse comportamento diferenciado so os sistemas gua/lcool (perfeitamente miscveis) e gua/leo (imiscveis). Sistemas com duas substncias parcialmente miscveis podem apresentar uma ou duas fases. Quando apresenta uma s fase temos uma nica soluo lquida (homognea). Ao apresentar duas fases teremos duas solues, ambas contendo uma composio das duas substncias. Nesse caso so chamadas de solues conjugadas. Diagramas de equilbrio so representaes grficas que indicam em quais condies termodinmicas (temperatura e composio qumica) ocorrem s transformaes de fase.
OBJETIVO O objetivo dessa prtica construir o diagrama de equilbrio para um sistema contendo fenol e gua. Essa determinao foi feita observando em cada ponto na temperatura em que ocorre a homogeneidade total dos componentes, ou seja, pelos pontos determinados da curva binodal que se separa a regio da monofsica.
PROCEDIMENTO EXPERIMENTAL
Material Utilizado 1 Termmetro 0 100C (0,5C); 1 Bquer de 600 ml; Dois tubos de ensaios; Duas pipetas; Pera de borracha; Soluo Fenlica 80%.
D
C
E
A
TEM (C)
Uma demonstrao simples do dispositivo usado para realizao da prtica. A. Chapa; B. Bquer com gua; C. Termmetro; D. Tubo de ensaio 1; E. Tubo de ensaio 2.
Procedimento i. Termmetro e agitador suspenso em uma rolha de borracha e encaixados dentro do tubo de ensaio e este preso a um suporte e mergulhado em banho de glicerina. (No ensaio realizado foi utilizado agua no lugar da glicerina); Pipete, com pera de borracha e seringa na capela, 5mL de soluo fenlica 80% e transfira para um tubo de ensaio. Adicione 1.8mL de agua destilada de forma a obter uma mistura com 59,4% de fenol. Esta composio no totalmente miscvel a temperatura ambiente; Aquea a mistura lentamente, em banho de glicerina ate o desaparecimento da opalescncia e anote a temperatura; Retira a mistura do banho e deixa resfriar lentamente ate o reaparecimento da opalescncia. Anote a temperatura.
ii.
iii. iv.
Repita o procedimento a mistura anterior as seguintes quantidade de agua uma de cada vez: 1,0; 1,4;2,0;1,5 mL. i. ii. Composio de cada mistura, em cada caso, (%m/m) de fenol, respectivamente, 52,0; 44,2; 36,4; 32,2%; Pegue outro tubo de ensaio e coloque 2mL de uma soluo fenlica 80%, acrescente 4,6mL de agua de forma a obter uma mistura de 25% em fenol e seguindo o mesmo procedimento anterior a temperatura de miscibilidade total da mistura. Em seguida acrescente esta, 2,6 e posteriormente 7,7 mL de agua destilada, uma quantidade de cada vez, para obter fenol 20,0 e 10,4% respectivamente. Faa determinaes de temperatura de miscibilidade nos dois casos.
RESULTADOS E DISCUSSES Tratamento de Dados Abaixo se encontra a tabela com as temperaturas determinadas em cada concentrao, na aula prtica.
Tubo de Ensaio I I I I I II II II
Amostra Volume Fenol (ml) 1 5,0 2 5,0 3 5,0 4 5,0 5 5,0 1 2,0 2 2,0 3 2,0
Volume gua (ml) 1,8 1,0 1,4 2,0 1,5 4,6 2,6 7,7
Composio T1 (C) do Fenol 59,4% 52,0% 44,2% 36,4% 32,2% 25,0% 20,0% 10,4% 56,9 64,2 67,1 67,9 69,1 67,7 63,2 41,8
T2 (C)
Mdia T (C) 56,8 64,1 64,0 67,75 69,05 67,6 63,15 41,75
56,7 64,0 66,9 67,6 69,0 67,1 63,1 41,7
De acordo com a tabela, podemos construir o grfico da temperatura mdia X composio da mistura.
Grfico 1
80 Mdia da Temperatura 70 60 50 40 30 20 10 0 0 10 20 30 40 50 60 70 Composio da Mistura Mdia T
A partir do grfico, podemos afirmar que a temperatura crtica superior e a composio da mistura correspondente a esta : Temperatura Crtica Superior: 69,05C Composio da Mistura: 32,2%
Comparando com a literatura: Encontrei na literatura uma temperatura critica superior de 65,85C, no nosso experimento foi de 69,05C, com um erro de aproximadamente de 4,86%. Esse erro pode ser atribudo aos erros de medio e as condies do laboratrio. Aplicando a regra das fases, determinei a varincia nas diversas regies do diagrama. Atravs de consideraes termodinmicas, Gibbs deduziu uma relao entre o nmero de fases (P) que podem coexistir em equilbrio em um dado sistema, o nmero mnimo de componentes (C) que podem ser usados para formar o sistema e os graus de liberdade(F). A relao pode ser apresentada sob a forma de equao:
Nmero de Fase, P = 1 Nmero de Componentes, C = 2 Logo a equao fica assim: O grau de liberdade de 3.
Considerando uma mistura de fenol e gua 40% de fenol e a 50 C. Determine, para esta mistura, as composies das fases conjugadas e as quantidades relativas destas.
80 70 Mdia da Temperatura 60 50
Grfico 2
Series1 40 30 20 10 0 0 10 20 30 40 50 Composio da Mistura 60 70 80 Poly. (Series1)
REGRA DA ALAVANCA usada para se determinar as propores das fases em equilbrio em um campo de duas fases. Deduo Chega-se regra das fases simplesmente atravs de um balano de massa; Consideremos WL e W as fraes mssicas, respectivamente, da fase lquida,L, e da fase slida, ; Cada componente do sistema pode estar em cada uma das fases, em concentrao CL (no lquido) e C (no slido); As duas equaes abaixo podem ser escritas:
WL+ W = 1
W =1- W (eq. I )
WLCL+WC = C0 (eq. II) (1-W) CL + W C = C0 CL WCL +W C = C0 W (C CL) = C0
Para o nosso caso: As composies, so as seguintes, de acordo com o grfico traamos uma reta tanto na horizonta como na vertical. Uma demonstrao simples:
O ponto em questo a ser analisado.
Assim determinamos pelo Grfico 2, os pontos e os seu valores. Abaixo se encontra os valores e o calculo para quantidades relativas.
CONCLUSO Em relao ao experimento da solubilidade de dois lquidos conclui-se que a solubilidade mutua aumenta com a temperatura. A informao que obtemos em relao solubilidade, aonde ela homogenia ou heterogenia no diagrama de fase, muito importante para inmeras aplicaes na engenharia.
REFERNCIAS BIBLIOGRFICAS
http://www.cienciadosmateriais.org/index.php?acao=exibir&cap=14&top=27 http://dc176.4shared.com/doc/ACmAeuTX/preview.html http://www.pipe.ufpr.br/portal/defesas/dissertacao/119.pdf http://www.scielo.br/scielo.php?script=sci_arttext&pid=S010040422006000600033 http://pt.scribd.com/doc/58627747/11%C2%BA-aula-Diagramas-de-Fases http://sites.poli.usp.br/d/pmt2100/Aula05_2005%201p.pdf http://www.cienciadosmateriais.org/index.php?acao=exibir&cap=16&top=216 ATKINS, D.; PAULA, J.D. Fsico-Qumica, 7 Ed., volume 1, LTC Editora, Rio de Janeiro, 2003.
Potrebbero piacerti anche
- 4-Diagrama Unifilar - Marcio - R00Documento1 pagina4-Diagrama Unifilar - Marcio - R00Joao Paulo100% (2)
- A Chave Da Consciência - Hinaldo Breguez PDFDocumento110 pagineA Chave Da Consciência - Hinaldo Breguez PDFMichelliPossmozerNessuna valutazione finora
- Proposta YogaDocumento6 pagineProposta YogaGiuvana Salvador100% (1)
- Manual do usuário bancada de testeDocumento7 pagineManual do usuário bancada de testeFernando BatistaNessuna valutazione finora
- Lançamento Projétil MRUADocumento4 pagineLançamento Projétil MRUALuiz Fernando F. De AndradeNessuna valutazione finora
- FISICO QUIMICA - Efeito Da Temperatura Sobre A Miscibilidade de Dois LíquidosDocumento6 pagineFISICO QUIMICA - Efeito Da Temperatura Sobre A Miscibilidade de Dois LíquidosmarianaclrcunhaNessuna valutazione finora
- Tim Ingold - The Perception of The EnvironmentDocumento20 pagineTim Ingold - The Perception of The EnvironmentBolivar MariniNessuna valutazione finora
- Uma análise da abordagem de Reggio Emilia na educação infantil brasileiraDocumento24 pagineUma análise da abordagem de Reggio Emilia na educação infantil brasileiraTati KhamisNessuna valutazione finora
- Aurora TrigueirinhoDocumento190 pagineAurora TrigueirinhoGisele KlobukoskiNessuna valutazione finora
- 3 AvmodelagemDocumento19 pagine3 AvmodelagemAna Luiza CamposNessuna valutazione finora
- 6 - Equilíbrio Líquido-Vapor e Destilação FracionadaDocumento27 pagine6 - Equilíbrio Líquido-Vapor e Destilação FracionadaJosé Alberto Júnior100% (1)
- Curva Solubilidade Fenol-ÁguaDocumento6 pagineCurva Solubilidade Fenol-ÁguaMarcos Bittencourt0% (1)
- Aula 5 - Química XDocumento24 pagineAula 5 - Química XGuilhermeNessuna valutazione finora
- Equilíbrio de fases em sistemas ternáriosDocumento9 pagineEquilíbrio de fases em sistemas ternáriosPamela ChristineNessuna valutazione finora
- Forças Intermoleculares e Redes CristalinasDocumento9 pagineForças Intermoleculares e Redes CristalinasStéfane Oliveira de LiraNessuna valutazione finora
- 5º Relatório Aula Prática Analise Gravimetrica.Documento7 pagine5º Relatório Aula Prática Analise Gravimetrica.AdelsonRodrigues100% (2)
- ISO 8859 1QAdsor E7 E3o I 2edocxDocumento8 pagineISO 8859 1QAdsor E7 E3o I 2edocxWillian BoulosNessuna valutazione finora
- Propriedades ColigativasDocumento23 paginePropriedades ColigativasFábioRobertoBatistaNessuna valutazione finora
- Ponto de Bolha em Misturas IdeaisDocumento41 paginePonto de Bolha em Misturas IdeaisIthiaraDalponteNessuna valutazione finora
- Relatório de Química Experimental, Padronização de Soluções - UEMDocumento7 pagineRelatório de Química Experimental, Padronização de Soluções - UEMrrodrigueswellingtonNessuna valutazione finora
- Medições e Erros em Instrumentos de LaboratórioDocumento7 pagineMedições e Erros em Instrumentos de LaboratóriobarbaraverenaNessuna valutazione finora
- Diagrama Solubilidade Sistema TernarioDocumento9 pagineDiagrama Solubilidade Sistema TernarioLeandro PloencioNessuna valutazione finora
- Experimento Calor EspecificoDocumento8 pagineExperimento Calor EspecificoBruna KonoNessuna valutazione finora
- Relatório de Quimica - 6Documento6 pagineRelatório de Quimica - 6Pedro Henrique SilvaNessuna valutazione finora
- Relatório Destilação Simples e FracionadaDocumento3 pagineRelatório Destilação Simples e FracionadaBruna GomesNessuna valutazione finora
- Determinação de coeficientes de transferência de massa e difusãoDocumento40 pagineDeterminação de coeficientes de transferência de massa e difusãoThais AlvesNessuna valutazione finora
- Reações químicas: calor e entalpiaDocumento8 pagineReações químicas: calor e entalpiaeuNessuna valutazione finora
- Determinação Do Volume Molar Co2Documento10 pagineDeterminação Do Volume Molar Co2Katy AzalimNessuna valutazione finora
- Gases Ideais II 72Documento16 pagineGases Ideais II 72Rafael VianaNessuna valutazione finora
- Lista de Exercicio 1 - CQ 114 - 2013-02Documento2 pagineLista de Exercicio 1 - CQ 114 - 2013-02Porteclefus50% (2)
- Trabalho de Des ColigativasDocumento10 pagineTrabalho de Des ColigativasJorgenilson SandraNessuna valutazione finora
- Relatorio - Cromatografia GasosaDocumento17 pagineRelatorio - Cromatografia GasosaKassia Thais Giehl100% (1)
- Predição da densidade do sistema H2O+CO2 usando as equações SRK e CPADocumento5 paginePredição da densidade do sistema H2O+CO2 usando as equações SRK e CPALaboratório SimulaçãoNessuna valutazione finora
- RELATORIODocumento5 pagineRELATORIOHayane AmorimNessuna valutazione finora
- Relatorio Equilibrio Liquido VaporDocumento3 pagineRelatorio Equilibrio Liquido VaportatianeNessuna valutazione finora
- DIAGRAMA DE FASES Aula1Documento35 pagineDIAGRAMA DE FASES Aula1Gabriella BalisaNessuna valutazione finora
- FQ II DiagramasdefaseDocumento58 pagineFQ II DiagramasdefaseWanessa TeixeiraNessuna valutazione finora
- Prática 1 - Preparo de SoluçõesDocumento2 paginePrática 1 - Preparo de SoluçõesHenrique EvaristoNessuna valutazione finora
- Relatório Momento LinearDocumento4 pagineRelatório Momento LinearLUANA FERREIRANessuna valutazione finora
- Pressão de Vapor Pelo Método DFQDocumento4 paginePressão de Vapor Pelo Método DFQjulianadias91Nessuna valutazione finora
- Determinação de fosfato em refrigerante por espectrofotometriaDocumento3 pagineDeterminação de fosfato em refrigerante por espectrofotometriaVictor CarvalhoNessuna valutazione finora
- Relatório 3 (Determinação Da Densidade Do Dióxido de Carbono)Documento9 pagineRelatório 3 (Determinação Da Densidade Do Dióxido de Carbono)Jean MarcioliNessuna valutazione finora
- Primeira Lista de ExeciciosDocumento3 paginePrimeira Lista de ExeciciosTatiane FerreiraNessuna valutazione finora
- RefratometriaDocumento6 pagineRefratometriaIsabela SilvérioNessuna valutazione finora
- Cálculos químicos de elementos e compostosDocumento6 pagineCálculos químicos de elementos e compostoslalallalaNessuna valutazione finora
- Exercicios Trabalho e CalorDocumento10 pagineExercicios Trabalho e CalorWilliam Evangelista de JesusNessuna valutazione finora
- Determinação das constantes de adsorção da isoterma de Freundlich para adsorção de ácido acético em carvão ativadoDocumento3 pagineDeterminação das constantes de adsorção da isoterma de Freundlich para adsorção de ácido acético em carvão ativadoVictor Augusto0% (1)
- Lista de ExerciciosDocumento6 pagineLista de ExerciciosAline AraujoNessuna valutazione finora
- Relatório RefratometriaDocumento5 pagineRelatório RefratometriaSabrina MedradoNessuna valutazione finora
- Lista de Exercícios 2 - Absorção - Determinação de Estágios de EquilíbrioDocumento2 pagineLista de Exercícios 2 - Absorção - Determinação de Estágios de EquilíbrioSimeus Marc donn Marc100% (1)
- Lista de Exercícios 4 - FQ2-2022-2Documento3 pagineLista de Exercícios 4 - FQ2-2022-2Biso NiosoNessuna valutazione finora
- Relatorio Hexaaquacobalto II LAST PDFDocumento12 pagineRelatorio Hexaaquacobalto II LAST PDFIbraima Bente DjaloNessuna valutazione finora
- Determinação dos parâmetros cinéticos de reação usando uma reação relógio de formaldeídoDocumento20 pagineDeterminação dos parâmetros cinéticos de reação usando uma reação relógio de formaldeídoChrystiano CaladoNessuna valutazione finora
- Iogurte FermentaçãoDocumento14 pagineIogurte FermentaçãoLarissa FoltranNessuna valutazione finora
- Ponto de Fusao e EbulicaoDocumento18 paginePonto de Fusao e EbulicaoJulio SeibertNessuna valutazione finora
- Relatório Cromatografia - Março 2011Documento9 pagineRelatório Cromatografia - Março 2011Lucila AndradeNessuna valutazione finora
- Relatorio Destilação de VinhoDocumento6 pagineRelatorio Destilação de VinhoArianeMachadoAlviraPachecoNessuna valutazione finora
- Química Geral II - Atividades ExperimentaisDocumento46 pagineQuímica Geral II - Atividades ExperimentaisTaciana GuarnieriNessuna valutazione finora
- Calorímetro e A Determinação Da Entalpia Do Peróxido de HidrogênioDocumento15 pagineCalorímetro e A Determinação Da Entalpia Do Peróxido de HidrogênioDanieleNessuna valutazione finora
- Relatório 1 - Fermentação LáticaDocumento9 pagineRelatório 1 - Fermentação LáticaGabriela CarlettiNessuna valutazione finora
- Curva binodal do sistema água-ácido acético-acetato de etilaDocumento5 pagineCurva binodal do sistema água-ácido acético-acetato de etilaVitor SantosNessuna valutazione finora
- Adsorção do corante azul de metileno em esferas de vidroDocumento14 pagineAdsorção do corante azul de metileno em esferas de vidroDyogo Mondego MoraesNessuna valutazione finora
- Método Instrumental de AnáliseDocumento13 pagineMétodo Instrumental de AnáliseDaniela PascoalNessuna valutazione finora
- Proteção Radiológica: Unidades, Grandezas e LimitesDocumento48 pagineProteção Radiológica: Unidades, Grandezas e LimitesVictor DouglasNessuna valutazione finora
- Síntese e Análise de Oxalato de Cobalto HidratadoDocumento5 pagineSíntese e Análise de Oxalato de Cobalto HidratadoNando KissNessuna valutazione finora
- Curva miscibilidade água-fenolDocumento10 pagineCurva miscibilidade água-fenolTarsila CarvalhoNessuna valutazione finora
- Realatorio Sobre Equilibrio de Sistema Ternario (Modelo Da Net)Documento6 pagineRealatorio Sobre Equilibrio de Sistema Ternario (Modelo Da Net)Auricéia FariasNessuna valutazione finora
- Relatório Solubilidade MútuaDocumento36 pagineRelatório Solubilidade MútuaAlexânder De Paula RodriguesNessuna valutazione finora
- Modelo Convite Casando Sem GranaDocumento1 paginaModelo Convite Casando Sem GranaLeandro AraújoNessuna valutazione finora
- Questões de Indice de MillerDocumento15 pagineQuestões de Indice de MillerSamara RaquelNessuna valutazione finora
- Modelo Convite Casando Sem GranaDocumento1 paginaModelo Convite Casando Sem GranaLeandro AraújoNessuna valutazione finora
- Aula Trat AguaDocumento62 pagineAula Trat AguaSamara RaquelNessuna valutazione finora
- Analise Granulometrica - SamaraDocumento8 pagineAnalise Granulometrica - SamaraSamara RaquelNessuna valutazione finora
- Questões de Indice de MillerDocumento15 pagineQuestões de Indice de MillerSamara RaquelNessuna valutazione finora
- Resolução Da 4 Lista de Fisicia Geral IiiDocumento3 pagineResolução Da 4 Lista de Fisicia Geral IiiSamara RaquelNessuna valutazione finora
- Relatorio FQ III - Pratica 4Documento8 pagineRelatorio FQ III - Pratica 4Samara RaquelNessuna valutazione finora
- PROVACAL3Documento6 paginePROVACAL3Nanda SousaNessuna valutazione finora
- Siga FelizDocumento1 paginaSiga FelizSamara RaquelNessuna valutazione finora
- PROVACAL3Documento6 paginePROVACAL3Nanda SousaNessuna valutazione finora
- Leito Poroso: Permeabilidade e Perdas de CargaDocumento9 pagineLeito Poroso: Permeabilidade e Perdas de CargaSamara RaquelNessuna valutazione finora
- Apostila de Técnica de Redação Com Teoria Da ComunicaçãoDocumento111 pagineApostila de Técnica de Redação Com Teoria Da ComunicaçãoErnane Duarte NunesNessuna valutazione finora
- Tecnologia Das Fermentações - Meios de CulturaDocumento20 pagineTecnologia Das Fermentações - Meios de CulturaSamara RaquelNessuna valutazione finora
- 7 Lista de Exercícios - Cap. 27 - CircuitosDocumento1 pagina7 Lista de Exercícios - Cap. 27 - CircuitosSamara RaquelNessuna valutazione finora
- Processos Unitários 1 Introdução A Calculos de EngenhariaDocumento28 pagineProcessos Unitários 1 Introdução A Calculos de EngenhariaSamara RaquelNessuna valutazione finora
- ABSORÇÃODocumento7 pagineABSORÇÃOSamara RaquelNessuna valutazione finora
- Eletrostática 21 - Trabalho Da Força ElétricaDocumento5 pagineEletrostática 21 - Trabalho Da Força ElétricaLeonardo MardeganNessuna valutazione finora
- Cespe 2016 Policia Cientifica Pe Perito Criminal Quimica ProvaDocumento14 pagineCespe 2016 Policia Cientifica Pe Perito Criminal Quimica ProvaThiago FagundesNessuna valutazione finora
- Projetos para a Estância Hidromineral do Barreiro em AraxáDocumento343 pagineProjetos para a Estância Hidromineral do Barreiro em AraxáAry MedeirosNessuna valutazione finora
- MERLEAU - PONTY. Conversas, 1948Documento50 pagineMERLEAU - PONTY. Conversas, 1948renan_pazinatto100% (1)
- Teorias pós-críticas e diversidade culturalDocumento12 pagineTeorias pós-críticas e diversidade culturalMarcela PereiraNessuna valutazione finora
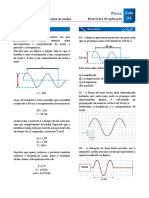
- Exercícios de CinemáticaDocumento5 pagineExercícios de CinemáticaAngelo Suisei DamiaoNessuna valutazione finora
- Ondas físicas em cordas e superfícies - exercícios resolvidosDocumento3 pagineOndas físicas em cordas e superfícies - exercícios resolvidosDavidson MirandaNessuna valutazione finora
- Lista 1 F Sica Geral 1Documento2 pagineLista 1 F Sica Geral 1VALDILEIA OLIVEIRA DOS SANTOSNessuna valutazione finora
- TCC ATP Simulador CircuitosDocumento145 pagineTCC ATP Simulador CircuitosjosejesusthomazNessuna valutazione finora
- Comunicações ÓpticasDocumento6 pagineComunicações ÓpticasMatheus Alves FreitasNessuna valutazione finora
- Termodinâmica Aplicada - Exame EE SV 1718Documento2 pagineTermodinâmica Aplicada - Exame EE SV 1718Duarte MotaNessuna valutazione finora
- Ensino de História, Tecnologias e Metodologias Ativas Novas Experiências e Saberes Escolares (Leite, Priscila Gontijo Borges Etc.)Documento296 pagineEnsino de História, Tecnologias e Metodologias Ativas Novas Experiências e Saberes Escolares (Leite, Priscila Gontijo Borges Etc.)Viviane GalvãoNessuna valutazione finora
- Disjuntores - Mat at MTDocumento21 pagineDisjuntores - Mat at MTRogério Lopes Da CostaNessuna valutazione finora
- OSIFICACAO DA DISCIPLINA DE FÍSICA 8a CLASSE I TRIMESTRE 2022Documento5 pagineOSIFICACAO DA DISCIPLINA DE FÍSICA 8a CLASSE I TRIMESTRE 2022Edmundo Cardoso CardosoNessuna valutazione finora
- Torção 201721Documento44 pagineTorção 201721eldyvaniaNessuna valutazione finora
- LFQ - Experimento 1 (Viscosidade de Líquidos)Documento11 pagineLFQ - Experimento 1 (Viscosidade de Líquidos)Hevelin Balbino100% (1)
- Case: PONTE SADocumento4 pagineCase: PONTE SAkrikacz100% (6)
- Porosidade e permeabilidade do soloDocumento3 paginePorosidade e permeabilidade do soloKelly FerreiraNessuna valutazione finora
- QuimicaDocumento12 pagineQuimicaHellyan WilkerNessuna valutazione finora
- Rumo a uma mente sábia e sociedade nobreDocumento140 pagineRumo a uma mente sábia e sociedade nobrest.machadoNessuna valutazione finora
- O Livro de AbschteulichDocumento12 pagineO Livro de Abschteulichwhadyston galietaNessuna valutazione finora
- Resistência dos materiais - Lista 01Documento8 pagineResistência dos materiais - Lista 01jadocb1Nessuna valutazione finora