Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Carbonatos y Bicarbonatos Por Titulacion Pehachimetrica
Caricato da
luisurielesCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Carbonatos y Bicarbonatos Por Titulacion Pehachimetrica
Caricato da
luisurielesCopyright:
Formati disponibili
ANLISIS DE CARBONATOS Y BICARBONATOS POR TITILACIN PEHACHIMTRICA
LUIS EDUARDO URIELES LOPEZ DOC 1.045.020.527 EDITH YADIRA RODRIGUEZ VELANDIA DOC 63.523.997
MAURIN SALAMANCA
UNIVERSIDAD DE ANTIOQUIA FACULTAD QUIMICA FARMACEUTICA NOVIEMBRE 2012
ANLISIS DE CARBONATOS Y BICARBONATOS POR TITILACIN PEHACHIMTRICA
OBJETIVOS Efectuar anlisis Potenciomtrico, mediante una titilacin a una muestra desconocida de carbonatos y bicarbonatos. Determinar la concentracin de CO3 problema. Realizar una curva de valoracin de pH vs. Volumen de HCl.
2
y HCO3 presentes en la muestra
MODELO DE CALCULO DE RESULTADOS Reacciones CO32- + H3O+ HCO3- + H3O+ Datos tericos Concentracin Ma HCL = 0.1268 Na2CO3 =105,99 mg /mmol NaHCO3=84,01 mg /mmol HCO3- + H2O H2CO3 + H2O
Datos Experimentales g. muestra = 0,2036 (0.0001)
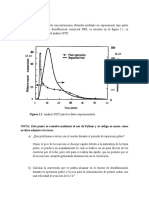
Volmenes de Equivalencia de la Grfica Primera Derivada Veq 1: 6.00 ml (0.02) ml Veq 2: 20.10 ml (0.02) ml
pH vs Volumen HCL
V HCL 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0 5,5 6,0
PH 9.96 9.91 9.85 9.78 9.72 9.63 9.58 9.41 9.29 9.15 8.93 8.61 8.24
V HCL 6,5 7,0 7,5 8,0 8,5 9,0 9,5 10,0 10,5 11,0 11,5 12,0 12,5
PH 7.88 7.71 7.58 7.42 7.35 7.31 7.24 7.15 7.09 7.02 6.95 6.87 6.82
V HCL 13,0 13,5 14,0 14,5 15,0 15,5 16,0 16,5 17,0 17,5 18,0 18,5 19,0
PH 6.79 6.76 6.69 6.65 6.6 6.54 6.49 6.43 6.32 6.26 6.13 6.03 5.86
V HCL 19,5 20,0 20,5 21,0 21,5 22,0 22,5 23,0 23,5 24,0 24,5 25,0
PH 5.3 4.24 3.42 3.19 3.02 2.91 2.71 2.69 2.66 2.61 2.56 2.52
Porcentaje de Na2 CO3 % (p/p) CO3 =
2
y HCO3 en la muestra:
Veq1* CHCL * Na2CO3 * 100% 1 mmol Na2CO3 *1000mg* g. muestra
% HCO3
Veq 2 2Veq 1 * CHCL * NaHCO3 * 100% 1 mmol NaHCO3 *1000mg* g. muestra
Clculos % (p/p) CO3 = 6ml * 0,1268 mol HCL * 105.99mgNa2CO3 * 100%= 39,60% 1 mmol Na2CO3*1000mg*0,2036g muestra % (p/p) HCO3 = 8,1ml * 0,1268 mol HCL * 84,01mgNa2CO3*100%= 42,38% 1 mmol Na2CO3*1000mg*0,2036g muestra
Clculos de error % (p/p) CO3 E Veq1 = 0,02 X 100% = 0,33% 6 E pesada muestra = 0,0001 X 100% = 0,0491% 0,2036 E Relativo % = (0,33)2 + (0,0491) 2 =0,3336 ( 0,3) % % (p/p) HCO3 E Veq 2 2Veq1 = 0,02 X 100% = 0,25% 8 E pesada muestra = 0,0001 X 100% = 0,0491% 0,2036 E Relativo % = (0,25)2 + (0,0491) 2 =0,2547 ( 0,2) %
RESULTADOS % (p/p) CO3 = 39,60 ( 0,3) % % (p/p) HCO3= 42,38 ( 0,2) %
Tabla de Datos de Grficas
Promedio vol 0.25 0.75 1.25 1.75 2.25 2.75 3.25 3.75 4.25 4.75 5.25 5.75 6.25 6.75 7.25 7.75 8.25 8.75 9.25 9.75 10.25 10.75 11.25 11.75 12.25 12.75 13.25 13.75 14.25 14.75 15.25 15.75 16.25 16.75 17.25 17.75 18.25 18.75 19.25 19.75 20.25 20.75 21.25 21.75 22.25 22.75 23.25 23.75 24.25 24.75 Ph -0.05 -0.06 -0.07 -0.06 -0.09 -0.05 -0.17 -0.12 -0.14 -0.22 -0.32 -0.37 -0.36 -0.17 -0.13 -0.16 -0.07 -0.04 -0.07 -0.09 -0.06 -0.07 -0.07 -0.08 -0.05 -0.03 -0.03 -0.07 -0.04 -0.05 -0.06 -0.05 -0.06 -0.11 -0.06 -0.13 -0.1 -0.17 -0.56 -1.06 -0.82 -0.23 -0.17 -0.11 -0.2 -0.02 -0.03 -0.05 -0.05 -0.04 v 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 Ph/v -0.1 -0.12 -0.14 -0.12 -0.18 -0.1 -0.34 -0.24 -0.28 -0.44 -0.64 -0.74 -0.72 -0.34 -0.26 -0.32 -0.14 -0.08 -0.14 -0.18 -0.12 -0.14 -0.14 -0.16 -0.1 -0.06 -0.06 -0.14 -0.08 -0.1 -0.12 -0.1 -0.12 -0.22 -0.12 -0.26 -0.2 -0.34 -1.12 -2.12 -1.64 -0.46 -0.34 -0.22 -0.4 -0.04 -0.06 -0.1 -0.1 -0.08 Promedio vol (pH/V) V. pH/V
2 2
0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9 9.5 10 10.5 11 11.5 12 12.5 13 13.5 14 14.5 15 15.5 16 16.5 17 17.5 18 18.5 19 19.5 20 20.5 21 21.5 22 22.5 23 23.5 24 24.5
-0.02 -0.02 0.02 -0.06 0.08 -0.24 0.1 -0.04 -0.16 -0.2 -0.1 0.02 0.38 0.08 -0.06 0.18 0.06 -0.06 -0.04 0.06 -0.02 0 -0.02 0.06 0.04 0 -0.08 0.06 -0.02 -0.02 0.02 -0.02 -0.1 0.1 -0.14 0.06 -0.14 -0.78 -1 0.48 1.18 0.12 0.12 -0.18 0.36 -0.02 -0.04 0 0.02
0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5
-0.04 -0.04 0.04 -0.12 0.16 -0.48 0.2 -0.08 -0.32 -0.4 -0.2 0.04 0.76 0.16 -0.12 0.36 0.12 -0.12 -0.08 0.12 -0.04 0 -0.04 0.12 0.08 0 -0.16 0.12 -0.04 -0.04 0.04 -0.04 -0.2 0.2 -0.28 0.12 -0.28 -1.56 -2 0.96 2.36 0.24 0.24 -0.36 0.72 -0.04 -0.08 0 0.04
SOLUCION A LAS PREGUNTADAS PLANTEADAS PARA ESTE INFORME 1. Qu es lo que realmente se lee cuando el potencimetro muestra un valor de pH de la solucin? Explique brevemente. R/ Las membranas muy delgadas de vidrio son permeables selectivamente para iones H+. El potencial a travs de sta membrana es un potencial de concentracin debido a diferencias en la concentracin de H+. Las soluciones cidas y bsicas poseen potenciales elctricos medibles por medio de electrodos, el ms usado es el de vidrio, el cual consta de una semicelda de Ag-AgCl inmersa en HCl a una concentracin conocida. La semicelda es un electrodo calomel que consiste de Mg-MgCl en una solucin de KCl a una concentracin conocida. El vidrio de pH es conductor de cargas elctricas porque tiene xido de litio dentro del cristal, adems de xido de slice, de calcio y algunos otros. La estructura del vidrio es tal que permite el intercambio de iones litio por iones de hidrgeno en solucin acuosa, de modo que se forma una capa (fina) hidratada. Se crea as un potencial (del orden mv) a travs de la interface creada entre el vidrio (en el "seno" del vidrio) y la solucin acuosa. El voltaje creado hacia el interior del bulbo es constante porque se mantiene su pH constante (mediante una solucin buffer de pH 7) de modo que la diferencia de potencial depende slo del pH del medio externo. La incorporacin de un alambre (usualmente de Ag/AgCl) permite conducir este potencial hasta un amplificador. Funcionamiento de un Electrodo de pH El mtodo determina el pH midiendo el potencial generado (en mv) por un electrodo, este potencial se compara contra un electrodo de referencia, que genera un potencial constante e independiente del pH. El electrodo de referencia que se utiliza es el de calomel saturado con cloruro de potasio, el cual sirve como puente salino que permite el paso de los mv generados hacia al circuito de medicin. 2. Construya un grfico de pH vs VHCL de l obtenga los volmenes de HCL del primero y segundo punto de equivalencia y a partir de ellos demuestre que: Porcentaje de Na2C03 = V1pe x CHCL x 1,06x104 Mm Porcentaje de NaHC03 = V2pe x CHCL x 8,40x103 Mm Dnde: V1pe = Volumen de HCL del primer punto de equivalencia en ml
V2pe = Volumen de HCL del segundo punto de equivalencia en ml Mm = Masa de la muestra en gramos R/ Ambas ecuaciones estn correctas, ya que lo que realizaron fue multiplicar el peso molecular del carbonato y bicarbonato de sodio por el 100%, y para decir que son correctas lo planteamos as: Porcentaje de Na2C03 = V1pe x CHCL x 1,06x104 Mm* 1000 Porcentaje de NaHC03 = V2pe x CHCL x 8,40x103 Mm * 1000 No obstante segn la representacin de los datos el volumen es en ml, de lo cual afirmamos que es falso, ya que la formula no utiliza factores de conversin para expresar la concentracin, por lo tanto el volumen debe expresarse en litros; para que se cumpla tal como lo plantean.
CONCLUSIONES En este tipo de titulacin encontramos como el anlisis Potenciomtrico, nos permite determinar paralelamente diferentes componentes de una muestra desconocida como en la prctica carbonatos y bicarbonatos.
2 Los porcentajes de las concentraciones de CO3 y HCO3 presentes en la muestra problema 39,60% y 42,38%, respectivamente, nos indica que tena mayor concentracin de HCO3
ANALISIS DE LOS RESULTADOS Al analizar la curva de valoracin de pH vs vol HCl, podemos observar un primer cambio al adicionar 6ml HCl, este volumen nos indica que ya ha 2 reaccionado todo el CO3 y alcanza el primer punto final o P.E, puesto que este pasa a HCO3 A partir del volumen anterior empiezan a reaccionar los HCO3 los cuales van desapareciendo hasta que observamos que se presenta un cambio en el pH an ms abrupto, al adicionar 20ml antes pH=5,3 y despus pH=4,2. Esto nos indica que se alcanz el segundo punto final o P.E. Se debe tener en cuenta que se esperaba que para el segundo P.E volumen gastado fuera el doble del gastado en el primer P.E, a partir de los resultados obtenidos se pudo observar que no fue as sino que se gasto mucho mas debido a que la
muestra contena tambin HCO3-, por lo cual el H2CO3 proveniente de CO32es igual al volumen gastado en el primer P.E, adems como se mencionaba anteriormente, se gasta mas cantidad de HCl debido a que reacciona con el HCO3-, proveniente de la muestra; por lo tanto a la hora de hallar el porcentaje de este presente en la muestra se efectu la siguiente operacin Veq2 2Veq1 para poder calcular el porcentaje real de HCO3
Es decir despus del segundo punto de equivalencia ya han reaccionado todo el bicarbonato, lo cual nos muestra que ya no hay presencia de ninguna de las sustancias en estudio, pero como se queda un exceso de analato HCL, la sustancia que queda es el H2CO3. Su diferencia frente al anlisis volumtrico acido-base radica a pesar de que es un anlisis demorado aporta los datos suficientes para calcular constantes de equilibrio, concentracin de H+ y de las diferentes especies en solucin, a partir de la elaboracin de grficos. Mientras que en el anlisis volumtrico solo es posible identificar el volumen de equivalencia a partir del cambio de color del indicador, y al no aportarnos los datos suficientes nos queda imposible conocer el pH, constantes de equilibrio; adems se necesitan varios anlisis para conocer la cantidad de sustancias presentes en solucin como el caso de los carbonatos y bicarbonatos, puesto que el indicador solo cambia su color en el primer cambio abrupto de pH, no es posible analizar la presencia de ambas especies al mismo tiempo, por lo cual tienen que analizarse por separado.
Potrebbero piacerti anche
- Como Practicar Sexo Tantrico Manual Ilustrado-Abraham VatekDocumento157 pagineComo Practicar Sexo Tantrico Manual Ilustrado-Abraham VatekJessica James96% (25)
- El Hijo Del MillonarioDocumento416 pagineEl Hijo Del MillonariojetzelisNessuna valutazione finora
- Cómo Preparar Auténtico Asado Dominical Inglés con Pudin Yorkshire, Papas, Chirivías Rostizadas y Salsa de CebollaDa EverandCómo Preparar Auténtico Asado Dominical Inglés con Pudin Yorkshire, Papas, Chirivías Rostizadas y Salsa de CebollaNessuna valutazione finora
- REVISTA OFICIAL - Porque Sois Fuertes-2Documento59 pagineREVISTA OFICIAL - Porque Sois Fuertes-2David Delgado100% (1)
- Equilibrio de fases: Un enfoque basado en competenciasDa EverandEquilibrio de fases: Un enfoque basado en competenciasNessuna valutazione finora
- Microbiologia GeneralDocumento669 pagineMicrobiologia Generalururalxela96% (25)
- Aplicación de Técnicas PreventivasDocumento95 pagineAplicación de Técnicas PreventivasPipe CastroNessuna valutazione finora
- Equilibrio QuímicoDocumento34 pagineEquilibrio QuímicoRobert100% (5)
- NTC3884 PDFDocumento16 pagineNTC3884 PDFCarlos Alberto Castañeda Rendon67% (3)
- Coeficientes de Transferencia de Calor Experimental para El Enfriamiento de Licor en IntercambiadoreDocumento11 pagineCoeficientes de Transferencia de Calor Experimental para El Enfriamiento de Licor en IntercambiadoreOscar Rodea OlivaresNessuna valutazione finora
- Capitulo 24-Tarea de API 62 EjerciciosDocumento24 pagineCapitulo 24-Tarea de API 62 EjerciciosJeyson Dueñas Porras100% (2)
- Dialogo Entre Masones Julio 2017Documento190 pagineDialogo Entre Masones Julio 2017HERBERT ORE BELSUZARRI100% (2)
- Esquemas ElectricosDocumento141 pagineEsquemas ElectricosCarlos Martin100% (1)
- Tecnica Dulce de LecheDocumento3 pagineTecnica Dulce de LecheTeFany Csc MousesitaNessuna valutazione finora
- Informe AdsorcionDocumento17 pagineInforme AdsorcionVincenzo Ortega GutierrezNessuna valutazione finora
- Revoluciones Liberales y NacionalesDocumento17 pagineRevoluciones Liberales y NacionalesJackie Kennedy OnassisNessuna valutazione finora
- Trasiego y almacenamiento de aceites de oliva. INAK0109Da EverandTrasiego y almacenamiento de aceites de oliva. INAK0109Nessuna valutazione finora
- Política InformáticaDocumento11 paginePolítica Informáticaanon_278407064100% (1)
- Determinacion de Carbonatos y BicarbonatosDocumento2 pagineDeterminacion de Carbonatos y BicarbonatosAlejandro AngaritaNessuna valutazione finora
- MERMASDocumento24 pagineMERMASRafael ReyesNessuna valutazione finora
- Modelo de Ostwald de WaeleDocumento12 pagineModelo de Ostwald de WaeleDaniel Luis SolanoNessuna valutazione finora
- Preparación de Un Catalizador BimetálicoDocumento8 paginePreparación de Un Catalizador BimetálicoCesar Augusto Henao BalseiroNessuna valutazione finora
- La Eliminación de La Electrólisis Rust - Cómo Quitar El Óxido Con La ElectrólisisDocumento29 pagineLa Eliminación de La Electrólisis Rust - Cómo Quitar El Óxido Con La ElectrólisisRomeo Lopez AyaneguiNessuna valutazione finora
- Practica 5Documento8 paginePractica 5Jennifer Muñoz50% (2)
- Reacción Química y FermentacionDocumento3 pagineReacción Química y Fermentacioncristhiane abadNessuna valutazione finora
- Reporte Destilacion Lopu 2Documento52 pagineReporte Destilacion Lopu 2Salazar SalazarNessuna valutazione finora
- De Pectina A Partir de La Cascara de Maracuyá Mediante Hidrólisis ÁcidaDocumento9 pagineDe Pectina A Partir de La Cascara de Maracuyá Mediante Hidrólisis Ácidaisrael246Nessuna valutazione finora
- Helados PDFDocumento103 pagineHelados PDFAlfaNessuna valutazione finora
- Tarea 2. Absorción de SO2 en AguaDocumento11 pagineTarea 2. Absorción de SO2 en AguaXaviGarciaNessuna valutazione finora
- Filtro Agua LluviaDocumento43 pagineFiltro Agua LluviaJennifferJuradoNessuna valutazione finora
- Fisicoquimica de Los AlimentosDocumento112 pagineFisicoquimica de Los AlimentosWilder Luis Valera GonzalesNessuna valutazione finora
- Destilacion Azeotropica-Acetato de Vinilo - Estacionario - ss0.HscDocumento5 pagineDestilacion Azeotropica-Acetato de Vinilo - Estacionario - ss0.HscDann MoraNessuna valutazione finora
- Obtencion de AcetladehidoDocumento9 pagineObtencion de AcetladehidoAndre HdezNessuna valutazione finora
- Tachos Continuos, Fives Cail PDFDocumento2 pagineTachos Continuos, Fives Cail PDFIdiLab EmprendimientoNessuna valutazione finora
- Manual de Prácticas 2022-1Documento43 pagineManual de Prácticas 2022-1Fabian SánchezNessuna valutazione finora
- Analisis de Agua Conceptos BasicosDocumento19 pagineAnalisis de Agua Conceptos BasicosAndreNessuna valutazione finora
- PatenteDocumento11 paginePatentePedro JuanNessuna valutazione finora
- Ecuacion de ClapeyronDocumento1 paginaEcuacion de ClapeyronPedro NaveGaohNessuna valutazione finora
- MoralidadDocumento5 pagineMoralidadSergioNessuna valutazione finora
- Practica N°2-Titulación PotenciométricasDocumento8 paginePractica N°2-Titulación Potenciométricasmvaca_1Nessuna valutazione finora
- Azúcar+en (1)Documento4 pagineAzúcar+en (1)sarita_seveNessuna valutazione finora
- Obtención de Benzoato de EtiloDocumento23 pagineObtención de Benzoato de EtiloPonce Castillejos Arturo EugenioNessuna valutazione finora
- Ing ReaccionesDocumento33 pagineIng ReaccionesTATIANA CATALINA LÓPEZ ZAPATANessuna valutazione finora
- Termo TDocumento86 pagineTermo TÁngel Esteban RinconesNessuna valutazione finora
- Diseño PropilenglicolDocumento1 paginaDiseño PropilenglicolAngie Paola RamosNessuna valutazione finora
- Laboratorio IQ IV Práctica#1Documento11 pagineLaboratorio IQ IV Práctica#1America AlvarezNessuna valutazione finora
- Informe 1 - Reactores - Docx-1 (Nota 18) - Formato IEEE PDFDocumento8 pagineInforme 1 - Reactores - Docx-1 (Nota 18) - Formato IEEE PDFAlex Pari FarfanNessuna valutazione finora
- Informe Laboratorio Lix CobreDocumento6 pagineInforme Laboratorio Lix CobreYoSoyCharlyeBobaryNessuna valutazione finora
- Acido Acetico - En.esDocumento21 pagineAcido Acetico - En.esLAURA VALENTINA ARIAS RINCONNessuna valutazione finora
- GelatinaDocumento3 pagineGelatinaMarta RodríguezNessuna valutazione finora
- Universidad Privada Del Valle Servicios de Laboratorio Laboratorio de Química Orgánica IiDocumento8 pagineUniversidad Privada Del Valle Servicios de Laboratorio Laboratorio de Química Orgánica IiAlex Crispin VillcaNessuna valutazione finora
- Analisis de SíliceDocumento3 pagineAnalisis de SíliceSheila V. DarcyNessuna valutazione finora
- Rotavapor R 250-250exDocumento8 pagineRotavapor R 250-250exsujey-reyesNessuna valutazione finora
- Saponificación de Un Ácido GrasoDocumento5 pagineSaponificación de Un Ácido Grasodannyrios230% (1)
- Aroma y SaborDocumento2 pagineAroma y SaborElizabeth Sandoval MartinezNessuna valutazione finora
- Resumen Del Proceso CativaDocumento3 pagineResumen Del Proceso CativaAndrea Buendia MataNessuna valutazione finora
- Reactor Tipo Tanque AgitadoDocumento9 pagineReactor Tipo Tanque AgitadoFernandoNessuna valutazione finora
- Aislantes TermicosDocumento9 pagineAislantes TermicosWilsonNessuna valutazione finora
- 13 Determinacion de Acidez en Alimentos de HortalizasDocumento4 pagine13 Determinacion de Acidez en Alimentos de HortalizasVioLeta RebouLenNessuna valutazione finora
- PRACTICA No 5 PolimerizacionDocumento5 paginePRACTICA No 5 PolimerizacionMati PrezzoNessuna valutazione finora
- Reactor de Hidrogenación 3Documento2 pagineReactor de Hidrogenación 3Kelly RLiNessuna valutazione finora
- Producción de Ácido Aspártico y Fenilalanina - Zucchi, Gabriel PabloDocumento46 pagineProducción de Ácido Aspártico y Fenilalanina - Zucchi, Gabriel PabloGabriel ZucchiNessuna valutazione finora
- Discusion 2Documento8 pagineDiscusion 2Luis Enrique100% (1)
- Proyecto Envasadora de LiquidosDocumento7 pagineProyecto Envasadora de LiquidosAndy JhoelNessuna valutazione finora
- Determinación Del Acido Acético en Diferentes Marcas de VinagreDocumento16 pagineDeterminación Del Acido Acético en Diferentes Marcas de VinagreMatadamas AlecitaNessuna valutazione finora
- Esterificacion de FisherDocumento5 pagineEsterificacion de FisherErick SisalemaNessuna valutazione finora
- D CD102078 PDFDocumento171 pagineD CD102078 PDFJavier Solano GaribayNessuna valutazione finora
- Libro de cocina Crock Pot Express: recetas increíbles y saludables en tu Crockpot Multi-cooker (Olla De Cocción Lenta): Crock PotDa EverandLibro de cocina Crock Pot Express: recetas increíbles y saludables en tu Crockpot Multi-cooker (Olla De Cocción Lenta): Crock PotValutazione: 5 su 5 stelle5/5 (1)
- Normatividad de Productos CosméticosDocumento49 pagineNormatividad de Productos Cosméticosluisurieles100% (2)
- AlcaloidesDocumento84 pagineAlcaloidesAntónio TchambuleNessuna valutazione finora
- Clase MicroencapsulaciónDocumento54 pagineClase Microencapsulaciónluisurieles100% (1)
- Resumen FarmaciaDocumento2 pagineResumen FarmacialuisurielesNessuna valutazione finora
- Caracteristicas Fisicas y Quimicas Carbohidratos Blanco y NegroDocumento100 pagineCaracteristicas Fisicas y Quimicas Carbohidratos Blanco y NegroLibardo Castañeda FlorezNessuna valutazione finora
- Validación de Procesos Productivos (MSR y CBM)Documento42 pagineValidación de Procesos Productivos (MSR y CBM)Braulio GonzálezNessuna valutazione finora
- Fisica - Serway Vol.2 (Solucionario)Documento245 pagineFisica - Serway Vol.2 (Solucionario)jen_ilut57% (7)
- SERWAY. VOL.1 - SolucionarioDocumento307 pagineSERWAY. VOL.1 - SolucionarioJean Piere Sloan88% (66)
- Ciencia Tecnologia AlimentosDocumento97 pagineCiencia Tecnologia AlimentosWilber Vilcapoma QuispeNessuna valutazione finora
- Tema 26 Derivadas MuestraDocumento7 pagineTema 26 Derivadas MuestraalbisbisNessuna valutazione finora
- Guic3b3n Tutorial LogiclyDocumento6 pagineGuic3b3n Tutorial LogiclynymgbyNessuna valutazione finora
- Reporte Truchas KathiaDocumento3 pagineReporte Truchas KathiakathiaNessuna valutazione finora
- Sistema Operativo Dos (Resumen)Documento12 pagineSistema Operativo Dos (Resumen)Nore MaestreNessuna valutazione finora
- Conduccion y Tanque de AlmacenamientoDocumento22 pagineConduccion y Tanque de AlmacenamientoOscar Dario Muñoz JaramilloNessuna valutazione finora
- Las Ventajas de Ser MortalDocumento7 pagineLas Ventajas de Ser MortalAnimalesProtegidosAhoraNessuna valutazione finora
- Examen Nivel 1 2023Documento25 pagineExamen Nivel 1 2023steph.takeandgoperuNessuna valutazione finora
- Precursores Del DibujoDocumento22 paginePrecursores Del DibujoGenesis-A-2150% (2)
- ManualUsuario MEP V4.0Documento15 pagineManualUsuario MEP V4.0CLAUDIO TOSOLININessuna valutazione finora
- Cronograma ÉticaDocumento4 pagineCronograma ÉticaJennifer López0% (1)
- Práctica Forense Crua 2022 Módulo 1. ArbitrajeDocumento19 paginePráctica Forense Crua 2022 Módulo 1. ArbitrajeKatheryne VergaraNessuna valutazione finora
- 5.3 Clasificacion Herramientas CaseDocumento23 pagine5.3 Clasificacion Herramientas CaseAnonymous 13bD6J7Nessuna valutazione finora
- Caso Economia IDocumento2 pagineCaso Economia ID'arcy QRNessuna valutazione finora
- Ampliacion de Plazo A La Orden de Servicio #484Documento3 pagineAmpliacion de Plazo A La Orden de Servicio #484Susan Salazar VargasNessuna valutazione finora
- Leccion 1Documento2 pagineLeccion 1leonel21Nessuna valutazione finora
- Acuerdos Escolares de ConvivenciaDocumento30 pagineAcuerdos Escolares de Convivenciajuan jimenezNessuna valutazione finora
- Estudio Del Programa Gubernamental de DesarrolloDocumento8 pagineEstudio Del Programa Gubernamental de DesarrolloJosué BarónNessuna valutazione finora
- Proyecto BocatomaDocumento7 pagineProyecto BocatomaAndrea Carolina Guzman MartinezNessuna valutazione finora
- Costos OcultosDocumento3 pagineCostos OcultosDJ Cristian SNessuna valutazione finora
- Tema 3 Historia Europa MedievalDocumento38 pagineTema 3 Historia Europa MedievalLeo HidalgoNessuna valutazione finora
- Raven, J. C., Court, J. H., & Raven, J. (1993) - Test de Matrices Progresivas - Cuaderno de Matrices - Escalas ColoreadaDocumento16 pagineRaven, J. C., Court, J. H., & Raven, J. (1993) - Test de Matrices Progresivas - Cuaderno de Matrices - Escalas ColoreadaCatherin RiveroNessuna valutazione finora
- LORENA PLESNICAR (2013) - Los y Las Jovenes en El Discurso de Los Anos 1980 de La UnescoDocumento17 pagineLORENA PLESNICAR (2013) - Los y Las Jovenes en El Discurso de Los Anos 1980 de La UnescoFelipe TobarNessuna valutazione finora
- RESUME6N Sa6ndra CARLI2023¿Documento5 pagineRESUME6N Sa6ndra CARLI2023¿Lita CaputoNessuna valutazione finora