Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Lista APFQ - Soluções e Solubilidade
Caricato da
Renata Pinho da SilvaCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Lista APFQ - Soluções e Solubilidade
Caricato da
Renata Pinho da SilvaCopyright:
Formati disponibili
SOLUBILIDADE
1. Suponha um lago em uma cidade a 1000 m de altitude e outro ao nvel do mar. Se ambos estiverem mesma temperatura, qual deles ter maior quantidade de oxignio dissolvido por litro de gua? Justifique sua resposta.
2. A 18C, a solubilidade do cloreto de magnsio de 55,8 g por 100 g de gua. Nesta
temperatura, 150 g de MgCl2 foram misturados em 200 g de gua. Pergunta-se:
a) O sistema obtido homogneo ou
heterogneo? b) Qual a massa de slido dissolvida na gua?
c) Qual a massa de MgCl2 depositada?
d) O que pode ocorrer se aquecermos a mistura?
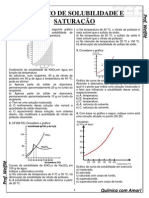
3. dado o grfico: Solubilidade (g A/L solvente) 20 40 50 T (C)
60
100 g de um soluto A foram dissolvidos em 2 L de solvente, a 50C. Com base nessas informaes, responda s questes:
40
a) O conjunto obtido foi homogneo ou
heterogneo?
20
b) Se resfriarmos a soluo a 40C, o
que ocorrer? Especifique a massa dissolvida e a no dissolvida. c) Se resfriarmos a soluo a 20C, qual a massa no dissolvida?
4. A solubilidade do brometo de clcio em gua, a 18C, de 143 g por 100 g de gua.
a) Qual a massa de brometo de clcio que se dissolve em 450 g de gua a 18C? Qual a massa de
gua necessria para se preparar uma soluo saturada de CaBr2 contendo 3864 g desse sal, a 18C?
b) Se a massa molar do CaBr2 vale 200g/mol, a soluo obtida pela dissoluo de 6 mol de CaBr2
em 1 Kg de gua a 18C ser saturada? Justifique sua resposta.
5. A curva de solubilidade de um soluto A em funo da temperatura dada ao lado. Se a 20C
misturarmos 50 g de A com 100 g de gua, quando for atingido o equilbrio teremos: Cs (g A/100 g H2O)
50
10
0 C
20
40
c) Apenas uma soluo Insaturada. a) Um sistema homogneo. b) Um sistema heterogneo. d) Apenas uma soluo saturada. e) Uma soluo supersaturada.
Os dados da tabela abaixo referem-se s questes 6, 7 e 8. Solubilidade do KNO3 em g/100 g de gua Temperatura (C) 12 0 35 20 70 40 115 60
6. Traar a curva de solubilidade do nitrato de potssio nas temperaturas indicadas.
7. A 60 C foi preparada uma soluo de KNO3 pela dissoluo de 345 g do sal em 300 g de gua.
A seguir, a soluo foi resfriada at 20C. Responda: a) A soluo preparada a 60C saturada? Por qu? b) Resfriando-se a soluo at 20C, qual a massa de sal que permanece dissolvida na soluo? c) Qual a massa de sal que cristaliza quando a soluo resfriada a 20C?
8. Um Tcnico recebeu cinco solues de KNO3 com temperaturas e concentraes diferentes,
conforme quadro abaixo: SOLU O A B C D E CONCENTRA O (g/100g de gua) 43 30 50 35 28 TEMPERAT URA (c) 25 40 10 20 5
Intercale as solues acima no grfico da questo 6, e classifique-as em saturadas, insaturadas e supersaturadas. UNIDADES DE CONCENTRAO 9. Uma soluo aquosa de cloreto de sdio (NaCl) tem concentrao igual a 30 g/L. Calcule a massa do sal em 600 mL desta soluo. (Resp. 18 g) 10.100 g de hidrxido de sdio (NaOH) so dissolvidos em 400 mL de soluo. Calcule a concentrao da soluo em g/L? (Resp. 250 g/L)
11.
Calcule a concentrao em g/L, de uma soluo aquosa de nitrato de potssio (KNO3) que contm 60 g do sal dissolvidos em 800 mL de soluo. (Resp. 75 g/L) Evaporou-se totalmente o solvente de 250 mL de uma soluo aquosa de cloreto de magnsio (MgCl2) de concentrao 8g/L. Quantos gramas do soluto foram obtidos? (Resp. 2 g)
12.
13.
80 g de cloreto de potssio (KCl) so dissolvidos em 380 cm3 de gua, originando 400 cm de soluo. Calcule: (dado: dgua = 1 g/cm3)
3
a) A concentrao da soluo em g/L. (Resp. 200 g/L)
b) A densidade da soluo em g/cm3. (Resp. 1,15 g/cm3)
14.
30 g de cloreto de sdio (NaCl) so dissolvidos em 190 g de gua, originando 200 cm3 de soluo. Calcule: (dado: dgua = 1 g/cm3) a) A concentrao da soluo em g/L. (Resp. 150 g/L) b) A densidade da soluo em g/mL. (Resp. 1,1 g/mL)
15.
Uma soluo de barrilha (Na2CO3) tem concentrao igual a 150 g/L. Qual o volume de soluo necessrio para que, por evaporao, obtenhamos 7,5 g de barrilha? (Resp. 0,05 L ou 50 mL)
16.Calcule a massa de hidrxido de sdio (NaOH) necessria para preparar 200 mL de soluo a 50 g/L. (Resp. 10 g)
17.
Dissolvendo-se 50 g de um soluto A em 700 g de um solvente B, obtm-se uma soluo de densidade igual a 0,75 g/cm3. Calcule:
a) O volume da soluo em cm3. (Resp. 1000 cm3)
b) A concentrao da soluo em g/L. (Resp. 50 g/L) 18.Qual a porcentagem em massa de soluto numa soluo que foi preparada dissolvendo-se 20 g de soda custica (NaOH) em 80 g de gua? (Resp. 20 %)
19.
Calcule a porcentagem em massa de soluto numa soluo preparada pela dissoluo de 50 g de salitre (NaNO3) em 150 mL de gua. (Resp. 25 %)
20.80 g de nitrato de potssio so dissolvidos em 240 g de gua. Calcule: a) O ttulo da soluo. (Resp. 0,25) b) O ttulo percentual da soluo. (Resp. 25 %)
21.
Uma amostra de gs amonaco tem 15 % de NH3 em massa. Considere uma amostra de 50 g desta soluo e calcule:
a) A massa de NH3 contida na amostra. (Resp. 7,5 g)
b) A massa de gua contida na amostra. (Resp. 42,5 g)
22. 23.
Calcule a concentrao em g/L de uma soluo de cido sulfrico (H2SO4) que apresenta 98 % de H2SO4 em massa e possui densidade igual a 1,84 g/cm3. (Resp. 1803,2 g/L)
Qual a concentrao em g/L de uma soluo de cido clordrico (HCl), a 36,5 % em massa e densidade 1,185 g/mL? (Resp. 432,5 g/L)
24.Calcule a porcentagem em massa de cloreto de sdio (NaCl) em uma soluo que apresenta 240 g/L e d=1,15 g/mL. (Resp. 20,9%)
25.
Qual a densidade de uma soluo de cido sulfrico (H2SO4) cuja concentrao igual a 668 g/L e apresenta 49,5 % em massa de H2SO4? (Resp. 1,35 g/mL)
26.
Uma soluo de acetona foi preparada pela reunio de 600 mL de acetona pura e 2400 mL de gua. Determine a porcentagem em volume de acetona na soluo (Resp. 20 %)
27.
A gasolina amarela contm 20 % em volume, de etanol. Calcule o volume de lcool etlico (etanol) contido no tanque de um automvel com capacidade para 50 L. (Resp. 10 L de lcool)
28.Calcule o volume de etanol puro contido numa garrafa de cerveja (600 mL) com teor alcolico de 4.6GL. (Resp. 27,6 mL)
29.Qual a molaridade de uma soluo de iodeto de sdio (NaI) que possui 45 g do sal dissolvidos em 400 mL de soluo? (Resp. 0,75 mol/L)
30.Calcule a molaridade de uma soluo aquosa contendo 36,5 g de cido clordrico (HCl) dissolvidos em gua at completar 2 L de soluo. (Resp. 0,5 M)
31.
g)
Calcule a massa de glicose (C6H12O6) dissolvida em 40 mL de soluo molar. (Resp. 7,2
32.
136,8 g de sulfato de alumnio Al2(SO4)3 foram dissolvidos em gua suficiente para 800 mL de soluo. Determine a molaridade da soluo. (Resp. 0,5 M)
33.
Deseja-se preparar 500 mL de soluo de hidrxido de sdio (NaOH) 0,1 M a partir do reagente p. a. Determine a massa de lcali (NaOH) necessria para preparar a soluo. (Resp. 2 g)
34.
Deseja-se preparar 400 mL de soluo M/4 de sulfato de amnio (NH4)2SO4 . Determine a massa do sal que deve ser dissolvida. (Resp. 13,2 g)
35.
Quantos gramas de cloreto de alumnio hexahidratado (AlCl3 . 6 H2O) so necessrios para preparar 2 L de soluo M/10? (Resp. 48,3 g)
36.
Qual a concentrao de ons H+ de uma soluo 0,05 M de cido sulfrico (H2SO4), supondo que ele est 100 % ionizado? (Resp. [H+] = 0,1 M)
37.
500 mL de uma soluo de barrilha (Na2CO3) foram preparados pela dissoluo de 1,06 g do sal. Calcule a molaridade da soluo em relao ao: a) Sal. (Resp. 0,02 M)
b) Aos ons Na+ e CO32-. (Resp. [Na+] = 0,04 M e [CO32-] = 0,02 M) 38.
Uma soluo de fosfato de sdio (Na3PO4) apresenta concentrao da soluo em relao: a) Ao sal. (Resp. 0,15 M)
[Na+] = 0,45 M. Determine a
b) Ao on fosfato (PO43-). (Resp. [PO43-]= 0,15 M)
39.
1 litro de soluo de cido ntrico contm 69,8 % em massa de HNO3 e sua densidade de 1,42 g/mL. Calcule a molaridade da soluo (Resp. 15,7 M)
40.
A concentrao do NaCl na gua do mar , em mdia, 2,95 g/L. Calcule a molaridade da gua do mar em relao ao NaCl. (Resp. 0,05 M)
41.Temos as seguintes solues concentradas: soluo NaOH H2SO4 Densidade (g/mL) 1,43 1,70 % 40 78 Calcule as concentraes molares das solues de hidrxido de sdio e de cido sulfrico. Resp. [NaOH] = 14,3 M e [H2S O4] = 13,5 M
42.
Uma soluo de sulfato frrico Fe2(SO4)3 tem concentrao igual a 320 g/L e densidade igual a 1,25 g/mL. Calcule o ttulo, o ttulo percentual e a molaridade da soluo. (Resp. = 0,256 ; % = 25,6 %; 0,8 M)
43.
totais:
Calcular o equivalente qumico (E) dos seguintes cidos, considerando as neutralizaes
a) H3PO4 b) H2CrO4 c) HClO
d) HNO3 e) H2S f) H2SO4
g) H4SiO4 h) HCN i) HCl
44. Idem ao exerccio anterior, para as seguintes bases:
a) Ba(OH)2 b) Fe(OH)3 c) NH4OH
d) Pb(OH)4 e) Ni(OH)3 f)
NaOH
g) Ca(OH)2 h) Al(OH)3 i)
Mg(OH)2
45. Idem ao exerccio anterior, para os seguintes sais:
a) AgNO3 b) CaSO4 c) (NH4)2SO4
d) BaCl2 . 2 H2O e) CuSO4 . 5 H2O f) Na2SO4 . 10 H2O
g) Zn(NO3)2 h) Ca(NO3)2 i) AlCl3
46. Quantos equivalentes qumicos (e) existem em:
a) 24,5 g de H2SO4
b) 182,5 g de HCl
d) 50 g de CaCO3 e) 78 g de BaCl2 f) 210 g de NH4OH
g) 71 g de Al(NO3)3 h) 98 g de H2SO4
i) 8 g de NaOH
c) 222 g de Ca(OH)2 47.
Calcule a normalidade de 500 mL de soluo que contm 4,9 g de cido sulfrico (H 2SO4) totalmente ionizados. (Resp. 0,2 eq/L)
48. Calcule a normalidade de cada uma das solues abaixo, sabendo que elas contm: item a) b) c) soluto HNO3 cido ntrico Na2CO3 carbonato de sdio Ba(OH)2 hidrxido de brio m1 (g) 31,5 31,8 51,3 V (mL) 250 2000 400 Resp. N (eq/L) 2 0,3 1,5
d)
AlCl3 cloreto de alumnio
80,1
600
49.
Calcular a massa de H2S necessria para preparar 1 litro de soluo N/10, destinada a neutralizao total. (Resp. 1,7 g) Calcular a massa de soluto necessria para preparar as seguintes solues: item a) b) c) d) soluto H2SO4 cido sulfrico Mg(NO3)2 nitrato de magnsio (NH4)2S sulfeto de amnio Al(OH)3 hidrxido de alumnio N (eq/L) 1,5 0,5 3 0,2 V (mL) 400 2500 750 500 Resp. m1 (g) 29,4 92,5 76,5 2,6
50.
51.
Calcule a normalidade (N), a molaridade () e a concentrao g/L (C) de uma soluo de cido fosfrico (H3PO4) contendo 85 % em massa de cido puro e densidade 1,69 g/mL, sabendo que esta soluo ser utilizada em reaes de neutralizao total. (Resp. 44 eq/L ; 14,7 mol/L ; 1436,5 g/L)
52.
Calcular a concentrao g/L, a molaridade e a normalidade de uma soluo de cido sulfrico concentrado p.a. (98% de H2SO4 ; 1,84 g/mL), sabendo que esta soluo ser utilizada numa reao de neutralizao total. (Resp. 1803,2 g/L ; 18,4 mol/L ; 36,8 eq/L)
53.
A anlise de gua clorada proveniente de um poo apresentou os tabela abaixo. Transforme-os em ppm: Parmetro Dureza Alcalinidade total Cloro residual total Cloro residual livre Slidos totais dissolvidos Concentrao em g soluto/100 mL soluo 0,0037 0,0008 0,000045 0,000015 0,022
resultados mostrados na
ppm
54.
A anlise de um apresuntado revelou que a concentrao de nitrato na amostra 0,0019 g de nitrato em 100 g de amostra, ou seja, 0,0019 % (m/m). Qual a concentrao de nitrato na amostra em ppm? Considerando que a concentrao mxima neste tipo de alimento, permitido pelo Ministrio da Sade, de 150 ppm, conclui-se eu este produto prprio ou imprprio para o consumo humano?
55.
Diluindo-se 200 mL de soluo 5 M de cido sulfrico (H 2SO4) a 250 mL, qual a molaridade da soluo diluda? (Resp. 4 M)
56. Que volume de gua destilada devemos acrescentar a 150 mL de soluo 0,8 N de NaOH, a fim de torn-la 0,5N? (Resp. 90 mL de gua)
57.
Que volume de HCl concentrado (36,5 % em massa; 1,184 g/mL) devemos utilizar para preparar 500 mL de soluo 0,5 N? (Resp. V = 21,10 mL)
58.
Deseja-se preparar 1,5 L de soluo 2 M de H 2SO4 a partir da soluo concentrada p.a. (1,84 g/mL ; 98 % em massa). Qual o volume do cido concentrado deve ser utilizado? (Resp. V =163 mL)
59.
Que volume de gua deve ser adicionado a 10 mL de soluo aquosa 0,5 M de HCl para torn-la 0,2 N? (Resp. 15 mL de gua)
60.
Que volume de gua deve ser adicionado a 50 mL de soluo aquosa 0,5 M de H2SO4 para torn-la 0,1 N? (Resp. 450 mL de gua)
61.
Tem-se uma soluo estoque 1 M de permanganato de potssio (KMnO 4) da qual deseja-se preparar 250 mL de soluo 0,2 M de KMnO4. Que o volume da soluo estoque deve ser transferido para o balo volumtrico para fazer a diluio? (Resp. 50 mL da soluo estoque)
Potrebbero piacerti anche
- Lista 2 - Concentração DassoluçõesDocumento4 pagineLista 2 - Concentração Dassoluçõesbrigida.lucinNessuna valutazione finora
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocumento5 pagineLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaNessuna valutazione finora
- Aula Química - Soluções PDFDocumento2 pagineAula Química - Soluções PDF27.marcos9521Nessuna valutazione finora
- 1 Lista de Exercícios - SoluçõesDocumento2 pagine1 Lista de Exercícios - SoluçõesAllyf Ferreira100% (1)
- Exercício de SoluçõesDocumento2 pagineExercício de SoluçõesRodrigo TadeuNessuna valutazione finora
- SOLUÇOESDocumento37 pagineSOLUÇOESVictória Dutra100% (3)
- Exercicios - Instrumentação BiomédicaDocumento2 pagineExercicios - Instrumentação BiomédicaAstreNessuna valutazione finora
- Lista de Exercício SolubilidadeDocumento2 pagineLista de Exercício SolubilidadeJoseNessuna valutazione finora
- Exerci Oc IosDocumento4 pagineExerci Oc Iosvictor silvaNessuna valutazione finora
- ADPFQSDocumento8 pagineADPFQSnickdamas16Nessuna valutazione finora
- Apostila de Exercícios 2Documento16 pagineApostila de Exercícios 2abatubaiNessuna valutazione finora
- SoluçõesDocumento2 pagineSoluçõesQuedma RibeiroNessuna valutazione finora
- Exercicios de ConcentracaoDocumento4 pagineExercicios de Concentracaodkforever0% (1)
- Aula Pratica 5. Soluà à EsDocumento3 pagineAula Pratica 5. Soluà à Esosvaldo pessaneNessuna valutazione finora
- 01Documento7 pagine01Natany AssaiNessuna valutazione finora
- Lista 1Documento4 pagineLista 1Victor gonçalves de sousaNessuna valutazione finora
- Concentração de SoluçõesDocumento2 pagineConcentração de SoluçõesDavid LunaNessuna valutazione finora
- Ficha 32 Exerc CiiosDocumento4 pagineFicha 32 Exerc CiiosmiojoexpelliarmusNessuna valutazione finora
- Exercicios de SolubilidadeDocumento6 pagineExercicios de Solubilidadesua mae de 4Nessuna valutazione finora
- Atividade Sobre Coeficiente de SolubilidadeDocumento13 pagineAtividade Sobre Coeficiente de SolubilidadePedro HélioxNessuna valutazione finora
- Soluções ConcentraçõesDocumento13 pagineSoluções ConcentraçõesWelff Junior100% (2)
- Coeficiente de Solubilidade e Tipos de SaturaçãoDocumento5 pagineCoeficiente de Solubilidade e Tipos de SaturaçãoWelff Junior100% (2)
- Arquivo de Soluções Do Prof° VieiraDocumento9 pagineArquivo de Soluções Do Prof° VieiravieirasalesNessuna valutazione finora
- Gabarito Lista 1 - SoluçõesDocumento5 pagineGabarito Lista 1 - Soluçõesbrigida.lucinNessuna valutazione finora
- Solucoes ResolucaoDocumento39 pagineSolucoes ResolucaoLeandroB.CarneiroNessuna valutazione finora
- Soluções BásicaDocumento4 pagineSoluções BásicaLarissa DalapícolaNessuna valutazione finora
- Lista Química 2º (A, B, C e D)Documento4 pagineLista Química 2º (A, B, C e D)wwwisaque18Nessuna valutazione finora
- Lista de Exercícios de Preparo de SoluçõesDocumento2 pagineLista de Exercícios de Preparo de SoluçõesSILVIOGENTILNessuna valutazione finora
- Lista de Exercícios-1° Bimestre Prof. AndersonDocumento3 pagineLista de Exercícios-1° Bimestre Prof. AndersondankRN100% (1)
- Ficha Exercícios 2 - CONCENTRAÇÕESDocumento6 pagineFicha Exercícios 2 - CONCENTRAÇÕESPaulo OliveiraNessuna valutazione finora
- 2 SolucoesDocumento4 pagine2 Solucoesjuliana dinizNessuna valutazione finora
- SoluçãoDocumento1 paginaSoluçãoBrunoNessuna valutazione finora
- SOLUCOESDocumento15 pagineSOLUCOESRaquel Reis Duarte PinheiroNessuna valutazione finora
- Exercícios SoluçõesDocumento6 pagineExercícios SoluçõesMirela MottaNessuna valutazione finora
- Lista de Exercícios - SoluçõesDocumento3 pagineLista de Exercícios - SoluçõesJeane Rodrigues BrederNessuna valutazione finora
- Lista de ExercíciosDocumento2 pagineLista de ExercíciosDouglas SampaioNessuna valutazione finora
- Concentracoes 2 AnoDocumento5 pagineConcentracoes 2 AnodanzootecNessuna valutazione finora
- EstequiometriaDocumento8 pagineEstequiometriaadfs sadfasdfNessuna valutazione finora
- Exercícios - Aspectos Quantitativos Das SoluçõesDocumento4 pagineExercícios - Aspectos Quantitativos Das Soluçõesppavanin100% (2)
- Ficha de Fixação para 5 Periodo FarmaDocumento4 pagineFicha de Fixação para 5 Periodo FarmaEmídio Junior DuoNessuna valutazione finora
- Questões Concentração ComumDocumento2 pagineQuestões Concentração ComumLucas PontesNessuna valutazione finora
- Gama - Módulo SolucoesDocumento24 pagineGama - Módulo SolucoesAntonio ManuelNessuna valutazione finora
- Lista de Exercícios de Química Revisão Densidade Concentração Comum Concentração MolarDocumento3 pagineLista de Exercícios de Química Revisão Densidade Concentração Comum Concentração MolarLívia EmanuelllyNessuna valutazione finora
- Exercícios para Revisão Prova de Química Titulação/ SubstânciasDocumento5 pagineExercícios para Revisão Prova de Química Titulação/ SubstânciasDara HendgesNessuna valutazione finora
- Exercícios 1 de SoluçõesDocumento3 pagineExercícios 1 de SoluçõesMatheus HenriqueNessuna valutazione finora
- Lista Exercicios 01Documento2 pagineLista Exercicios 01Kalvin LeiteNessuna valutazione finora
- Lista 1 QG 1-19Documento6 pagineLista 1 QG 1-19schottbpNessuna valutazione finora
- 17 18 Concentracao e DiluicaoDocumento6 pagine17 18 Concentracao e Diluicaolfilippe5823Nessuna valutazione finora
- Valor Nota : 1) Uma Solução Pode Ser Definida ComoDocumento4 pagineValor Nota : 1) Uma Solução Pode Ser Definida ComoSuellen CartaxoNessuna valutazione finora
- Lista de Exercícios Quimica Concentração-Título-DiluiçãoDocumento5 pagineLista de Exercícios Quimica Concentração-Título-DiluiçãoGustavoNessuna valutazione finora
- Quimica 2 Ano 2 ParteDocumento19 pagineQuimica 2 Ano 2 ParteJoão PauloNessuna valutazione finora
- Introducao AQuantitativos - 094338Documento2 pagineIntroducao AQuantitativos - 094338Francisco silva cossaNessuna valutazione finora
- Jan2024 - Apostila de Exercícios QuímicaDocumento4 pagineJan2024 - Apostila de Exercícios Químicagabrieleduardo20066Nessuna valutazione finora
- Lista 05Documento4 pagineLista 05RonaldNessuna valutazione finora
- SolubilidadeDocumento4 pagineSolubilidadeCleber SerafinNessuna valutazione finora
- Apostila Química Orgânica: Carbono, Dienos E AromáticosDa EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNessuna valutazione finora
- Apostila Química Orgânica: Terpenos E Rotas De SínteseDa EverandApostila Química Orgânica: Terpenos E Rotas De SínteseNessuna valutazione finora
- Lista1 2016 TermoquímicaDocumento2 pagineLista1 2016 TermoquímicaRenata Pinho da SilvaNessuna valutazione finora
- Artigo Cravo Extração PDFDocumento12 pagineArtigo Cravo Extração PDFRenata Pinho da SilvaNessuna valutazione finora
- Lista APFQ - Soluções e SolubilidadeDocumento7 pagineLista APFQ - Soluções e SolubilidadeRenata Pinho da SilvaNessuna valutazione finora
- Lista EstequioDocumento4 pagineLista EstequioTaviinArauujoNessuna valutazione finora
- Lista EstequioDocumento4 pagineLista EstequioTaviinArauujoNessuna valutazione finora
- 19.20 - CN8 - Terra Um Planeta Com Vida - AE PDFDocumento32 pagine19.20 - CN8 - Terra Um Planeta Com Vida - AE PDFCarol e os Berríos100% (1)
- Espirometria CincottoDocumento25 pagineEspirometria CincottoThiago LacerdaNessuna valutazione finora
- Qui Mic 9697Documento11 pagineQui Mic 9697Fabio AmorimNessuna valutazione finora
- Poeiras Combustíveis - 2010 - Riscos AracajuDocumento26 paginePoeiras Combustíveis - 2010 - Riscos AracajuNicolas150956Nessuna valutazione finora
- Aula 2 - 2016-25-01Documento48 pagineAula 2 - 2016-25-01Drielly MarquesNessuna valutazione finora
- Resolução - RE N º 176, de 24 de Outubro de 2000Documento12 pagineResolução - RE N º 176, de 24 de Outubro de 2000Anderson GomesNessuna valutazione finora
- Alimentos para Gado de LeiteDocumento576 pagineAlimentos para Gado de LeiteWilson Faria100% (1)
- Bulário CoberturasDocumento6 pagineBulário CoberturaspacobilandiaNessuna valutazione finora
- Perda de Carga em EscoamentosDocumento37 paginePerda de Carga em EscoamentosEllen KindermannNessuna valutazione finora
- Dimensionamento de Eixos À FadigaDocumento8 pagineDimensionamento de Eixos À FadigaCleiton RodriguesNessuna valutazione finora
- Protocolo AcetoliseDocumento2 pagineProtocolo AcetoliseFrancione GomesNessuna valutazione finora
- Caminho Das Pedras - ApostilaDocumento24 pagineCaminho Das Pedras - ApostilaShirley CunhaNessuna valutazione finora
- Fispq Alcool Isopropilico PADocumento6 pagineFispq Alcool Isopropilico PAMateus DóriaNessuna valutazione finora
- N 0269 PDFDocumento43 pagineN 0269 PDFAntonio Tadeu MenesesNessuna valutazione finora
- Alimentação de Apis Mellifera AfricanizadasDocumento105 pagineAlimentação de Apis Mellifera Africanizadashugomar1elickerNessuna valutazione finora
- Apostila Cme AtualDocumento22 pagineApostila Cme AtualDébora Durojaye100% (1)
- Trabalho PetroleoDocumento29 pagineTrabalho PetroleoDouglas PachecoNessuna valutazione finora
- Viafloor FluorsilicatoDocumento2 pagineViafloor FluorsilicatoDaniela MelloNessuna valutazione finora
- Dose Resposta HormeseDocumento39 pagineDose Resposta HormeseCatarina SantosNessuna valutazione finora
- Dezesseis CaurisDocumento8 pagineDezesseis CaurisSueli MartinsNessuna valutazione finora
- Exercícios Eletrônica BásicaDocumento40 pagineExercícios Eletrônica BásicaRoger Arcanjo Oliveira100% (3)
- Efeitos Do Congelamento Nos AlimentosDocumento2 pagineEfeitos Do Congelamento Nos AlimentosElisa MohrNessuna valutazione finora
- Apostila Scuba Diving - Sobre EquipamentosDocumento16 pagineApostila Scuba Diving - Sobre EquipamentosWagnerSouzaNessuna valutazione finora
- Vedacit Manta AsfálticaDocumento3 pagineVedacit Manta AsfálticaEduardoBloemerNessuna valutazione finora
- DISSERTAÇÃO - Preparação de Carvão Ativado A Partir de Borra de Café Uso Como Adsorvente e Como Suporte Catalítico para A Remoção de Poluentes Orgânicos em Meio Aquoso PDFDocumento105 pagineDISSERTAÇÃO - Preparação de Carvão Ativado A Partir de Borra de Café Uso Como Adsorvente e Como Suporte Catalítico para A Remoção de Poluentes Orgânicos em Meio Aquoso PDFMatheusLucianoNessuna valutazione finora
- Aula 4 MoagemDocumento37 pagineAula 4 MoagemRui AiresNessuna valutazione finora
- Relatório - Experiência I-ProntoDocumento6 pagineRelatório - Experiência I-ProntoLivia AbreuNessuna valutazione finora
- FISPQ GHS - EcoshineDocumento7 pagineFISPQ GHS - EcoshineSivonildoNessuna valutazione finora
- Fermator Portas PDFDocumento6 pagineFermator Portas PDFGelson SimõesNessuna valutazione finora
- Trabalhos de Desmonte de Rochas PDFDocumento131 pagineTrabalhos de Desmonte de Rochas PDFDanilo PalazzoNessuna valutazione finora