Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Informe Sobre Determinació de Acido Citrico de Jugo de Frutas Comercial
Caricato da
César BermúdezTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Informe Sobre Determinació de Acido Citrico de Jugo de Frutas Comercial
Caricato da
César BermúdezCopyright:
Formati disponibili
UNIVERSIDAD DE SANTANDER-UDES
PRCTICA NUMERO SEIS. DETERMINACIN VOLUMTRICA DE CIDO CTRICO EN JUGOS DE FRUTAS COMERCIALES
LABORATORIO DE ANALISIS QUIMICO INSTRUMENTRAL
CESAR BERMUDEZ COD. 11171014
LINA GARCIA COD.10172025
BACTERIOLOGIA Y LABORATORIO CLINICO
RESUMEN La operacin volumtrica mediante la cual se determina la concentracin de una solucin a partir de otra solucin de concentracin conocida y con la cual reacciona qumicamente se denomina titulacin. Esta operacin volumtrica se fundamenta en la neutralizacin que experimentan las dos soluciones al reaccionar y que se puede evidenciar al conseguir mediante un el cambio uso de de un coloracin indicador
valoracin de cidos mediante lcalis (bases) y la alcalimetra es la valoracin de lcalis mediante cidos. El indicador utilizado vira de color cuando el pH de la solucin cambia e indica que la cantidad estequiometrica compuesto para producir al poner un en
conocido
contacto el cido y la base ha sido alcanzada. Esto permite el clculo de concentraciones o volmenes de cidos o bases a partir de los datos de una solucin conocida.
apropiado. Existen dos variantes en la valoracin volumtrica: acidimetra y alcalimetra. La acidimetra es la
INTRODUCCIN En el anlisis volumtrico la cantidad de sustancia que se busca se determina de forma indirecta midiendo el volumen de una disolucin de concentracin
Adquiri preparacin
destreza de
en
la
soluciones
acuosas de sales cidos y bases. Se utilizo valoraciones acido-base para determinar el contenido de cidos en una muestra problema PARTE EXPERIMENTAL MATERIALES Vaso precipitado (100ml). Balanza analtica. Pipeta graduada de (5 ml, 10ml). Tubos de ensayo. Pera. Gradilla. Dos vasos precipitados (250ml). Un churrusco. Baln aforado (100 ml). Un frasco lavador. Barra agitadora de vidrio. Frasco lavador. Erlenmeyer (250ml). Aro con nuez. HCL. NAOH. Carbonato de sodio. Anaranjado de metilo. Bureta. Fenolftalena.
conocida. El proceso de adicin de un volumen medido de la disolucin de concentracin conocida para que
reaccione con el constituyente buscado, se denomina valoracin. La disolucin de concentracin conocida es una
disolucin patrn, que puede prepararse de forma directa mediante o por normalizacin con un patrn
reaccin
primario. El punto final de la valoracin se aprecia por un cambio brusco de alguna propiedad Estimado este del sistema un
reaccionante. indicador,
mediante
cambio
debera
presentarse idealmente en el momento en que se haya aadido una cantidad de reactivo buscada, equivalente es decir, a la en sustancia el punto
estequiometrico del a reaccin.
OBJETIVOS Se adquiri habilidades en la valoracin de soluciones. Se aplic los y conceptos los de
soluciones
clculos
relacionados con la concentracin de la muestra problema.
3. Valoracin de NaOH. METODOLOGIA 1. Preparacin de las soluciones para estandarizar.
Aadir 5 ml de NaOH, mas 50 Ml de agua destilada y agitar.
Determininar las moles de NaOH.
Pesar en un vaso precipitado de 50 ml 1,15 g y 1,25g , por aparte de Na2CO3. Cargar bureta con HCL y determinar el punto de equivalencia.
Aadir dos gotas de fenolftaleina y agitar. Aadir 50 ml de agua destilada.
Calcular las concetraciones de cada solucion realizada.
4. Determinar contenido de acido ctrico
2. Valoracin de la soluciones. . Aadir 15 mL de la solucion estandar, por aparte cada una , a un vaso precipitado de 250 ml . Cargar la bureta completa con HCl 0,1N . Denotar punto de equivalencia y hallar numero de moles del acido.
Aadir dos gotas de anaranjado de metilo y mezclar.
Aadir 10 ml de jugo a probeta mas 20 ml de agua destilada.
Agregar dos gotas de fenolftale ina y tomar NaoH valorado.
Titular , hallar concentr acion y realizar por duplicado .
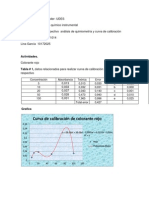
RESULTADOS Y DISCUSION
3. Valoracin del NaOH las
Punto de equivalencia (fucsia a transpatrente)= 7,6 ml V HCl*M HCl= M NaOH * V NaOH 55 * 0.0475/7,6=0,34 M NaOH -Molaridad de NaOH original V1*C1=V2*C2 5*C1=0,34*55 C1=0,34*55/5= 3,74 M Solo se realizo una prueba por falta del componente del HCL.
1. Clculos concentraciones soluciones.
M=# de moles/L
de de
las
# Moles= peso dado /peso molecular 1L______________1000mL Sln (a) # Moles=0,15/106= 0,41* 10 -3 50 ml (1L/1000ml) = 0, 05 L M Na2CO3= 0, 4 * 10-3/0.05=28*10-3 Sln (b) # Moles=0,25/106= 2,35* 10 -3 M Na2CO3= 2,35 * 10-3/0.05=0,047
4. Concentracin de acido ctrico.
Titulacin (amarillo a naranja): 1,5 ml y 1,6 ml = 1,55 V NaOH* M NaOH= V acido ctrico *M acido ctrico 1,55*3,74=30 * M acido ctrico M acido ctrico= 1,55 *3,74/30=0.1 M
2. Molaridad del HCl
Punto de equivalencia para sln (rojofucsia) b)=12ml
En un jugo hit de caja de sabor de M= V Na2CO3*M V Na2CO3/V HCl Sln (a) M=15 * 28* 10*-3/9.3= 0,045 Sln (b)= 15 * 0,47/12= 0,05 Promedio de la molaridad de mango que contiene 200 ml (0,2L) contiene 0,6 gramos de acido citrico. 0,1 g_______________30 ml X_________________200 ml X=200*0,1/30=0,6g
HCL=0,045+0,05/2= 0,0475
CONCLUSIONES -Tener fundamentos matemticos para realizar ecuaciones es primordial para no cometer errores sistemticos. -Por medio de clculos en regla de tres se puede realizar prcticas a menor escala en relacin a los componentes utilizados. -Al hallar el punto de equivalencia, se debe controlar con cuidado la medida para realizar la ecuacin
BIBLIOGRAFIA
http://perso.wanadoo.es/sergiora m1/espectrofotometria.htm
Anlisis
qumico
instrumental
moderno, Harold F. Walton, J Reyes
correspondiente. -Los indicadores de pH tiene un papel importante para establecer en nivel exacto en relacin al viraje del color. -El montaje para anlisis volumtricos debe estar bien ajustado para evitar daos del material. -Se debe lavar con jabn especial, para quitar residuos de los cidos con el
objetivo de que no se realicen reacciones con otros componentes que se van a utilizar de nuevo con el instrumento lo cual podr arrojara falsos resultados. -El descarte de los componentes y mezclas realizadas se deben eliminar en recipientes dados, para despus realizar el proceso ms veras para su
destruccin,
neutralizacin,
reciclaje,
entre otros, evitando afectar otros seres.
Potrebbero piacerti anche
- Conclusiones Determinacion de Cloruros Por ArgentometriaDocumento1 paginaConclusiones Determinacion de Cloruros Por ArgentometriaSaida Rodriguez VillarrealNessuna valutazione finora
- Informe-6-Organica-II Obtencion Del JabonDocumento3 pagineInforme-6-Organica-II Obtencion Del JabonAdrian De Jesus MontielNessuna valutazione finora
- Practica Valoracion de H2o2Documento3 paginePractica Valoracion de H2o2ABRACADAVER!100% (1)
- Determinación Del Contenido de Ácido Tartárico en Una Muestra de VinoDocumento1 paginaDeterminación Del Contenido de Ácido Tartárico en Una Muestra de VinoOriana Salas100% (1)
- ACIDIMETRÍADocumento4 pagineACIDIMETRÍAkarol321100% (1)
- Informe # 1 Titulacion PotenciometricaDocumento19 pagineInforme # 1 Titulacion PotenciometricaAnonymous PSYFnpcNessuna valutazione finora
- Argentometria 9Documento7 pagineArgentometria 9Juan José Hernández Torres100% (1)
- Determinacion Gravimetrica de SulfatosDocumento3 pagineDeterminacion Gravimetrica de Sulfatossalma de la rosa100% (1)
- #1 Informe Titulación Ácido BenzoicoDocumento6 pagine#1 Informe Titulación Ácido BenzoicoSamuel Flores RamirezNessuna valutazione finora
- Tarea Semana 2Documento6 pagineTarea Semana 2brayan jordi rodriguez guizadoNessuna valutazione finora
- Informe de Analisis YODO-YODIMETRIADocumento7 pagineInforme de Analisis YODO-YODIMETRIAAndrés SánchezNessuna valutazione finora
- Practica 2 Determinacion Del Cloruro Del Metodo MohrDocumento5 paginePractica 2 Determinacion Del Cloruro Del Metodo MohrJosmarlyn MartinezNessuna valutazione finora
- Titulacion Potenciometrica Del Acido Fosforico en Coca-ColaDocumento25 pagineTitulacion Potenciometrica Del Acido Fosforico en Coca-Colaantony1falconNessuna valutazione finora
- Métodos de Analisis de Agua de CalderasDocumento7 pagineMétodos de Analisis de Agua de CalderasKsitaNessuna valutazione finora
- Practica 1 Preparacion y Estandarizacion de Soluciones NaOH y HCLDocumento6 paginePractica 1 Preparacion y Estandarizacion de Soluciones NaOH y HCLDooSik PreñameNessuna valutazione finora
- PRACTICA 4 ANALISIS POR RETROVALORACION (Aspirina) PDFDocumento3 paginePRACTICA 4 ANALISIS POR RETROVALORACION (Aspirina) PDFDiana SalcedoNessuna valutazione finora
- Determinación de Hierro en Una Muestra Por GravimetríaDocumento7 pagineDeterminación de Hierro en Una Muestra Por GravimetríaMercedes100% (1)
- Informe3 AlcalinidadDocumento12 pagineInforme3 AlcalinidadMishell Andrea Macías MonserrateNessuna valutazione finora
- Fundamentos Basicos de ArgentometriaDocumento3 pagineFundamentos Basicos de ArgentometriaLeslie WayneNessuna valutazione finora
- Reacciones de PrecipitaciónDocumento4 pagineReacciones de PrecipitaciónVP LeonelNessuna valutazione finora
- Titulación PotenciométricaDocumento28 pagineTitulación PotenciométricaroshanythaNessuna valutazione finora
- PRÁCTICA 3. Saponificación de Una GrasaDocumento11 paginePRÁCTICA 3. Saponificación de Una Grasamaria fernanda moralesNessuna valutazione finora
- Informe Lab Analitica N6vol Por RetrocesoDocumento10 pagineInforme Lab Analitica N6vol Por RetrocesoLuisReáteguiQuirozNessuna valutazione finora
- Informe de Lab. ComplexometriaDocumento10 pagineInforme de Lab. Complexometriaiaraneda30Nessuna valutazione finora
- Laboratorio 4 5 6 7Documento3 pagineLaboratorio 4 5 6 7Wanda Polet Salvatierra Paz0% (3)
- Informe de Calibracion de Material de Vidrio en Lab de AnaliticaDocumento10 pagineInforme de Calibracion de Material de Vidrio en Lab de Analiticaemma streep100% (1)
- Determinación Gravimétrica de Una Sal Soluble de CuDocumento9 pagineDeterminación Gravimétrica de Una Sal Soluble de CuMake emo, great againNessuna valutazione finora
- Evaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDocumento3 pagineEvaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDayana BotelloNessuna valutazione finora
- Titulacion Yodimetrica de Vitamina CDocumento5 pagineTitulacion Yodimetrica de Vitamina ClorenaNessuna valutazione finora
- Informe Cuantificacion de Vitamina CDocumento7 pagineInforme Cuantificacion de Vitamina CMarcelo CucasNessuna valutazione finora
- Discusion Calor de NeutralizacionDocumento1 paginaDiscusion Calor de NeutralizacionAngel Gabriel MontoyaNessuna valutazione finora
- Introducción A Los Métodos VolumétricosDocumento18 pagineIntroducción A Los Métodos VolumétricosRonaldo Cañas BarreiroNessuna valutazione finora
- Determinación de Ácido Acético en Vinagre Mediante TitulaciónDocumento4 pagineDeterminación de Ácido Acético en Vinagre Mediante TitulaciónCarolina Ordóñez100% (3)
- Volumetría de Neutralización UNSA (2) y OrecipitaciónDocumento142 pagineVolumetría de Neutralización UNSA (2) y OrecipitaciónAlejandro Zambrano50% (2)
- LABORATORIO N 3 Determinación de Acido Acetico en VinagreDocumento14 pagineLABORATORIO N 3 Determinación de Acido Acetico en VinagreGary PlacenciaNessuna valutazione finora
- Reporte CromatografíaDocumento5 pagineReporte CromatografíaJosué PalmaNessuna valutazione finora
- Volumetría de Formación de Complejos - EstudiantesDocumento8 pagineVolumetría de Formación de Complejos - EstudiantesAlejandra DíazNessuna valutazione finora
- GHDocumento3 pagineGHMarco Antonio Zamora VargasNessuna valutazione finora
- Practica N 3 Volumetria Por RetrocesoDocumento6 paginePractica N 3 Volumetria Por RetrocesoAlejandra NuñezNessuna valutazione finora
- AcidimetriaDocumento6 pagineAcidimetriaWiliams CHNessuna valutazione finora
- Informe 1 Solubilizacion de Principios ActivosDocumento10 pagineInforme 1 Solubilizacion de Principios ActivosDaniela LozanoNessuna valutazione finora
- NAOHDocumento3 pagineNAOHCarlos Valera MtzNessuna valutazione finora
- Gravime. I.agr.20.Corregido ProblemaDocumento28 pagineGravime. I.agr.20.Corregido ProblemaDANIEL CHAVEZ MICHANessuna valutazione finora
- Caracterizacion de Aminoacidos y ProteinasDocumento14 pagineCaracterizacion de Aminoacidos y ProteinasAngela Soto Rivera100% (1)
- Informe de Laboratorio Dureza TotalDocumento15 pagineInforme de Laboratorio Dureza TotalRodrigo Andres Alarcón FranchiniNessuna valutazione finora
- Informe de Gravimetria de CalcioDocumento5 pagineInforme de Gravimetria de Calcioandres guerrero100% (1)
- 26436.ejercicio Del Cuestionario 8Documento3 pagine26436.ejercicio Del Cuestionario 8Camila Córdova LópezNessuna valutazione finora
- INFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDocumento13 pagineINFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDimar MontejoNessuna valutazione finora
- Informe 5 Determinación de Acidez Total en Un VinoDocumento10 pagineInforme 5 Determinación de Acidez Total en Un Vinoandres ardilaNessuna valutazione finora
- Informe YodometriaDocumento8 pagineInforme YodometriaEmiliano Picconi0% (1)
- Informe de EstandarizaciónDocumento30 pagineInforme de EstandarizaciónGino AragonNessuna valutazione finora
- Ácido BenzoicoDocumento8 pagineÁcido BenzoicoMoises EstradaNessuna valutazione finora
- Determinacion de La Curva de SolubilidadDocumento3 pagineDeterminacion de La Curva de Solubilidaddavid viloriaNessuna valutazione finora
- Metodo MohrDocumento2 pagineMetodo MohrEdgar Pineda0% (1)
- ALCALIMETRIADocumento42 pagineALCALIMETRIASTEFHANY PAOLA MENDOZA HERNANDEZNessuna valutazione finora
- Imforme Determinación de Ácido CítricoDocumento8 pagineImforme Determinación de Ácido CítricoMaria MendozaNessuna valutazione finora
- Determinacion Gravimetrica de SulfatosDocumento4 pagineDeterminacion Gravimetrica de SulfatosElizitaGC0% (1)
- Práctica 2. Preparación y Estandarización de DisolucionesDocumento7 paginePráctica 2. Preparación y Estandarización de DisolucionesLuis RuizNessuna valutazione finora
- Practica 4 Aplicaciones de Neutralizacion Determinacion de AcidezpruebaDocumento5 paginePractica 4 Aplicaciones de Neutralizacion Determinacion de AcidezpruebaDiego OlivaresNessuna valutazione finora
- Practica # 7 Preparación de Soluciones Valoradas 1Documento16 paginePractica # 7 Preparación de Soluciones Valoradas 1Heidi MauNessuna valutazione finora
- 06-05-2014,13-42-47ev Conocimientos Guia 7Documento5 pagine06-05-2014,13-42-47ev Conocimientos Guia 7César BermúdezNessuna valutazione finora
- Alteraciones Hematológicas en El DengueDocumento15 pagineAlteraciones Hematológicas en El DengueCésar Bermúdez100% (1)
- Diapositivas para El Articulo de Club de RevistasDocumento16 pagineDiapositivas para El Articulo de Club de RevistasCésar BermúdezNessuna valutazione finora
- Alteraciones Hematológicas en El DengueDocumento15 pagineAlteraciones Hematológicas en El DengueCésar Bermúdez100% (1)
- Escaldado, Termización y PasteurizaciónDocumento24 pagineEscaldado, Termización y PasteurizaciónCésar Bermúdez100% (1)
- Tabla de Informe de Reconocimiento de AminoácidosDocumento1 paginaTabla de Informe de Reconocimiento de AminoácidosCésar BermúdezNessuna valutazione finora
- Identificación de Staphylococcus y StreptococcusDocumento1 paginaIdentificación de Staphylococcus y StreptococcusCésar BermúdezNessuna valutazione finora
- Aislamiento de Enterobacterias en Lactuca Sativa, LechugaDocumento19 pagineAislamiento de Enterobacterias en Lactuca Sativa, LechugaCésar BermúdezNessuna valutazione finora
- Problemas UniversitariosDocumento3 pagineProblemas UniversitariosCésar Bermúdez100% (3)
- Información General Sobre Plasma Rico en PlaquetasDocumento2 pagineInformación General Sobre Plasma Rico en PlaquetasCésar BermúdezNessuna valutazione finora
- Clostridium SPPDocumento69 pagineClostridium SPPCésar Bermúdez100% (2)
- Informe Sobre Preparacion de SolucionesDocumento6 pagineInforme Sobre Preparacion de SolucionesCésar Bermúdez100% (1)
- Informe Sobre Analisis Gavimetrico de Azucares Re Duct OresDocumento8 pagineInforme Sobre Analisis Gavimetrico de Azucares Re Duct OresCésar BermúdezNessuna valutazione finora
- Informe Sobre Quimiometría y Curva de Calibración.Documento6 pagineInforme Sobre Quimiometría y Curva de Calibración.César BermúdezNessuna valutazione finora
- Mapa Conceptual - Analisis QuimicoDocumento2 pagineMapa Conceptual - Analisis QuimicoCésar Bermúdez100% (3)
- Modelo Del Poster 1Documento1 paginaModelo Del Poster 1César BermúdezNessuna valutazione finora
- Trabajo de Curva de CalibraciónDocumento3 pagineTrabajo de Curva de CalibraciónCésar BermúdezNessuna valutazione finora
- Informe Sobre Calibracion de Micro Pip EtaDocumento5 pagineInforme Sobre Calibracion de Micro Pip EtacegubemeNessuna valutazione finora
- Ensayo de Expo Sic Ion UnoDocumento1 paginaEnsayo de Expo Sic Ion UnoCésar BermúdezNessuna valutazione finora
- Aplicacion de Ecuaciones Difernciales-Final-2KATHERINE1Documento16 pagineAplicacion de Ecuaciones Difernciales-Final-2KATHERINE1Eswin RumarioNessuna valutazione finora
- Caso KaleaDocumento4 pagineCaso KalearocholfoNessuna valutazione finora
- Antonie - Aurum Potabile (DR FR)Documento2 pagineAntonie - Aurum Potabile (DR FR)Juan BubuNessuna valutazione finora
- El Otro SenderoDocumento11 pagineEl Otro SenderoEmerson Jack Centurion VasquezNessuna valutazione finora
- PorcentajeDocumento1 paginaPorcentajekarina evens0% (1)
- CONTABILIDADDocumento9 pagineCONTABILIDADLais Gabriela CadoreNessuna valutazione finora
- NT.00039.GN-SP - Ess Trabajos en AlturaDocumento23 pagineNT.00039.GN-SP - Ess Trabajos en AlturarcalveterNessuna valutazione finora
- Antecedentes de La Pericia en El MundoDocumento2 pagineAntecedentes de La Pericia en El MundoVICTORIA QUISPE MALLQUINessuna valutazione finora
- Actvidad Gtic U2 A1 DTGDDocumento2 pagineActvidad Gtic U2 A1 DTGDdanna tellez100% (2)
- Caso Accenture El Acento Esta en El NombreDocumento0 pagineCaso Accenture El Acento Esta en El NombreVirginia Navarro100% (1)
- Plan Financiero 3emDocumento4 paginePlan Financiero 3emLluvi CorreaNessuna valutazione finora
- LAGACETA01AGLPDocumento48 pagineLAGACETA01AGLPLaGacetadeCanariasNessuna valutazione finora
- EJERCICIOSDocumento3 pagineEJERCICIOSStig xDNessuna valutazione finora
- Pliego BarivenDocumento54 paginePliego BarivenJose Rodriguez0% (1)
- Resumen Susana TorradoDocumento15 pagineResumen Susana TorradoLauta Diaz CoutoNessuna valutazione finora
- Trabajo Final de Introduccion A La Ingenieria Grupo 41010Documento8 pagineTrabajo Final de Introduccion A La Ingenieria Grupo 41010Watson Alexander Luis RodriguezNessuna valutazione finora
- Proyecto Ecoturistico Chimichagua - Cesar-Noviembre 2019.Documento75 pagineProyecto Ecoturistico Chimichagua - Cesar-Noviembre 2019.Domingo Martinez Menco.Nessuna valutazione finora
- Estrategia de Entrada A Los Negocios InternacionalesDocumento17 pagineEstrategia de Entrada A Los Negocios InternacionalessantiagoNessuna valutazione finora
- OñaKevin Prueba2Documento6 pagineOñaKevin Prueba2PaOla OñaNessuna valutazione finora
- INFORME Ampliacion de PlazoDocumento13 pagineINFORME Ampliacion de PlazoManuel QuispeNessuna valutazione finora
- Trabajo Marco Logico TRABAJO TERMINADODocumento13 pagineTrabajo Marco Logico TRABAJO TERMINADOJose Luis Abad QuezadaNessuna valutazione finora
- Conozca Los Requisitos para Abrir Un Nuevo Negocio de Productos AlimenticiosDocumento3 pagineConozca Los Requisitos para Abrir Un Nuevo Negocio de Productos AlimenticiosLuz Katerine Martinez CrespoNessuna valutazione finora
- Almacenamiento Del CementoDocumento1 paginaAlmacenamiento Del CementoYerko Castillo MoralesNessuna valutazione finora
- Capitulo Del Estudio TecnicoDocumento7 pagineCapitulo Del Estudio TecnicoCecy De LeónNessuna valutazione finora
- Carta de Invitacion para Realizar Una AuditoriaDocumento69 pagineCarta de Invitacion para Realizar Una Auditorianelk100% (2)
- UNMSM E S13 Ergonomia y Mejora de ProcesosDocumento33 pagineUNMSM E S13 Ergonomia y Mejora de ProcesosrenzoNessuna valutazione finora
- ZAL Valparaiso ChileDocumento36 pagineZAL Valparaiso ChileborgesjnNessuna valutazione finora
- Proyeccion de VentasDocumento14 pagineProyeccion de VentasFriso 45Nessuna valutazione finora
- RAMOS ANGELES, Jesús - Fiscalidad Del Leasing en El IR e IGV - Caballero Bustamante, Thomson Reuters - Num 777 2da Quincena Febrero 2014 PDFDocumento4 pagineRAMOS ANGELES, Jesús - Fiscalidad Del Leasing en El IR e IGV - Caballero Bustamante, Thomson Reuters - Num 777 2da Quincena Febrero 2014 PDFJesús Alberto Ramos AngelesNessuna valutazione finora
- LoriRockett - ESTRATEGIA DEL OCÉANO AZULDocumento23 pagineLoriRockett - ESTRATEGIA DEL OCÉANO AZULJorsant Ed100% (1)