Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Curva Farmacocinetica
Caricato da
Juan Carlos Cruz SanchezTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Curva Farmacocinetica
Caricato da
Juan Carlos Cruz SanchezCopyright:
Formati disponibili
PAGINA 4 CONSULTOR DE SALUD | Nº 377 INSTITUCIONAL
ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA MEDICA A.N.M.A.T.
3º
PARTE
La ANMAT y la bioequivalencia
La Farmacocinética es entendida como la BIOEQUIVALENCIA, es decir, el estudio de los procesos
a los que es sometido un principio activo desde el momento en que ingresa al organismo. En síntesis, la
farmacocinética es el estudio cuantitativo de las relaciones diferenciales entre tiempo y concentración.
GENERALIDADES SOBRE do corresponda, tanto por el productor origi-
FARMACOCINÉTICA CLÍNICA nal como por el productor de similares. Un
caso en el cual el productor original debe rea-
L as relaciones entre medicamento y
paciente, son sumamente complejas.
Se define a la Farmacodinamia como
el impacto que el principio activo produce
lizar estudios de Bioequivalencia, es cuando,
a través de las fases clínicas de desarrollo del
producto utiliza una tecnología farmacéutica
dada, pero al finalizar dicho desarrollo (4-5
sobre el organismo (mecanismo de acción, años), desea poner en el mercado el medica-
modo de acción, acción y efecto). mento con la mejor tecnología, en este caso
La farmacocinética es el estudio de los debe demostrar Bioequivalencia entre el pro-
procesos a los que es sometido un principio ducto con la nueva tecnología (Producto
activo desde el momento en que ingresa al Test) y el producto con que se demostró la
organismo, los cuales pueden ser cuantifica- eficacia y seguridad (Producto de
dos mediante dos variables fundamentales, Referencia). Asimismo, cabe destacar, que el
una independiente -el tiempo- y la otra cambio de sitio de elaboración es un punto
dependiente -la concentración en un sitio crítico para la bioequivalencia.
determinado (compartimiento)-. En síntesis, Para establecer la bioequivalencia, exis-
la farmacocinética es el estudio cuantitativo ten criterios bien definidos. La OPS/OMS
de las relaciones diferenciales entre tiempo (1999) establece que es la "serie de normas y
y concentración. También puede establecer- procedimientos estadísticos cuyo empleo
se que la farmacocinética es el estudio de la permite decidir si dos productos medicamen-
velocidad con que un principio activo pasa tosos muestran similar biodisponibilidad,
de un compartimiento a otro. En este con- siendo uno de ellos el producto medicamen-
texto, Velocidad es entendida como la canti- toso de referencia. Según la Administración
dad de moléculas que traviesan una mem- de Alimentos y Medicamentos (FDA) esta-
brana en la unidad de tiempo. Los grandes dounidense, el producto de prueba, como
capítulos explorados por la farmacocinética célula, droga-receptor, acoplamiento receptor- 1.- Área Bajo la Curva (AUC o ABC): regla general, no debe diferir del producto de
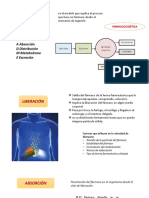
se conocen como "Sistema LADME", ini- efecto, cooperación entre receptores, etc. conocida como "exposición total", es el área referencia en más de un 20% en relación a
ciales de Liberación, Absorción, Distrib- La biodisponibilidad es la velocidad y can- bajo la curva concentración-tiempo, y repre- los parámetros de biodisponibilidad, por
ución, Metabolismo (Biotransformación) y tidad con que un principio activo alcanza el senta una función de la cantidad total de ejemplo, área bajo la curva, concentración
Excre-ción, que significan lo siguiente: sitio de acción (disponibilidad biológica). droga biodisponible. Las Áreas Bajo la Curva máxima, tiempo para alcanzar la concentra-
* La Liberación comprende a todos los Ocurre que, clínicamente es imposible deter- son: AUC0-t (área concentra-ción/tiempo ción máxima, etc.".
fenómenos que intervienen en la entrega del minar la cantidad de principio activo en el sitio entre tiempo 0 y la última determinación rea-
principio activo desde la forma farmacéutica. de acción. Se sabe, que la concentración de una lizada en la matriz biológica estudiada, por ETAPA ESTADÍSTICA:
* La Absorción es la penetración de las droga en la biofase (sitio de acción) es propor- ejemplo, sangre, plasma o suero) y AUC0-
moléculas del principio activo en la circulación. cional a la concentración de principio activo en Infinito, que es el área determinada entre el Todo estudio de bioequivalencia, atravie-
* El Metabolismo o Biotransformación la circulación sistémica, de allí que surge el tiempo 0 y su extrapolación a tiempo infinito, sa por tres etapas: clínica (internación de los
son todos los procesos químicos a los que es concepto "operativo" de BIodisponibilidad: a partir de AUC0-t. El AUC0-t, nunca debe voluntarios, extracción de muestras, contro-
sometido el principio activo en los órganos velocidad y cantidad con que un principio acti- ser inferior al 80% del total. les), bioanalítica (análisis de las muestras) y
pertinentes. Puede dar como resultado molé- vo, liberado desde una forma farmacéutica, 2.- Concentración Plasmática Máxima estadística (evaluación estadística de los
culas menos activas (biodegradación), igual- alcanza la circulación sistémica (OMS/OPS, (Cmáx): también conocida como "exposición resultados).
mente activas o más activas (bioactivación) 1999; Iannantuono y Tessler, 1994). puntual" cuantifica la velocidad de absorción La etapa estadística es sumamente crítica
que el compuesto originalmente administrado. La Biodisponibilidad se divide en del principio activo. Cmáx. Está determinada pues en ella se decide si existe o no bioequi-
* La Distribución es el proceso por el Absoluta y Relativa. Se entiende por por el equilibrio de velocidades (velocidad valencia. El análisis estadístico debe seguir
cual el principio activo pasa en mayor o Biodisponibilidad Absoluta, a la compara- de entrada y velocidad de salida). una metodología, que en líneas generales es
menor medida del compartimiento vascular ción entre la biodisponibilidad de una forma 3.- Tiempo necesario para alcanzar Cmáx la siguiente:
al compartimiento extravascular. farmacéutica no intravascular, respecto a la (Tmáx): es también función de la velocidad, a) Estadística descriptiva (descriptores de
* Finalmente, la Excreción es la salida biodisponibilidad de una forma farmacéutica pero además brinda información sobre canti- tendencia central y de dispersión) de las
del principio activo o su/s metabolito/s fuera administrada por vía intravascular (habida dad absorbida. determinaciones realizadas y de los paráme-
del organismo. cuenta que por vía intravascular no existe La Bioequivalencia (OMS/OPS,1999) es tros obtenidos (AUC0-t, AUC0-Infinito y
La farmacocinética clínica (Arias, TD: absorción). La Biodisponibilidad Relativa, es la "relación entre dos productos farmacéuti- Cmáx).
Glosario de medicamentos. Desarrollo, eva- la relación entre biodisponibilidades de dos cos que son equivalentes farmacéuticos y b) Análisis de variancia (ANOVA) de
luación y uso. OPS/OMS, Washington, 1999) formas farmacéuticas administradas por vía muestran idéntica biodisponibilidad (tasa y más de una vía, teniendo en cuenta la fuentes
es la "aplicación de los principios farmacoci- extravascular (por ejemplo comprimidos vs. grado de disponibilidad), por lo cual, después de variación sujetos, secuencias, períodos y
néticos al manejo seguro y efectivo de los cápsulas). Estos estudios son llevados a cabo de administrados en la misma dosis molar, tratamientos, ya que el diseño más frecuente-
medicamentos, particularmente en lo rela- por el elaborador original del producto son similares a tal grado que sus efectos serí- mente utilizado es es el de dos secuencias,
cionado a su selección y al diseño de los regí- durante la Fase I de la Farmacología Clínica an esencialmente los mismos. Por lo tanto, si dos períodos, cruzado, balanceado (cada
menes de dosificación". y se realizan con y sin alimentos, con el obje- hay bioequivalencia, dos productos farma- secuencia debe estar compuesta por el mismo
Lo anteriormente expresado puede sinte- to de observar la influencia del alimento en la céuticos deben considerarse equivalentes número de voluntarios). El ANOVA no deci-
tizarse estableciendo que todo medicamento absorción del medicamento. Cabe destacar terapéuticos. Puede establecerse, en síntesis de sobre bioequivalencia, ya que tutea la
atraviesa por tres fases claramente diferen- aquí, que el tipo de alimento utilizado en que la Bioequivalencia es la Biodisponibili- Hipótesis Nula de igualdad de medias.
ciadas (Iannantuono,RF; Tessler,J: Biodispo- estos estudios, posee un alto contenido graso, dad Comparada entre dos productos (Test y c) Análisis de Bioequivalencia: mediante
nibilidad y Bioequivalencia. Rev. Arg. de ya que los lípidos modifican el tránsito gas- Referencia) conteniendo el mismo principio la construcción del Intervalo de Confianza
Farm. Clínica 1994;1,5: 226-243): trointestinal así como la absorción de diver- activo, en la misma cantidad, en la misma 90% de la Razón de Medias: Media T /
1.- Fase farmacéutica: conformada por el sos fármacos. forma farmacéutica (o alternativa farmacéu- Media R (Media de Cmáx y AUC, luego de
pasaje del principio activo desde la forma tica) y administrados por la misma vía. Es la transformación logarítmica natural). Este
farmacéutica al medio donde será absorbido. INDICADORES DE BIODISPONIBILIDAD decir que la Biodisponibilidad explora el ren- Intervalo de Confianza para Cmáx y para
2.- Fase farmacocinética: comprende al dimiento comparativo de dos productos ambas AUC, debe estar entre 0,80 - 1,25.
"Sistema LADME", el cual determina la con- Este fenómeno de la Biodisponibilidad es (relaciona la velocidad y cantidad con que el d) Análisis de Bioequivalencia mediante
centración del principio activo en el sitio de estudiado con diversos indicadores, pero hay principio activo alcanza la circulación la utilización de dos test unilaterales (dos
acción o biofase. tres de ellos que pueden considerarse "datos mayor, proviniendo dicho principio activo de tests de una cola) para rechazar la Hipótesis
3.- Fase farmacodinámica: representada por resumen de biodiponibilidad", ellos son productos Test y Referencia). Los estudios de Nula de Bioinequivalencia, empleando, por
los fenómenos moleculares de relación droga- (Iannantuono y Tessler, 1994): Bioequivalencia deben ser realizados, cuan- ejemplo el Test t de Schuirman.
Potrebbero piacerti anche
- Procesos BiofarmaceuticosDocumento10 pagineProcesos BiofarmaceuticosJhon Cabezas MoranNessuna valutazione finora
- Resumen Tecnología Farmacéutica IDocumento66 pagineResumen Tecnología Farmacéutica IMariangel NavaNessuna valutazione finora
- Nuevos usos para viejos medicamentosDa EverandNuevos usos para viejos medicamentosNessuna valutazione finora
- Cuadro de Los Principales Neurotransmisores y Sus Principales FuncionesDocumento2 pagineCuadro de Los Principales Neurotransmisores y Sus Principales FuncionesHugo Vargas Lazcano100% (8)
- Manual de Reiki MarielDocumento10 pagineManual de Reiki MarielEvangelina Marassi100% (1)
- Innovadores 1Documento5 pagineInnovadores 1Emily SantanaNessuna valutazione finora
- Semana 1 Introduccion A La Biof-Fcocin. BF - FKDocumento30 pagineSemana 1 Introduccion A La Biof-Fcocin. BF - FKricardo100% (1)
- Preformulacion de Medicamentos Katerine Castro CazonDocumento10 paginePreformulacion de Medicamentos Katerine Castro CazonKaterine CastroNessuna valutazione finora
- 22 Pruebas A MedicamentosDocumento45 pagine22 Pruebas A MedicamentosMoniGuzmán100% (1)
- Anexo Técnico de La Resolución No. 2950 de 2019Documento8 pagineAnexo Técnico de La Resolución No. 2950 de 2019Andrey ForeroNessuna valutazione finora
- Reporte No 4 5 Control Calidad de FarmacosDocumento14 pagineReporte No 4 5 Control Calidad de FarmacosRoberto Arias FloresNessuna valutazione finora
- Ejemplos de DisoluciónDocumento12 pagineEjemplos de Disoluciónbyron sanchezNessuna valutazione finora
- Bioequivalencia - OctubreDocumento25 pagineBioequivalencia - OctubreFrancico XavierNessuna valutazione finora
- Farmaco 2Documento10 pagineFarmaco 2Vallita CedeñoNessuna valutazione finora
- Procesos Biofarmaceuticos 2Documento28 pagineProcesos Biofarmaceuticos 2juan carlos cuencaNessuna valutazione finora
- Etapas Del Desarrollo Del MedicamentoDocumento2 pagineEtapas Del Desarrollo Del Medicamentolizbeth calderon acostaNessuna valutazione finora
- Preformulación y Caracterización de Farmacos Páginas DesdeManual de Tecnología Farmacéutica - Maria Del Carmen LozanoDocumento12 paginePreformulación y Caracterización de Farmacos Páginas DesdeManual de Tecnología Farmacéutica - Maria Del Carmen LozanoDaniela HernandezNessuna valutazione finora
- Resumen2 FARMACO PDFDocumento19 pagineResumen2 FARMACO PDFNina VillarroelNessuna valutazione finora
- Resumen: Trabajo Fin de Grado - Medicamentos GenéricosDocumento1 paginaResumen: Trabajo Fin de Grado - Medicamentos GenéricosJuan SanchezNessuna valutazione finora
- Trabajao InvestigacvionDocumento17 pagineTrabajao InvestigacvionMarcos Hurtado CalderonNessuna valutazione finora
- Cronofarmacologia - Bioequivalencia y Biodisponibilidad - Renzo Armas IbarraDocumento2 pagineCronofarmacologia - Bioequivalencia y Biodisponibilidad - Renzo Armas IbarraCynthia JackelyneNessuna valutazione finora
- Farmacología Cuadro DescriptivoDocumento4 pagineFarmacología Cuadro DescriptivoMario SalasNessuna valutazione finora
- Configuración Económica de La Industria FarmacéuticaDocumento11 pagineConfiguración Económica de La Industria FarmacéuticaLuna LauraNessuna valutazione finora
- Algunas Consideraciones: Bioequivalencia, Biodisponibilidad y EFGDocumento4 pagineAlgunas Consideraciones: Bioequivalencia, Biodisponibilidad y EFGDiego Padilla SantosNessuna valutazione finora
- Tema 7 BiodisponibilidadDocumento17 pagineTema 7 BiodisponibilidadCecilia Gladys Cohaila AcevedoNessuna valutazione finora
- Manual CursoDocumento17 pagineManual CursoRafaelina ColonNessuna valutazione finora
- Nuevo MedicamentoDocumento18 pagineNuevo MedicamentoGiancarlos mendoza accostupaNessuna valutazione finora
- Desarrollo de Un FarmacoDocumento2 pagineDesarrollo de Un FarmacoFernanda OntiverosNessuna valutazione finora
- Biofarmacia Resumen PDFDocumento271 pagineBiofarmacia Resumen PDFPedro Miguel RodriguezNessuna valutazione finora
- Biofarmacia 1 PDFDocumento51 pagineBiofarmacia 1 PDFOLGA VEGANessuna valutazione finora
- Art 12Documento13 pagineArt 12yeniNessuna valutazione finora
- BioequivalenciaDocumento5 pagineBioequivalenciaGilmer ChamorroNessuna valutazione finora
- Boletín BioequivalenciaDocumento32 pagineBoletín BioequivalenciaAmaury CespedesNessuna valutazione finora
- Act 1 Far Avz AAFC - MergedDocumento8 pagineAct 1 Far Avz AAFC - MergedNarlly FuentesNessuna valutazione finora
- Fase 1 - Reconocimiento de Conceptos - Ruby BuitragoDocumento7 pagineFase 1 - Reconocimiento de Conceptos - Ruby BuitragolauraNessuna valutazione finora
- Farmacologiatrabajo 1glosario Kiara HernandezDocumento11 pagineFarmacologiatrabajo 1glosario Kiara HernandezjulidulNessuna valutazione finora
- Articulo de CalibracionDocumento15 pagineArticulo de CalibracionAny VillegasNessuna valutazione finora
- Conceptos para Principiantes de La Farmacología.Documento18 pagineConceptos para Principiantes de La Farmacología.Luis Fernando Sierra QuinterNessuna valutazione finora
- Guia para Establecer Las Bases de La Realización de Estudios de Biodisponibilidad y Bioequivalencia de Productos Farmacéuticos de Administración OralDocumento6 pagineGuia para Establecer Las Bases de La Realización de Estudios de Biodisponibilidad y Bioequivalencia de Productos Farmacéuticos de Administración OralGilberto Perez MartinezNessuna valutazione finora
- BIOEQUIVALENCIADocumento7 pagineBIOEQUIVALENCIAWesResNessuna valutazione finora
- Nom-177-Ssa1-2013 TareaDocumento10 pagineNom-177-Ssa1-2013 TareaKarol Hdz.BNessuna valutazione finora
- FASES DEL DESARROLLO DE UN NUEVO MEDICAMENTO Dr. CARLOS BUSTAMANTE ROJASDocumento4 pagineFASES DEL DESARROLLO DE UN NUEVO MEDICAMENTO Dr. CARLOS BUSTAMANTE ROJASMateo OrtizNessuna valutazione finora
- Fase 1 - Reconocimiento de Conceptos - Ruby BuitragoDocumento7 pagineFase 1 - Reconocimiento de Conceptos - Ruby Buitragolaura galeanoNessuna valutazione finora
- Actividad KWLDocumento2 pagineActividad KWLCesar ArroyoNessuna valutazione finora
- FarmacoDocumento13 pagineFarmacoCristian Joel RosadoNessuna valutazione finora
- Bolanmatagosto 2002Documento31 pagineBolanmatagosto 2002Juan Pablo LópezNessuna valutazione finora
- BIOQUIVALENCIADocumento10 pagineBIOQUIVALENCIAIsabel CristinaNessuna valutazione finora
- 1141-Texto Del Artículo-4927-1-10-20200923Documento9 pagine1141-Texto Del Artículo-4927-1-10-20200923Xavier Diego LopezNessuna valutazione finora
- Bioequivalencia: CONCEPTOS - GENERALESDocumento11 pagineBioequivalencia: CONCEPTOS - GENERALESVictor QuinterosNessuna valutazione finora
- Ponce Martel Dayana Nomei .....Documento1 paginaPonce Martel Dayana Nomei .....Karla PonceNessuna valutazione finora
- Storyboard Lluvia de Ideas PresentaciónDocumento8 pagineStoryboard Lluvia de Ideas Presentacióntaniagss33Nessuna valutazione finora
- RegulacionesDocumento50 pagineRegulacionesJohan Paredes LeveauNessuna valutazione finora
- Biofarmacia I. Tema IDocumento7 pagineBiofarmacia I. Tema IXiomara Ortega BetancoNessuna valutazione finora
- Modulo 1 BioequivalenciaDocumento27 pagineModulo 1 BioequivalenciaDEICYNessuna valutazione finora
- Nom 177 Bioeq FinalDocumento41 pagineNom 177 Bioeq FinalDarla SanchezNessuna valutazione finora
- Presentation (T.A 1)Documento26 paginePresentation (T.A 1)Milagros LozanoNessuna valutazione finora
- BioequivalenciaDocumento28 pagineBioequivalenciaDk-AngelNessuna valutazione finora
- FarmacologiaDocumento1 paginaFarmacologiamontserrat.quintero6084Nessuna valutazione finora
- Ilovepdf MergedDocumento114 pagineIlovepdf MergedCarlos RiofrioNessuna valutazione finora
- Biodisponibilidad UltimoDocumento25 pagineBiodisponibilidad UltimoMargot Mendoza SalasNessuna valutazione finora
- 1 Farmacia HospitalariaDocumento74 pagine1 Farmacia HospitalariaJennyCortez67% (3)
- Ciencia regulatoria: Medicamentos bio y su relevancia para la saludDa EverandCiencia regulatoria: Medicamentos bio y su relevancia para la saludNessuna valutazione finora
- FormaldehídoDocumento18 pagineFormaldehídoFranco MauricioNessuna valutazione finora
- Protozoa RiosDocumento39 pagineProtozoa RiosJuan Carlos Cruz SanchezNessuna valutazione finora
- XilenoDocumento4 pagineXilenoCarlos PeredaNessuna valutazione finora
- Formaldehido PDFDocumento3 pagineFormaldehido PDFJuan Carlos Cruz SanchezNessuna valutazione finora
- Spot TestDocumento2 pagineSpot TestJuan Carlos Cruz SanchezNessuna valutazione finora
- Practicas ParasitologiaDocumento79 paginePracticas ParasitologiainvestigaparasitolNessuna valutazione finora
- Sistemas Abo y RHDocumento35 pagineSistemas Abo y RHJuan Carlos Cruz SanchezNessuna valutazione finora
- Ley General de Salud 2010 NAL/ MéxicoDocumento183 pagineLey General de Salud 2010 NAL/ MéxicoJc LozNessuna valutazione finora
- Toxoplasmosis PDFDocumento15 pagineToxoplasmosis PDFaselle kellyNessuna valutazione finora
- Guia para Elaborar Manuales de Procedimientos, Secretaria de SaludDocumento55 pagineGuia para Elaborar Manuales de Procedimientos, Secretaria de Saludjcarreto100% (35)
- Formula Blanca y RojaDocumento7 pagineFormula Blanca y RojaDanniel Van Persie100% (2)
- BIOQUIMICASDocumento6 pagineBIOQUIMICASJuan Carlos Cruz SanchezNessuna valutazione finora
- HEMATOLOGIADocumento76 pagineHEMATOLOGIAMoon Sanchez FuentesNessuna valutazione finora
- FarmacocineticaDocumento12 pagineFarmacocineticaaxeldazaNessuna valutazione finora
- La Felicidad y La IraDocumento10 pagineLa Felicidad y La IraSergio CoronaNessuna valutazione finora
- Aminoácidos Esenciales (Tríptico) by AyayDocumento2 pagineAminoácidos Esenciales (Tríptico) by Ayayjheyson ayayNessuna valutazione finora
- Manguito Rotador ExpoDocumento32 pagineManguito Rotador Exposandra Mendoza100% (1)
- Banco de Preguntas Salud PublicaDocumento4 pagineBanco de Preguntas Salud PublicaUanderson Silva100% (1)
- Alteraciones MenstrualesDocumento16 pagineAlteraciones MenstrualesFLOR2209Nessuna valutazione finora
- HipoglusemiaDocumento82 pagineHipoglusemiaNGilberto SanchezNessuna valutazione finora
- El DueloDocumento6 pagineEl DueloJennifer VasquezNessuna valutazione finora
- Anestesia Fuera de La Sala de OperacionesDocumento10 pagineAnestesia Fuera de La Sala de OperacionesyorkitaNessuna valutazione finora
- Charla Pacientes Dolor - Laura RicaurteDocumento25 pagineCharla Pacientes Dolor - Laura RicaurteLaura Ricaurte GraciaNessuna valutazione finora
- Glosario Medios de ContrasteDocumento5 pagineGlosario Medios de ContrasteMARIANessuna valutazione finora
- AINESDocumento54 pagineAINESDangelo Querebalu UcedaNessuna valutazione finora
- Cura Con Terapia GersonDocumento5 pagineCura Con Terapia GersondanieladiplomadoNessuna valutazione finora
- Cancer D EprostataDocumento32 pagineCancer D EprostataxxlaxinesexxNessuna valutazione finora
- Jhoana Salud Del Adulto Rosa Examen de RutinaDocumento30 pagineJhoana Salud Del Adulto Rosa Examen de RutinahucalealNessuna valutazione finora
- Glosario2 de PatologiaDocumento17 pagineGlosario2 de PatologiaOtakuro Jun Sani Ranma100% (1)
- Mente y Cerebro PDFDocumento100 pagineMente y Cerebro PDFJose Morales67% (3)
- La Importancia Del Diagnóstico en PsicologíaDocumento6 pagineLa Importancia Del Diagnóstico en Psicologíasarai7rosales100% (2)
- Trabajo Apa Histo TodoDocumento23 pagineTrabajo Apa Histo TodoGabriela PerezNessuna valutazione finora
- Camu FichDocumento12 pagineCamu FichFattima Pingo PericheNessuna valutazione finora
- Enarm - Capitulo Muestra NeumoDocumento72 pagineEnarm - Capitulo Muestra NeumoDaniel Stich Mrtz100% (3)
- OLANZAPINA ResumenDocumento7 pagineOLANZAPINA ResumenalbiannyNessuna valutazione finora
- Resumen Semana 2 DiplomadoDocumento6 pagineResumen Semana 2 DiplomadoMONICA SALAZARNessuna valutazione finora
- TEMA 4 Diferencias Entre Los Aprendices y Necesidades de AprendizajeDocumento10 pagineTEMA 4 Diferencias Entre Los Aprendices y Necesidades de AprendizajeAnibal Urena RosarioNessuna valutazione finora
- Aloe BetaDocumento1 paginaAloe BetaFelipe De La VegaNessuna valutazione finora
- Rossi, Antonella y Rubiolo, Valentina (2011) - Sindrome de Peter Pan, Trastorno Narcisista de Una EpocaDocumento4 pagineRossi, Antonella y Rubiolo, Valentina (2011) - Sindrome de Peter Pan, Trastorno Narcisista de Una Epocaflaviis100% (1)
- Revista Psicopatologia 29 PDFDocumento122 pagineRevista Psicopatologia 29 PDFpepe pepeNessuna valutazione finora
- Biografía Sigmund FreudDocumento8 pagineBiografía Sigmund FreudOT B-angelNessuna valutazione finora
- Bactericidas y BacteriostáticosDocumento3 pagineBactericidas y Bacteriostáticosjoc3lyn_n100% (3)