Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Síntesis de Ciclohexeno
Caricato da
Lilibeth CadenaCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Síntesis de Ciclohexeno
Caricato da
Lilibeth CadenaCopyright:
Formati disponibili
SNTESIS DE CICLOHEXENO
Lilibeth Cadena 20131150105
Sptimo semestre
lcadenay@correo.udistrital.edu.co
Universidad Distrital Francisco Jos de Caldas
Marzo 28 de 2016
RESUMEN
En esta prctica experimental fue sintetizado ciclohexeno por medio de la deshidratacin de Ciclohexanol
obteniendo un porcentaje de reaccin del 35, 607 % (debido a que la reaccin pas de derecha a izquierda para
lograr el equilibrio) y en donde nuestro producto tubo un punto de fusin de 79 C (el cul es un punto de ebullicin
aceptable); todo esto reafirma la importancia de desecar las reacciones fundamentadas en el mecanismo E1 para
obtener un rendimiento de reaccin ptimo para evitar sobrecostos en estas prcticas.
Palabras clave: Deshidratacin, eliminacin unimolecular (E1), reaccin de primer orden, ciclohexanol,
ciclohexeno.
ABSTRACT
In this experimental practice it was synthesized cyclohexene by dehydration of cyclohexanol to obtain a reaction
rate of 35, 607% (due to the reaction went from right to left to achieve balance) and where our product tube melting
point 79 C (which is an acceptable boiling point); this reaffirms the importance of the reactions desiccate founded
in the E1 mechanism for optimal performance reaction to avoid overruns in these practices.
Keywords: Dehydration, unimolecular elimination (E1), first-order reaction, cyclohexanol, cyclohexane.
1. INTRODUCCIN
La deshidratacin de alcoholes es un procedimiento
en el cual el Hidrogeno y el grupo Hidroxilo se
separan de dos carbonos adyacentes con la ayuda de
un cido como catalizador dando como producto la
formacin de alquenos. Este tipo de reaccin se
explica mediante el mecanismo de eliminacin
unimolecular (E1), en el cual oxgeno del grupo OH
al ser protonado por el cido rompe su enlace con el
carbono generando un carbocatin el cual al tener
propiedades de un cido de Brnsted transfiere su
hidrgeno a la base de Brnsted (el agua) y as se
genera la produccin de un alqueno.
Este tipo de reaccin tiene una cintica de primer
orden, debido a que la reaccin depende en mayor
parte a la formacin de carbocatin y como todas las
reacciones de los alcoholes es orden de la reactividad
del alcohol es 3<2<1 [1].
2. METODOLOGA
En un baln de reaccin de dos bocas se coloc la
barra magntica y 10 mL de ciclohexanol; con la
ayuda de un embudo de decantacin se le adicion
gota a gota y agitando magnticamente 0,5 mL de
cido sulfrico concentrado. Se comenz a calentar
la muestra controlando la temperatura y destilndola
para colectar la fraccin obtenida entre 80-85C; el
matraz colector se enfri con un bao de hielo. [2]
El destilado obtenido fue saturado con 1 g de
Cloruro de Sodio para formar dos fases las cuales
fueron separadas con la ayuda de un embudo de
decantacin y la fase inferior (la cual estaba saturada
por el cloruro de sodio) fue desechada
El producto qued en el embudo de separacin fue
lavado 3 veces con una solucin de bicarbonato de
sodio al 5%, utilizando en cada lavado 5 mL de la
solucin.
La fase orgnica fue colocada en un vaso de
precipitados de 50 mL para ser secada con sulfato de
sodio anhidro. La solucin se trasfiri a una probeta
de 10 mL para poder medir el volumen de
ciclohexeno producido. A la muestra obtenida se le
midi el punto de ebullicin y se le determin el
espectro IR. [2]
3. RESULTADOS
RESULTADOS
ANLISIS
DE
Resultados
Figura 2: Ciclohexeno obtenido en el procedimiento
experimental
Figura N1: Montaje realizado en la prctica
experimental
Se logr obtener 3,9 mL de ciclohexeno el cual es de
un olor fuerte caracterstico; este obtuvo un punto de
ebullicin de 78C y su espectro IR se presenta a
continuacin:
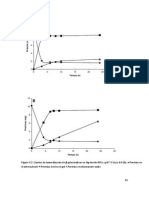
Grfica N1 Espectro IR resultado del ciclohexeno obtenido experimentalmente
Tabla N 1: Bandas caractersticas del espectro
obtenido en el anlisis IR de la muestra de
ciclohexeno sintetizada experimentalmente
El mecanismo de reaccin que mejor explica esta
sntesis es el mecanismo de eliminacin
unimolecular (E2), El cual es producido en tres
etapas:
Etapa1: Protonacin del grupo hidroxilo
Figura 4: Etapa 1 del mecanismo de reaccin E1
para la formacin del ciclohexeno [2]
Clculos:
10
mL
611
0,96 611
1 611
1 611
1 610
100.2 611 1 611
92,6 610
1 610
0,81 610 =
1 610
se esperaba la
En este paso el cido sulfrico se disuelve en el
alcohol (el sustrato) y el hidrogenin desprendido se
enlaza al oxigeno del alcohol protonndolo [1].
Etapa 2: Formacin del carbocatin
Figura 5: Etapa 2 del mecanismo de reaccin E1
para la formacin del ciclohexeno [2]
produccin de 10, 953 ml de 610
3,9
*
10,953
100%= 35, 607 %. Es el rendimiento de la
reaccin.
0,5
98% 5%= se necesitaron 9,5 mL de Bicarbonato de
sodio para neutralizar el cido usado
Anlisis de resultados
Mecanismo de reaccin
La reaccin global es:
Figura 3: reaccin global para la formacin del
ciclohexeno [2].
Se produce un carbocatin debido a la ruptura del
enlace de oxgeno con el carbono alfa y agua lo cual
produce la eliminacin del grupo hidroxilo. La
produccin del carbocatin es la que determina la
velocidad de la sntesis del ciclohexeno, es decir, la
reaccin es de primer orden [1].
Etapa 3: Abstraccin del protn (paso
rpido)
Figura 6: Etapa 3 del mecanismo de reaccin E1
para la formacin del ciclohexeno [2]
En esta etapa el carbocatin formado tiene
propiedades de cido de Brnsted lo cual produce
que el carbono beta rompa su enlace con el hidrgeno
el cual se enlaza al oxgeno protonndolo
nuevamente y produciendo el ciclohexeno (el
producto esperado), es en este momento en el que el
agua protonada reacciona con el ion sulfuro para
producir nuevamente agua y cido sulfrico [1].
La adiccin de los dems reactivos es para neutralizar
el cido en exceso y para deshidratar el agua
producida [3].
Rendimiento de reaccin
Esta sntesis tuvo un rendimiento del 35, 607 % el
cual es muy bajo y se puede explicar de acuerdo al
principio de Le Chtelier, ya que al no eliminarse el
agua producida de forma inmediata, esta evitaba que
la reaccin se produjera haca la derecha y al ser una
reaccin cido base, esta se devolva buscando el
equilibrio lo cual terminaba en la prdida del
ciclohexeno producido. [4]
Punto de ebullicin
El punto de ebullicin (79C) no fue exacto al punto
de ebullicin terico (83C) debido a la presin
atmosfrica la cual al disminuir en Bogot hizo que
el punto de fusin disminuyera [5]. Debido a que el
punto de ebullicin experimental no es muy diferente
al punto de ebullicin terico se puede deducir que
se sintetiz ciclohexeno, este es un buen parmetro
de pureza.
Espectro IR
El espectro que lo logr a partir de la muestra
sintetizada tiene bandas caractersticas ubicadas en
3022.45 cm-1 (Tensin asimtrica del =CH2), 2931.8
cm-1 (Tensin simtrica del CH2), 2858 cm-1(Tensin
asimtrica del CH2), 1438.9 cm-1 (Balanceo de
cizalla acoplado del C=C), 1136.07 cm-1 (muestra del
grupo =C-H), 717.52 cm-1 (Rocking caracterstico de
ms de 4 enlaces de CH2), 640.37 cm-1; todas estas
bandas son caracterstica de un alqueno cclico
debido a la ausencia de bandas caractersticas de
grupos CH3. Este espectro es una excelente muestra
de que el compuesto sintetizado es el ciclohexeno
4. CONCLUSIONES
El mecanismo de reaccin E1 es el que mejor explica
la sntesis del ciclohexeno. Esta sntesis tuvo un mal
rendimiento de reaccin (35, 607 %) debido a que la
reaccin se devolvi para mantener el equilibrio de
esta concluyendo la importancia de desecar los
procesos de sntesis fundamentados en el mecanismo
E1 lo ms pronto posible para poder obtener un
rendimiento de reaccin ptimo para estas prcticas
y evitar sobrecostos.
5. BIBLIOGRAFA
[1] Francis. A. Carey, Qumica Orgnica, Ed. Mc
Graw Hill, Mxico, 2006, pgs. 156 162
[2] Tomado y adaptado de: CRUZ, F., LOPEZ, I.,
HARO, J., BARBA, J. Manual de prcticas de
laboratorio de qumica orgnica. Universidad
Autnoma Metropolitana y Universidad Iztapalapa.
Divisin de ciencias biolgicas y de la salud. Mxico,
2012.
Disponible
en:
[http://www.izt.uam.mx/ceu/publicaciones/MQO1/
MANUAL_QUIMICA_ORGANICA_1.pdf].
[3] Pea, Luis E. Qumica inorgnica, primera
edicin, Ed. Universidad Distrital Francisco Jos de
Caldas, coleccin tierra y vida, Bogot D.C. 2013.
[4] Chang. Raymond, Qumica General, Ed. Mc
Graw Hill, Mxico, 2010.
[5] Cengel, Yunes A. Termodinmica, sptima
edicin, Ed. Mc Graw Hill, Mxico, 2012.
[6] Caldern G. Carlos E; Manual para la
interpretacin de espectros infrarrojos. Universidad
Nacional de Colombia, Editorial Guadalupe LTDA.
Bogot- Colombia. 1985.
Potrebbero piacerti anche
- Practica 7Documento5 paginePractica 7González Chávez MarianaNessuna valutazione finora
- Síntesis del ácido 5-nitrosalicílico a partir del ácido salicílicoDocumento10 pagineSíntesis del ácido 5-nitrosalicílico a partir del ácido salicílicoKmilo OspinaNessuna valutazione finora
- Obtencion de DIBENZALACETONADocumento10 pagineObtencion de DIBENZALACETONAHeimer Mestra ArgumedoNessuna valutazione finora
- Práctica 8-Síntesis de CiclohexenoDocumento5 paginePráctica 8-Síntesis de CiclohexenoAndy Aldama100% (1)
- ClaisenDocumento4 pagineClaisenSuarez GOmez Alexis Gabriel100% (1)
- Sintesis de Bromuro de ButiloDocumento5 pagineSintesis de Bromuro de ButiloBryan PerezNessuna valutazione finora
- Reactividad de Aldehidos y CetonasDocumento24 pagineReactividad de Aldehidos y CetonasLiliana Yaneth MenaNessuna valutazione finora
- Reacciones de Friedel CraftsDocumento13 pagineReacciones de Friedel CraftsLorenz SamanezNessuna valutazione finora
- Condensacion Aldolica Aldehidos y CetonasDocumento4 pagineCondensacion Aldolica Aldehidos y CetonasLuis MoralesNessuna valutazione finora
- Informe 4 Organica IIDocumento3 pagineInforme 4 Organica IIDelfi Cristina Espinosa FuentesNessuna valutazione finora
- Informe de Síntesis Del ButanalDocumento11 pagineInforme de Síntesis Del ButanalIsabella MartinezNessuna valutazione finora
- QM 344 Informe 4Documento4 pagineQM 344 Informe 4Roger RamosNessuna valutazione finora
- Taller Gravimetría, Química AnaliticaDocumento17 pagineTaller Gravimetría, Química AnaliticaXiomara SanchezNessuna valutazione finora
- Práctica #11. Hidrólisis de La Nitro-Acetanilida FinalDocumento9 paginePráctica #11. Hidrólisis de La Nitro-Acetanilida FinalGetsa ContrerasNessuna valutazione finora
- Informe 6 Solubilidad Del Ácido Benzoico en Agua 1Documento3 pagineInforme 6 Solubilidad Del Ácido Benzoico en Agua 1Angelly Ortega100% (2)
- Practica 2 Nitracion Del Benzoato de MetiloDocumento7 paginePractica 2 Nitracion Del Benzoato de MetiloAndres TaveraNessuna valutazione finora
- Reporte 5 - Preparacion de Acido Salicilico y Sintesis de La Aspirina!Documento22 pagineReporte 5 - Preparacion de Acido Salicilico y Sintesis de La Aspirina!Ligia FletesNessuna valutazione finora
- Propiedades de Los CarbohidratosDocumento14 paginePropiedades de Los CarbohidratosLeandro PotosyNessuna valutazione finora
- Acetilación anilina bromación acetanilidaDocumento7 pagineAcetilación anilina bromación acetanilidaHerman Ruiz Calderin100% (1)
- Reporte TermoquimicaDocumento8 pagineReporte TermoquimicaDiianaLauraMelendezNessuna valutazione finora
- Bombeo de Protones en Levaduras y Sus Procesos InhibitoriosDocumento9 pagineBombeo de Protones en Levaduras y Sus Procesos InhibitoriosLina VidalNessuna valutazione finora
- Sintesis de Butanal y BenzalacetonaDocumento8 pagineSintesis de Butanal y BenzalacetonaSamuel Fernando DelgadoNessuna valutazione finora
- Manual de Organica III.2013Documento16 pagineManual de Organica III.2013Karinaa AndreaaNessuna valutazione finora
- Práctica de laboratorio sobre estereoisomería cis-trans del ácido maleico y fumáricoDocumento3 paginePráctica de laboratorio sobre estereoisomería cis-trans del ácido maleico y fumáricoRamiro AmariNessuna valutazione finora
- Nitración Del Ácido SalicílicoDocumento4 pagineNitración Del Ácido SalicílicoNitgma DcNessuna valutazione finora
- Determinación de la tensión superficial por el método ascendenteDocumento8 pagineDeterminación de la tensión superficial por el método ascendenteRamon GarciaNessuna valutazione finora
- Practica 9 Sintesis de para NitroanilinaDocumento2 paginePractica 9 Sintesis de para NitroanilinaLeonardo Jain Toral0% (2)
- Ácido Cinámico FINALDocumento8 pagineÁcido Cinámico FINALAndres Felipe Vargas GaviriaNessuna valutazione finora
- Práctica 10 y 11 DETERMINACIÓN DE LA ACTIVIDAD (SDH) Y CITOCROMAS - Amador y AbrizDocumento8 paginePráctica 10 y 11 DETERMINACIÓN DE LA ACTIVIDAD (SDH) Y CITOCROMAS - Amador y AbrizIridian ArNessuna valutazione finora
- Ácidos Carboxilicos InformeDocumento5 pagineÁcidos Carboxilicos InformeCesar Alfonso Rodriguez Maestre0% (1)
- BENZOATODocumento16 pagineBENZOATOLuis BlNessuna valutazione finora
- Síntesis de dibenzalacetonaDocumento6 pagineSíntesis de dibenzalacetonaAna FloresNessuna valutazione finora
- Síntesis SN1 cloruro terbutiloDocumento5 pagineSíntesis SN1 cloruro terbutilojuliana alvarezNessuna valutazione finora
- ImformeDocumento5 pagineImformeAnonymous MVMOeliIRzNessuna valutazione finora
- Nitracion Acido SalicilicoDocumento8 pagineNitracion Acido SalicilicoAndresArevaloCortesNessuna valutazione finora
- Caracterización Fisicoquímica de Un Compuesto OrgánicoDocumento9 pagineCaracterización Fisicoquímica de Un Compuesto OrgánicoSara LeonNessuna valutazione finora
- Alcaloides-propiedades-extracción-identificaciónDocumento8 pagineAlcaloides-propiedades-extracción-identificaciónJorge Luis Chambi LauraNessuna valutazione finora
- Difusion en LiquidosDocumento4 pagineDifusion en LiquidosYAneth100% (1)
- Práctica de BaquelitaDocumento11 paginePráctica de BaquelitaJCKARL100% (1)
- Informe de HidrocarburosDocumento18 pagineInforme de HidrocarburosMiguel Serrano100% (1)
- Reporte CafeínaDocumento8 pagineReporte CafeínaIbran Gutierrez LanderosNessuna valutazione finora
- Preparación y análisis del complejo de pentaaminclorocobaltoDocumento4 paginePreparación y análisis del complejo de pentaaminclorocobaltoDaniel Arturo Caballero SanchezNessuna valutazione finora
- Sintesis CiclohexenoDocumento13 pagineSintesis CiclohexenoValentina Salazar LópezNessuna valutazione finora
- Condensación de Aldehídos y CetonasDocumento8 pagineCondensación de Aldehídos y CetonasAndres Julian Huerfano ChaparroNessuna valutazione finora
- IntroducciónDocumento25 pagineIntroducciónAlicia CastilloNessuna valutazione finora
- Keto Rola CoDocumento14 pagineKeto Rola CoKoKo Torres Andrade100% (1)
- Práctica 8. Extracción Con Disolventes Orgánicos y Activos.Documento5 paginePráctica 8. Extracción Con Disolventes Orgánicos y Activos.Xuxek MartinezNessuna valutazione finora
- MetiltrifenilestañoDocumento9 pagineMetiltrifenilestañooscarNessuna valutazione finora
- Cinetica LactasaDocumento122 pagineCinetica LactasaalvarezriNessuna valutazione finora
- Practica No 4 Obtención de Ácido FenoxiacéticoDocumento18 paginePractica No 4 Obtención de Ácido FenoxiacéticogisvanessaNessuna valutazione finora
- Practica 1. Reaccion de Aminoacidos y ProteinasDocumento2 paginePractica 1. Reaccion de Aminoacidos y ProteinasPierdant O-oNessuna valutazione finora
- Síntesis de Colorantes Organicos: Fenolftaleína, Anaranjado de MetiloDocumento16 pagineSíntesis de Colorantes Organicos: Fenolftaleína, Anaranjado de MetiloCarlos Ruben Suarez GavidiaNessuna valutazione finora
- Síntesis de P-AminoacetanilidaDocumento3 pagineSíntesis de P-AminoacetanilidaaaNessuna valutazione finora
- Investigación Previa Practica No.3Documento12 pagineInvestigación Previa Practica No.3Alvarado Fernández Juan CarlosNessuna valutazione finora
- Reporte 6f SubirDocumento17 pagineReporte 6f SubirFarah CatúNessuna valutazione finora
- HDT Cinetica e Inhibicion Enzimatica ResolucionDocumento3 pagineHDT Cinetica e Inhibicion Enzimatica ResolucionPao RosalesNessuna valutazione finora
- Propiedades y Reacciones de Los Aldehidos y CetonasDocumento10 paginePropiedades y Reacciones de Los Aldehidos y CetonasabdielNessuna valutazione finora
- Práctica No. 4 Extracción de Fosfatasa Alcalina, Efecto de PH, Temperatura, Velocidad de Reacción-Actividad de SustratoDocumento7 paginePráctica No. 4 Extracción de Fosfatasa Alcalina, Efecto de PH, Temperatura, Velocidad de Reacción-Actividad de SustratoLyseth GómezNessuna valutazione finora
- Identificación de bases purínicas y pirimídicas de DNA y RNA mediante cromatografía en capa finaDocumento3 pagineIdentificación de bases purínicas y pirimídicas de DNA y RNA mediante cromatografía en capa finafernando tvNessuna valutazione finora
- Síntesis Del Ciclohexeno A Partir de La Deshidratación Del Ciclohexanol: Una Típica Reacción de Eliminación E1Documento4 pagineSíntesis Del Ciclohexeno A Partir de La Deshidratación Del Ciclohexanol: Una Típica Reacción de Eliminación E1Melanny Sofia CorredorNessuna valutazione finora
- Alcoholes, Fenoles y ÉteresDocumento34 pagineAlcoholes, Fenoles y ÉteresYsleidid CoronaNessuna valutazione finora
- Quiz de Balance de Materia Con Reacción QuímicaDocumento1 paginaQuiz de Balance de Materia Con Reacción Químicaosneider jose peña cuetoNessuna valutazione finora
- Solución Práctica Derivados HidrocarburosDocumento48 pagineSolución Práctica Derivados HidrocarburoshecfermeNessuna valutazione finora
- Declaracionde Agentesde RiesgoDocumento5 pagineDeclaracionde Agentesde RiesgoJuan Pablo Dalla ViaNessuna valutazione finora
- Sintesis de EsteresDocumento16 pagineSintesis de EsteresBrian Pacheco100% (1)
- Análisis funcional orgánicoDocumento10 pagineAnálisis funcional orgánicoMARIA ELDA PAZ TOLEDONessuna valutazione finora
- ALCANOSDocumento6 pagineALCANOSJose Wilson Cuesta CordobaNessuna valutazione finora
- Rutas Metabolicas Glucolisis Gluconeogenesis Fosforilacion OxidativaDocumento5 pagineRutas Metabolicas Glucolisis Gluconeogenesis Fosforilacion OxidativaYili yiliNessuna valutazione finora
- Alcoholes y FenolesDocumento27 pagineAlcoholes y FenolesPauSaracheNessuna valutazione finora
- Ácidos CarboxílicosDocumento7 pagineÁcidos Carboxílicosantonio floresNessuna valutazione finora
- Tema 5 2018 PDFDocumento72 pagineTema 5 2018 PDFLeandro PelletànNessuna valutazione finora
- Sintesis de Acetato de EtiloDocumento6 pagineSintesis de Acetato de EtiloMaria J AncoNessuna valutazione finora
- Química Orgánica 2005 - UNAD PDFDocumento266 pagineQuímica Orgánica 2005 - UNAD PDFAndrés Cárdenas NovoaNessuna valutazione finora
- TFM G313Documento56 pagineTFM G313Giovanni CoronaNessuna valutazione finora
- Quimica-2º-Bachillerato - Resumen Grupos Funcionales PDFDocumento1 paginaQuimica-2º-Bachillerato - Resumen Grupos Funcionales PDFFrancisca RojasNessuna valutazione finora
- BiomoléculasDocumento12 pagineBiomoléculasHeriberto Suarez FajardoNessuna valutazione finora
- Informacion Del Bloque de Quimica OrganicaDocumento30 pagineInformacion Del Bloque de Quimica OrganicaDiego Hernandez Maciel100% (1)
- Guia de Quimica Undecimo # 2Documento4 pagineGuia de Quimica Undecimo # 2VICTOR PEÑANessuna valutazione finora
- Guía 2Documento6 pagineGuía 2Anita HernandezNessuna valutazione finora
- 7b - Metabolismo de L°pidosDocumento25 pagine7b - Metabolismo de L°pidosMauricio GarciaNessuna valutazione finora
- Por Qué El Carbono Es Tan Importante en Las Moléculas BiológicasDocumento3 paginePor Qué El Carbono Es Tan Importante en Las Moléculas BiológicasAlisonAle50% (2)
- Practicas QHeterociclicaDocumento27 paginePracticas QHeterociclicapanick001Nessuna valutazione finora
- La Química y Sus AplicacionesDocumento2 pagineLa Química y Sus AplicacionesmartinNessuna valutazione finora
- Desarrollo de la Química OrgánicaDocumento5 pagineDesarrollo de la Química Orgánicamarcela ortizNessuna valutazione finora
- Informe 7 Algunas Pruebas de Acidos Carboxilicos y Sus Derivados - CompressDocumento17 pagineInforme 7 Algunas Pruebas de Acidos Carboxilicos y Sus Derivados - CompressKaroll DominguezNessuna valutazione finora
- Informe de AlquinosDocumento3 pagineInforme de AlquinosJavier Mercado Diaz75% (4)
- Inbound 357859809Documento4 pagineInbound 357859809Mer BarNessuna valutazione finora
- EtilinacionDocumento4 pagineEtilinacionLeidy TarquiNessuna valutazione finora
- Informe 8 QuimicaDocumento14 pagineInforme 8 QuimicasramoscamarenaNessuna valutazione finora
- Apuntes Q IIDocumento79 pagineApuntes Q IIIsidro Gonzalez ParraNessuna valutazione finora