Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Coeficiente de Difusion Lista
Caricato da
Arturo Collazos0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
60 visualizzazioni10 paginedifusion de gases
Copyright
© © All Rights Reserved
Formati disponibili
PDF, TXT o leggi online da Scribd
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentodifusion de gases
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
0 valutazioniIl 0% ha trovato utile questo documento (0 voti)
60 visualizzazioni10 pagineCoeficiente de Difusion Lista
Caricato da
Arturo Collazosdifusion de gases
Copyright:
© All Rights Reserved
Formati disponibili
Scarica in formato PDF, TXT o leggi online su Scribd
Sei sulla pagina 1di 10
Prctica 2: DETERMINACIN EXPERIMENTAL DE COEFICIENTES DE DIFUSIN
MOLECULAR EN FASE GASEOSA
Objetivos y fundamentos tericos
Con esta prctica se pretende conocer y desarrollar el concepto de difusin molecular de un lquido en
un gas. La difusin molecular es el viaje de uno o ms componentes a travs de otros ocasionados por
una diferencia de concentraciones o de potencial qumico cuando se ponen en contacto dos fases
inmiscibles, que se encuentran estancadas o en rgimen laminar.
Cuando un sistema contiene dos o ms componentes cuyas concentraciones varan de punto a punto,
hay una gran tendencia a la transferencia de masa, minimizando las diferencias de concentracin en el
sistema. El transporte de un constituyente, de una regin de alta concentracin a una de concentracin
baja, se denomina transferencia de masa.
El mecanismo de transferencia de masa, as como el de transferencia de calor, dependen del sistema
dinmico en que tiene lugar. La masa se puede transferir por movimiento molecular en fluidos en
reposo, o bien puede transferirse desde una superficie contenida en el seno de fluido que se mueve,
ayudada por las caractersticas dinmicas de flujo, esto es el movimiento forzado de grandes grupos de
molculas.
La rapidez con la cual se transfiere un componente en una mezcla depender del gradiente de
concentracin existente en un punto y en una direccin dados. Su movimiento est relacionado por
medio de la Primera Ley de Fick para un sistema isobrico e isotrmico.
NA = yA (NA + NB) c
yA
1 Ley de Fick de la difusin para un sistema binario en fase gas
Breve explicacin del desarrollo de la prctica.
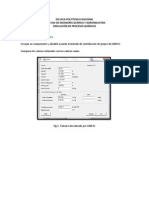
Para el desarrollo se dispone de un dispositivo experimental que consta de:
un catetmetro
un bao de agua que se encarga de mantener constante la temperatura de la celda.
un compartimento que contiene la soplante de aire y los controles elctricos del equipo.
El bao de agua se calienta por medio de una resistencia elctrica que permitir mantener la
temperatura deseada as como cambiarla cuando fuere necesario.
En este bao se introduce la celda de difusin, un tubo en forma de T, procurando que no contenga
agua en su interior. La celda contiene el lquido de difundir en el aire. Este lquido, en primer lugar
acetona y en segundo lugar metanol, debe introducirse en la celda con una jeringa.
Una vez colocada la celda en el bao se conecta un tubo procedente del serpentn a uno de los extremos
de la celda, y un trozo de goma largo al otro extremo. Se aade agua hasta que la celda quede
totalmente sumergida.
1
Cuando el lquido se pone en contacto con el aire la cantidad de lquido en la celda va disminuyendo a
medida que transcurre el tiempo como consecuencia de su difusin en el lquido. Esta disminucin del
nivel del lquido se observa con el catetmetro.
El proceso descrito se repetir para la acetona a 50 C y luego con una celda distinta e inicialmente seca
se introduce el metanol y se lleva a cabo a 50C.
Despus de introducir el lquido en la celda, se conecta la soplante de aire y se realizan medidas cada 15
minutos anotando el descenso del nivel que va alcanzando lquido en la celda. Transcurrida una hora y
media, se repite el proceso introduciendo metanol en la celda, midiendo de nuevo cada 15 minutos y
durante otra hora y media.
Resultados experimentales y desarrollo pormenorizado de los clculos realizados y de su
justificacin.
SISTEMA ACETONAAIRE A 50C
Para la determinacin del sistema metanolaire se necesita disponer de los siguientes datos, siendo A =
Acetona:
Presin total (PT) = 741 mmHg
Temperatura (T) = 323K = 50 C
Presin de vapor de A a 50 C (p
) = 610.35 mmHg
Masa molecular (MA) = 58.08 g/mol
Densidad de A (A) = 0.753 g/cm3
Constante de los gases (R) =62320 cm3mm/Kmol
Clculo de la constante k:
Se obtiene sustituyendo en la ecuacin:
Con lo que se tiene un valor de k segn los datos arriba facilitados:
k =
Determinacin del coeficiente de difusin DAB
Datos obtenidos para el sistema acetonaaire a 50C.
2
x = 5.67cm.
H0 (cm) Hi (cm) h0 (cm) hi (cm) ti (s) ti/hi (scm1)
0.30 5.97 11.94 0 0
0.40 0.10 900 9000
0.51 0.21 1800 8571.43
0.63 0.33 2700 8181.82
0.74 0.44 3600 8181.82
0.84 0.54 4500 8333.33
0.95 0.65 5400 8307.69
Finalmente:
SISTEMA METANOLAIRE A 50C
Para la determinacin del sistema metanolaire se necesita disponer de los siguientes datos, siendo A =
Metanol:
Presin total (PT) = 741 mmHg
Temperatura (T) = 323K = 50 C
Presin de vapor de A a 50 C (p
) = 417.02 mmHg
Masa molecular (MA) = 32.042 g/mol
Densidad de A (A) = 0.760 g/cm3
Constante de los gases (R) =62320 cm3mm/Kmol
Clculo de la constante k:
Si se sustituye en la ecuacin anteriormente facilitada y con los datos del cuadro se obtiene:
k =
Determinacin del coeficiente de difusin DAB
Datos obtenidos para el sistema metanolaire a 50C.
x = 5.52cm.
H0 (cm) Hi (cm) h0 (cm) hi (cm) ti (s) ti/hi (scm1)
3
0.00 5.52 11.04 0 0
0.05 0.05 900 18000
0.19 0.19 1800 9473.68
0.20 0.20 2700 13500
0.25 0.25 3600 14400
0.30 0.30 4500 15000
0.34 0.34 5400 15882.35
Finalmente:
Conclusiones
Balances de cantidad de movimiento y de materia necesarios para deducir, a partir de la 1 ley de Fick, la
ecuacin empleada
El calculo de NAZ, numero de moles que difunden por unidad de rea de interfase y tiempo vendr
dado por la ley de Fick, que para un sistema unidireccional es:
Una vez alcanzado el rgimen estacionario, el desplazamiento del componente B en el sentido
contrario al de difusin es nulo, es decir:
Y la densidad de flujo de la especie A ser:
Que integrada para las condiciones lmites
Condicin limite 1:
Condicin lmite 2:
=
Se obtiene
Expresin que en funcin de las presiones parciales suponiendo un comportamiento ideal para las
4
mezclas gasvapor:
En el proceso evoluciona en rgimen pseudoestacionario, de forma que
Teniendo en cuenta que segn el modelo descrito, el nmero de moles que se evapora por unidad de
tiempo y superficie en la interfase viene dado por:
Teniendo en cuenta la ecuacin en funcin de presiones parciales se obtiene:
(1)
Siendo
la densidad de A en fase lquida a la temperatura de operacin y
la masa molecular de A. dh/dt es la velocidad de descenso de nivel de A. De acuerdo con el modelo indicado
anteriormente la composicin de la especie A en la zona superior del tubo se puede considerar nula debido a
un defecto de barrido del gas inerte, mientras que en la interfase corresponde al valor de equilibrio, es decir,
su presin de vapor a la temperatura de operacin:
Sustituyendo el valor de NAZ en la expresin anterior tendremos la forma diferencial de la ecuacin:
Expresin que integrada entre los lmites adecuados:
5
(2)
Como h0 es la distancia inicial para un tiempo t = 0 entre la interfase y la boca de la columna y hi es el
descenso de la interfase que corresponde a un tiempo t=t1 se tiene:
Integrando de nuevo la expresin (2)
Englobando los trminos constantes de la ecuacin anterior en una constante k, se obtiene:
Con lo que operando:
1/2hi (2h0+hi) = DAB K ti
Difusividad de AcetonaAire segn las ecuaciones tericas.
SlatteryBird:
Si se supone una mezcla binaria de gases no polares se tiene:
;
donde: a = 2.74104 b = 1.823 y
Sistema ACETONAAIRE a 50C
6
Para el sistema AcetonaAire a 50C los valores que habr que sustituir en la correlacin son los siguientes:
T = 323K
P=741 mmHg
TCaire=132.4 K
PCaire=37.2 atm = 28272 mmHg
TCacetona=508.1 K
PCacetona=46 atm = 35261 mmHg
Maire=29 g/mol
Macetona= 58.08 g/mol
Sistema METANOLAIRE a 50C
Para el sistema MetanolAire a 50C los valores que habr que sustituir en la correlacin son los
siguientes
T=323 K
P=741 mmHg
TCaire=132.4 K
PCaire=37.2 atm = 28272 mmHg
TCmetanol=513 K
PCmetanol=78.7 atm = 59812 mmHg
Maire=29 g/mol
Mmetanol=32.042 g/mol
HirchsfelderBirdPratz:
7
Sistema ACETONAAIRE a 50C
Para el sistema AcetonaAire a 50C los valores que habr que sustituir en la correlacin son los
siguientes:
P = 0.975 atm
T = 323K
Maire =29 g/mol
Macetona = 58.08 g/mol
A
Sustituyendo en la ecuacin:
Sistema METANOLAIRE a 50C
Para el sistema MetanolAire a 50C los valores que habr que sustituir en la correlacin son los
siguientes:
P = 0.975 atm
T = 323K
Maire =29 g/mol
Mmetanol = 32.042 g/mol
A
Sustituyendo en la ecuacin:
Se compararn los valores determinados tericamente con los obtenidos experimentalmente, estimando el
error de las ecuaciones de prediccin para cada sistema
8
Sistema ACETONAAIRE a 50C Sistema METANOLAIRE a 50C
Experimental SlatteryBird Experimental SlatteryBird
DAB = 0.142 cm2s1 DAB = 0.129 cm2s1 DAB = 0.234 cm2s1 DAB = 0.167 cm2s1
Error = 9.15% Error = 28.6%
Experimental HirchsfelderBirdPratz Experimental HirchsfelderBirdPratz
DAB = 0.142 cm2s1 DAB = 0.113 cm2s1 DAB = 0.234 cm2s1 DAB = 0.182 cm2s1
Error = 20.4% Error = 22.2%
siendo % Error =
exp = experimental; teor = terico
Como conclusin y visto que los porcentajes de error estn entorno al 25 % se puede concluir diciendo
que las medidas experimentales fallan principalmente debido a errores en la medida. Este tipo de
errores tienen que ver con la persona que realiza la medida y tambin a que no siempre mida la misma.
De todos modos se obtienen tambin errores grandes porque las medidas son muy pequeas y por tanto
cualquier alejamiento de lo exacto y preciso se hace notar ms.
Conclusiones y sugerencias.
Como conclusin final se adjuntan los datos obtenidos en otros experimentos llevados a cabo a
temperaturas diferentes para el sistema MetanolAire:
GRUPO 1 2 3 4
T (C) 60 55 50 45
(cm2s1)
0.2043 0.2150 0.2340 0.2110
En teora el coeficiente de difusin, DAB, para un mismo sistema, en este caso el del MetanolAire,
debera disminuir con la temperatura. Esto se debe precisamente a que la difusividad es directamente
proporcional a la temperatura de la forma que sigue:
Como se vio anteriormente esta es la expresin que permite obtener el valor de la constante
adimensional que tiene relacin con DAB:
Por otro lado se tiene que el coeficiente de difusin responde la siguiente expresin:
Pues bien, si se introduce en
lo que vale la constante k se llega, ya de manera ordenada, a lo siguiente:
9
Aqu se observa claramente que la difusividad y la temperatura son directamente proporcionales y por
tanto si una aumenta lo har tambin la otra y viceversa.
Cuestiones
Cmo vara la difusividad en fase gas con la temperatura?Es esta variacin igual tanto si las
temperaturas son bajas como si son elevadas
En teora debera disminuir con la temperatura. Esta variacin no ser la misma a temperaturas bajas
que a altas porque a temperaturas altas se facilita la difusividad pero lo que realmente influye o explica
este fenmeno es el aumento de la energa cintica debido a que al aumentar la temperatura tambin
hay mayor nmero de choques. Realmente la difusividad vara ms a temperaturas elevadas que a
temperaturas bajas. De todas formas la determinacin de la difusividad a partir de valores del
coeficiente de difusin trmica est limitada a pares de gases nobles y molculas monoatmicas sin
grados internos de libertad.
Cmo afectara a la difusividad en fase gas del componente objeto de estudio la presencia en la
celda de difusin (fase lquida) de un segundo componente no voltil y miscible con el primero?
El hecho de ser no voltil implica que no se evaporar en las condiciones de trabajo y por tanto no
alcanzar el equilibrio lquidovapor. Por ser miscible se mezclar con el resto de componentes y por
tanto ser necesario aplicar ms energa calorfica para conseguir la evaporacin. En conclusin
disminuir la difusividad, tanto ms cuanto menos voltil y ms miscible sea el componente.
Por qu razn la celda de difusin tiene que ser un cilindro de pequeo dimetro? Cmo se evita
la presencia de fenmenos de convencin asociados a los puramente difusionales?
Principalmente se utilizan celdas de pequeo dimetro para asegurar que la difusin se produzca
unidireccionalmente. Un dimetro de mayor tamao implicara una difusin en dos direcciones, la
radial y la longitudinal, y adems facilitara turbulencias.
Bibliografa
Fsicoqumica: Ira N. Levine, McGrawHill, 1991
lvarez, R., Diseo y Construccion de un Sistema para la medida de difusividades en fase
vapor, Tesis de licenciatura, Universidad de Oviedo, 1975.
lvarez, R., Determinacin de coeficientes de difusin de vapores orgnicos en sistemas
polmero disolvente mediante la tcnica Stephan Winkelmann. Tesis doctoral. Universidad de
Oviedo, 1977.
http://www.virtual.unal.edu.co/cursos/sedes/manizales/4090013/links/PDF/cap_2.pdf
10
Potrebbero piacerti anche
- Determinacion de Constante de DIFUSIVIDADDocumento12 pagineDeterminacion de Constante de DIFUSIVIDADMike UlloaNessuna valutazione finora
- Ingeniería química. Soluciones a los problemas del tomo IDa EverandIngeniería química. Soluciones a los problemas del tomo INessuna valutazione finora
- Práctica 2: Determinación Experimental de Coeficientes de Difusión Molecular en Fase GaseosaDocumento12 paginePráctica 2: Determinación Experimental de Coeficientes de Difusión Molecular en Fase GaseosaArturo ChavezNessuna valutazione finora
- Difusividad MasicaDocumento17 pagineDifusividad MasicaGuillermoNessuna valutazione finora
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDa EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSValutazione: 4.5 su 5 stelle4.5/5 (7)
- Reporte 1 - DIfusión Binaria en GasesDocumento13 pagineReporte 1 - DIfusión Binaria en GasesDaniel Servín100% (4)
- Problemas resueltos de Hidráulica de CanalesDa EverandProblemas resueltos de Hidráulica de CanalesValutazione: 4.5 su 5 stelle4.5/5 (7)
- Calculo de U en RAMDocumento17 pagineCalculo de U en RAMEric Jasso CelayaNessuna valutazione finora
- UF1670 - Reparación de equipos mecánicos y eléctricos de plantas de tratamiento de agua y plantas depuradorasDa EverandUF1670 - Reparación de equipos mecánicos y eléctricos de plantas de tratamiento de agua y plantas depuradorasValutazione: 5 su 5 stelle5/5 (1)
- Documento 6Documento42 pagineDocumento 6Germany G Cando100% (1)
- Difusión MásicaDocumento9 pagineDifusión MásicaAlex MonzonNessuna valutazione finora
- Eficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108Da EverandEficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108Nessuna valutazione finora
- Guía de Ejercicios 1Documento6 pagineGuía de Ejercicios 1blaskyyNessuna valutazione finora
- Difusión MolecularDocumento11 pagineDifusión MolecularTania HoneyNessuna valutazione finora
- Difusividad (Nuestro)Documento15 pagineDifusividad (Nuestro)Nicolas Aristizabal HernandezNessuna valutazione finora
- L9 ReporteDocumento14 pagineL9 ReporteOrlando MartinezNessuna valutazione finora
- Balance de Materia y Energía en Un Proceso de Acondicionamiento de AireDocumento7 pagineBalance de Materia y Energía en Un Proceso de Acondicionamiento de AireDrake Balderas100% (3)
- Informe Difusividad Sustancias OrganicasDocumento17 pagineInforme Difusividad Sustancias OrganicasOscar PulidoNessuna valutazione finora
- Torre de EnfriamientoDocumento10 pagineTorre de EnfriamientoJesús Gerardo JuárezNessuna valutazione finora
- Control de Procesos 1Documento9 pagineControl de Procesos 1Antonio Yañez RamirezNessuna valutazione finora
- Resolucion de Problemas de BioprocesosDocumento6 pagineResolucion de Problemas de BioprocesosJosept Churqui CondoriNessuna valutazione finora
- Solución:: Tanque ADocumento6 pagineSolución:: Tanque APablo MamaniNessuna valutazione finora
- Problemas - DifusionDocumento16 pagineProblemas - DifusionGIANCARLONessuna valutazione finora
- Flujo Fluidos CompresiblesDocumento30 pagineFlujo Fluidos CompresiblesGabriela Fernanda Bravo ParadaNessuna valutazione finora
- 6 TemaDocumento21 pagine6 TemastansilawNessuna valutazione finora
- Práctica 1 - Difusion MolecularDocumento16 paginePráctica 1 - Difusion MolecularJemmy Villalobos100% (1)
- Practica #2 DIFUSIVIDADDocumento10 paginePractica #2 DIFUSIVIDADFreddie Roland PinchiNessuna valutazione finora
- Psicrometria y Acondicionamiento de AireDocumento31 paginePsicrometria y Acondicionamiento de AireRuberli RJNessuna valutazione finora
- Ejercicio de IntercambiadorDocumento4 pagineEjercicio de IntercambiadorAngel De Jesus Arrieta RojanoNessuna valutazione finora
- Ciclo de La Tarea Grupal - Momento 3Documento24 pagineCiclo de La Tarea Grupal - Momento 3LuisCarlosCuelloDiaz100% (1)
- Tercera LeyDocumento2 pagineTercera LeyAndres AcostaNessuna valutazione finora
- Ejercicios Tema 03 Boletin 2 SolucionesDocumento3 pagineEjercicios Tema 03 Boletin 2 SolucionesMysterium Mysterium100% (6)
- Practica 1 LIQ IIIDocumento13 paginePractica 1 LIQ IIIMiguel KasitasNessuna valutazione finora
- Preinforme Coeficiente de DifusividadDocumento7 paginePreinforme Coeficiente de DifusividadMagaly PinzónNessuna valutazione finora
- Transferencia de Masa TrabajoDocumento58 pagineTransferencia de Masa TrabajoJhon Ramirez TamayoNessuna valutazione finora
- Informe - Calentamiento de Un Tanque AgitadoDocumento10 pagineInforme - Calentamiento de Un Tanque AgitadoRodrigo Gabrielli GonzálezNessuna valutazione finora
- Sistemas Termicos e HidraulicosDocumento17 pagineSistemas Termicos e HidraulicosDavid Nicolas Torres BarreraNessuna valutazione finora
- Present P4Documento37 paginePresent P4YaelNessuna valutazione finora
- Laboratorio 1. Equipos de Procesos Térmicos. Carolina Miranda FritzDocumento18 pagineLaboratorio 1. Equipos de Procesos Térmicos. Carolina Miranda FritzJuan Pablo Cuitiño SaldiviaNessuna valutazione finora
- Operaciones UnitariasDocumento30 pagineOperaciones UnitariasPerrito LoquitoNessuna valutazione finora
- CalorDocumento3 pagineCalorcynrg1410Nessuna valutazione finora
- Difusion MasicaDocumento10 pagineDifusion MasicaJohanaAlfaroNessuna valutazione finora
- 2et - Problemario Ley de Raoult (Sistemas Ideales) para EntregarDocumento4 pagine2et - Problemario Ley de Raoult (Sistemas Ideales) para EntregarMiguel Eduardo Rangel Cordero0% (2)
- Parametros Concentrados 1Documento6 pagineParametros Concentrados 1Samuel Lepe80% (5)
- Simunlacion ChemcadDocumento16 pagineSimunlacion ChemcadAxel AbarcaNessuna valutazione finora
- Ejercicios TermodinamicaDocumento15 pagineEjercicios TermodinamicaVictor Ortiz Ortiz50% (2)
- Aguirre Yolanda SecadorDocumento10 pagineAguirre Yolanda SecadoryolandaNessuna valutazione finora
- Difusion BinariaDocumento14 pagineDifusion BinariaAnheliJoceNessuna valutazione finora
- Sistemas de Una Fase1Documento19 pagineSistemas de Una Fase1Luis AngelNessuna valutazione finora
- Conveccion Repaso - UNAC - TurbulentoDocumento12 pagineConveccion Repaso - UNAC - TurbulentoJoe RosasNessuna valutazione finora
- Medidores de Flujo GaseosoDocumento5 pagineMedidores de Flujo GaseosoAndrés Castaño RendónNessuna valutazione finora
- Informe GasesDocumento10 pagineInforme GasesDavid Fernandez0% (1)
- Tema 2Documento9 pagineTema 2Pepe Pertíñez0% (1)
- Difusion Binaria en GasesDocumento13 pagineDifusion Binaria en Gases4n70n104b4dNessuna valutazione finora
- Mezclas IdealesDocumento10 pagineMezclas IdealeskthyCoNessuna valutazione finora
- T4 Equipo2Documento20 pagineT4 Equipo2Ismael GoNessuna valutazione finora
- Ecuaciones Fases FisicoquimicaDocumento17 pagineEcuaciones Fases FisicoquimicaBrianda Villanueva EscobarNessuna valutazione finora