Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Diferencia Entre Fase y Estado
Caricato da
Sato AfrodescendienteCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Diferencia Entre Fase y Estado
Caricato da
Sato AfrodescendienteCopyright:
Formati disponibili
Diferencia entre fase y estado
Una fase es un estado en una secuencia de posibles estados generalmente peridicos (e.g. fases
de la luna). Las fases en termodinmica son los distintos estados homogneos en los que se
presenta una sustancia al ir cambiando su estado termodinmico (temperatura, presin o
concentracin). Los tres estados fsicos de la materia son: slido, lquido y gaseoso.
El estado termodinmico y el equilibrio.
Es una condicin de un sistema o de una sustancia, total o perfectamente definida a travs de sus
propiedades.
Como regla general se puede identificar por completo el estado termodinamico de un sistema o
de una sustancia, a partir de dos propiedades intensivas que sean termodinmicamente
independientes T.I. (a esta regla se le conoce como postulado de estado). Para ilustrar esta regla y
a modo de ejemplo, se tiene una sustancia conocida con propiedades fijas (digamos que es aire) y
se conocen los valores de dos propiedades que con certeza son T.I. (digamos que este aire se
encuentre a la presion que hay en la atmosfera y a la temperatura del sitio en que usted se
encuentra en este momento), por lo tanto las demas propiedades de estado de esta sustancia
como el volumen especifico, la energa interna y otras que no han sido tratadas en detalle (todas)
tienen un valor definido que puede determinarse a partir de las que inicialmente se utilizaron para
definir el estado (un procedimiento detallado para calcular las propiedades restantes sera tratado
el captulo sobre Comportamiento de las sustancias puras).
Si se habla de la misma sustancia, todas las propiedades de un estado dado tienen siempre el
mismo valor sin importar como se haya alcanzado dicho estado, y se identifican plenamente
cuando existe equilibrio termodinmico (en una sustancia, el equilibrio termodinmico se define
cuando no hay transferencia de energa entre las diferentes porciones de masa de esta sustancia o
cuando sus propiedades permanecen constantes e invariantes con el tiempo).
Considerando los aspectos anteriores, si se grafican dos propiedades termodinamicas T.I. en un
diagrama cartesiano (en la figura 3. Se muestra un diagrama Presion "P" vs Volumen especifico
"v"), se observa que cada estado de equilibrio corresponde a un punto cualquiera sobre el
diagrama, por ejemplo en la figura 3. el punto 1 es el estado 1, que fue localizado en el diagrama
con los valores de P1 y v1.
Diferencia
fase
La fase indica la situacin instantnea en el ciclo, de una magnitud que varia cclicamente.
estado
Es la modificacion de la materia en su temperatura o presion. El nmero de grados de libertad es
el nmero de factores variables independientes, tomados de entre la temperatura, presin y
composicin de las fases. Es decir, es el nmero de estas variables que deben especificarse para
que el sistema quede completamente definido.
El sistema H2O(l) - H2O(v) es univariante, solo es necesario un grado de libertad, presin o
temperatura, para describir completamente el sistema en equilibrio Una disolucin slida en el
sistema Al2O3-Cr2O3 es bivariante, es necesario especificar la composicin y la temperatura para
describir el equilibrio del sistema
Potrebbero piacerti anche
- Ley de Charles - PrevioDocumento2 pagineLey de Charles - PrevioIvanzote Benitez100% (1)
- Practica 3 FluidosDocumento5 paginePractica 3 FluidosLeoNessuna valutazione finora
- Practica #3.1 Cambio de Fase en Una Sustancia PuraDocumento7 paginePractica #3.1 Cambio de Fase en Una Sustancia PuraLuis Roberto Aguirre Ramos0% (2)
- Práctica 5 Conductividad TérmicaDocumento10 paginePráctica 5 Conductividad TérmicaRené GVNessuna valutazione finora
- Proyecto de Transferencia de CalorDocumento3 pagineProyecto de Transferencia de CalorSimon Caceres Quiroz100% (3)
- Ley de Stefan-BoltzmannDocumento5 pagineLey de Stefan-Boltzmannflar_ny100% (1)
- Efectos de Los Flujos Externos en Diseño de Elementos AerodinámicosDocumento10 pagineEfectos de Los Flujos Externos en Diseño de Elementos AerodinámicosValeria TreviñoNessuna valutazione finora
- Soldadura Por DifusionDocumento20 pagineSoldadura Por DifusionOmarGReyes100% (6)
- Actividad-2 Conversiones-1851824Documento3 pagineActividad-2 Conversiones-1851824hugo floresNessuna valutazione finora
- Termodinámica gases: Cambio entropía sistema aisladoDocumento10 pagineTermodinámica gases: Cambio entropía sistema aisladoDaniel LoeraNessuna valutazione finora
- Actividad 1 PDFDocumento40 pagineActividad 1 PDFArizbeth RodríguezNessuna valutazione finora
- Informe Influencia de La Temperatura en La Presión de VaporDocumento9 pagineInforme Influencia de La Temperatura en La Presión de VaporANdres Murillo100% (2)
- Celdas ElectroquimicasDocumento11 pagineCeldas ElectroquimicasArias100% (1)
- Ecuaciones de estado y métodos para determinar pesos molecularesDocumento8 pagineEcuaciones de estado y métodos para determinar pesos molecularesAbner MartinezNessuna valutazione finora
- Capítulo 2 CengelDocumento21 pagineCapítulo 2 CengelMatamoros De La Cruz Jorge100% (1)
- Presión ManométricaDocumento22 paginePresión ManométricaLAURANessuna valutazione finora
- Soldadura Electrica Por ResistenciaDocumento6 pagineSoldadura Electrica Por ResistenciaEliud GzzNessuna valutazione finora
- Proyector de PerfilesDocumento13 pagineProyector de PerfilesTeddy100% (5)
- Practicas Mecanica de Fluidos FIMEDocumento96 paginePracticas Mecanica de Fluidos FIMEClan Ojibwa100% (1)
- Investigación Del VernierDocumento11 pagineInvestigación Del VernierFernando GHNessuna valutazione finora
- Act. 1: Aparatos y Máquinas. Laboratorio de Mecánica de Materiales.Documento9 pagineAct. 1: Aparatos y Máquinas. Laboratorio de Mecánica de Materiales.StratowarionNessuna valutazione finora
- Ley de AmagatDocumento4 pagineLey de AmagatAldo Sebastian Tamay VeleNessuna valutazione finora
- Medición de piezas pequeñas con microscopio y proyectorDocumento3 pagineMedición de piezas pequeñas con microscopio y proyectorAlondra FloresNessuna valutazione finora
- CSS BOOKS: PROPIEDADES DE LAS SUSTANCIAS PURASDocumento2 pagineCSS BOOKS: PROPIEDADES DE LAS SUSTANCIAS PURASMemo Ramirez Mendoza50% (2)
- AutoinductanciaDocumento5 pagineAutoinductanciaedith daniela inga ccencho100% (1)
- Zona elástica límite materialesDocumento2 pagineZona elástica límite materialesLetii Floriano Melendez100% (1)
- Reporte. Práctica #1. Reglas de Seguridad Y Manejo Del EquipoDocumento3 pagineReporte. Práctica #1. Reglas de Seguridad Y Manejo Del EquipoPaola de LeonNessuna valutazione finora
- Dilatacion Lineal. (INFORME)Documento10 pagineDilatacion Lineal. (INFORME)Andres ViloriaNessuna valutazione finora
- Practica No - 1: L Aboratorio de Termodinamica de Vapores Y GasesDocumento20 paginePractica No - 1: L Aboratorio de Termodinamica de Vapores Y GasesTania MontoyaNessuna valutazione finora
- Diagramas de Propiedades Que Involucran A La EntropíaDocumento10 pagineDiagramas de Propiedades Que Involucran A La EntropíaRicardo RM0% (2)
- Actividad Fundamental 1Documento8 pagineActividad Fundamental 1nandoferNessuna valutazione finora
- Aplicación de Las Leyes de La Termodinámica.Documento9 pagineAplicación de Las Leyes de La Termodinámica.Samantha J. EspinosaNessuna valutazione finora
- Presión ReducidaDocumento2 paginePresión ReducidaKenyi Solano Portales100% (1)
- Practica 1 Seguridad en Laboratorio de ElectromagnetismoDocumento10 paginePractica 1 Seguridad en Laboratorio de ElectromagnetismoAnne HarperNessuna valutazione finora
- Experimento de Transferencia de CalorDocumento14 pagineExperimento de Transferencia de CalorYuridiaMontellanoHenestrozaNessuna valutazione finora
- Controladores de temperaturaDocumento14 pagineControladores de temperaturaDaniel SánchezNessuna valutazione finora
- Laboratorio Conductividad TermicaDocumento21 pagineLaboratorio Conductividad TermicaMateo RuizNessuna valutazione finora
- Practica 9 FluidosDocumento14 paginePractica 9 FluidosCarlos ChavezNessuna valutazione finora
- Actividad 8 Bloques de Patron PDFDocumento4 pagineActividad 8 Bloques de Patron PDFArizbeth RodríguezNessuna valutazione finora
- Informe de Laboratorio Calor Especifico de Los SolidosDocumento17 pagineInforme de Laboratorio Calor Especifico de Los SolidosJhon JefferNessuna valutazione finora
- Practica Viscosimetria TermofluidosDocumento8 paginePractica Viscosimetria TermofluidosLena AmpudiaNessuna valutazione finora
- Manómetro Tipo PozoDocumento3 pagineManómetro Tipo Pozogabybomer100% (1)
- Práctica 1 ManometrosDocumento5 paginePráctica 1 ManometrosJosue GuerreroNessuna valutazione finora
- Conclusion EsDocumento5 pagineConclusion EsSheyla GaimesNessuna valutazione finora
- Practica 2 Mecanica de Fluidos.Documento8 paginePractica 2 Mecanica de Fluidos.Bernardo Cantu Rodriguez100% (1)
- Marco Teórico Tensión SuperficialDocumento3 pagineMarco Teórico Tensión SuperficialAlejandro CisnerosNessuna valutazione finora
- Conclusiones Conductividad TérmicaDocumento1 paginaConclusiones Conductividad TérmicaJose de la BarreraNessuna valutazione finora
- Practica 2Documento9 paginePractica 2Ignacio BañuelosNessuna valutazione finora
- Practica 6Documento8 paginePractica 6Quintero OskrNessuna valutazione finora
- Practica 2 Lab Fisica 4Documento5 paginePractica 2 Lab Fisica 4Carlos GonzalesNessuna valutazione finora
- Introducción A Los Instrumentos ReglasDocumento3 pagineIntroducción A Los Instrumentos ReglasAndimonse EguiaNessuna valutazione finora
- Manejo de Tablas de Propiedades TermodinDocumento58 pagineManejo de Tablas de Propiedades TermodingheijoNessuna valutazione finora
- 13-3 y 13-4. Superficies Negras, Grises y DifusasDocumento36 pagine13-3 y 13-4. Superficies Negras, Grises y DifusasNatalia Ahumada Soto100% (1)
- Marco Teórico ImpactoDocumento3 pagineMarco Teórico ImpactoJesus-santamaria-llontop100% (1)
- Metrología UANL: Comparador ópticoDocumento3 pagineMetrología UANL: Comparador ópticoArizbeth RodríguezNessuna valutazione finora
- Termodinámica: Conceptos básicos y leyesDocumento8 pagineTermodinámica: Conceptos básicos y leyescobos_gattuso11Nessuna valutazione finora
- 5.-Diagramas de Propiedades Que Involucran A La Entropía Los Diagramas de Propiedades Proporcionan Gran Ayuda Visual en El AnálisisDocumento4 pagine5.-Diagramas de Propiedades Que Involucran A La Entropía Los Diagramas de Propiedades Proporcionan Gran Ayuda Visual en El AnálisisRasec Leo Chipana MamaniNessuna valutazione finora
- Sistemas termodinámicos y sustancias purasDocumento12 pagineSistemas termodinámicos y sustancias purasrjoseNessuna valutazione finora
- Comportamiento de FasesDocumento35 pagineComportamiento de FasesDroite RonaldoNessuna valutazione finora
- SocratesDocumento3 pagineSocratesMarcos MexNessuna valutazione finora
- Biografía de Wiz KhalifaDocumento2 pagineBiografía de Wiz KhalifaSato AfrodescendienteNessuna valutazione finora
- La Medicina en Tiempos de HipócratesDocumento4 pagineLa Medicina en Tiempos de HipócratesNathaly BerríoNessuna valutazione finora
- Programación Didactica Quimica y FisicaDocumento74 pagineProgramación Didactica Quimica y FisicaSato AfrodescendienteNessuna valutazione finora
- RiegoCultivoDocumento7 pagineRiegoCultivoSato AfrodescendienteNessuna valutazione finora
- Versión: 01Documento2 pagineVersión: 01Sato AfrodescendienteNessuna valutazione finora
- El Metodo CientificoDocumento4 pagineEl Metodo CientificoSato AfrodescendienteNessuna valutazione finora
- La Ciencia y El Metodo CientificoDocumento14 pagineLa Ciencia y El Metodo CientificoSato AfrodescendienteNessuna valutazione finora
- El Metodo CientificoDocumento4 pagineEl Metodo CientificoSato AfrodescendienteNessuna valutazione finora
- Ácido bórico propiedadesDocumento5 pagineÁcido bórico propiedadesnoxleekNessuna valutazione finora
- Lectura El Metodo CientificoDocumento3 pagineLectura El Metodo CientificoSato AfrodescendienteNessuna valutazione finora
- Solucion de Administracion PublicaDocumento2 pagineSolucion de Administracion PublicaSato Afrodescendiente100% (1)
- 88 MIN002 LetraCambioDocumento1 pagina88 MIN002 LetraCambioJulio D. EnriquezNessuna valutazione finora
- Certificado de vecindad JAC 2da Etapa D. LemaitreDocumento1 paginaCertificado de vecindad JAC 2da Etapa D. LemaitreSato AfrodescendienteNessuna valutazione finora
- Ley 743 de 2002 JacDocumento25 pagineLey 743 de 2002 Jacpipe920321Nessuna valutazione finora
- Ejemplo de CERTIFICACIÓN DE RESIDENCIA ItaloDocumento1 paginaEjemplo de CERTIFICACIÓN DE RESIDENCIA ItaloSato AfrodescendienteNessuna valutazione finora
- 31 FilosofiaDocumento1 pagina31 FilosofiaSato AfrodescendienteNessuna valutazione finora
- Biografía de Diomedes DíazDocumento5 pagineBiografía de Diomedes DíazSato AfrodescendienteNessuna valutazione finora
- 31 FilosofiaDocumento5 pagine31 FilosofiaVictor Hugo AlejandroNessuna valutazione finora
- 31 FilosofiaDocumento5 pagine31 FilosofiaVictor Hugo AlejandroNessuna valutazione finora
- Protocolo Grupal Produccion Unidad 3Documento19 pagineProtocolo Grupal Produccion Unidad 3Sato AfrodescendienteNessuna valutazione finora
- Para Qué Sirve La FilosofíaDocumento4 paginePara Qué Sirve La FilosofíaHugomarNessuna valutazione finora
- Las ProteinasDocumento6 pagineLas ProteinasSato AfrodescendienteNessuna valutazione finora
- 31 FilosofiaDocumento5 pagine31 FilosofiaVictor Hugo AlejandroNessuna valutazione finora
- Nomenclatura Alcanos PDFDocumento2 pagineNomenclatura Alcanos PDFricardoarmijoNessuna valutazione finora
- Humedad y CenizasDocumento91 pagineHumedad y CenizasMauricio RomanNessuna valutazione finora
- Humedad y CenizasDocumento91 pagineHumedad y CenizasMauricio RomanNessuna valutazione finora
- Ensayo de FilosofiaDocumento4 pagineEnsayo de FilosofiaSato AfrodescendienteNessuna valutazione finora
- Humedad y CenizasDocumento91 pagineHumedad y CenizasMauricio RomanNessuna valutazione finora
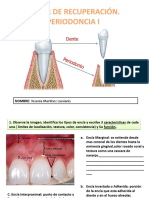
- Taller de Recuperación Periodoncia FinalDocumento6 pagineTaller de Recuperación Periodoncia FinalSato AfrodescendienteNessuna valutazione finora
- Implementación de un reloj en tiempo real usando PIC16F887 y módulo DS3232Documento17 pagineImplementación de un reloj en tiempo real usando PIC16F887 y módulo DS3232Ivan Crispin PaucarNessuna valutazione finora
- 2da Expo. DIFERENCIAS ENTRE UN CONDENSADOR Y GENERADOR ELECTRICODocumento28 pagine2da Expo. DIFERENCIAS ENTRE UN CONDENSADOR Y GENERADOR ELECTRICOJesus Chevarria TellezNessuna valutazione finora
- InvestigacionDocumento6 pagineInvestigacionJoel Abel Pin EspinalNessuna valutazione finora
- 3.0 Parametros de La Fuente SismicaDocumento41 pagine3.0 Parametros de La Fuente SismicaKevinNessuna valutazione finora
- Practica FisicoquimciaDocumento6 paginePractica FisicoquimciaDAYANA MICHELL SANTANA PINTONessuna valutazione finora
- Guía completa sobre el coeficiente de variaciónDocumento5 pagineGuía completa sobre el coeficiente de variaciónNelson Enrique Javier AnguloNessuna valutazione finora
- Proyecto Calculo 1Documento22 pagineProyecto Calculo 1Bryan J. Portocarrero RosasNessuna valutazione finora
- PresaDocumento23 paginePresaAldo SebastianNessuna valutazione finora
- Criterios de Selección de HardwareDocumento3 pagineCriterios de Selección de HardwareHeiner FonsecaNessuna valutazione finora
- FT Ficha Tecnica 385 410 WattsDocumento1 paginaFT Ficha Tecnica 385 410 WattsFrancescoNessuna valutazione finora
- Especificaciones de Cal Viva para Propositos Estructurales 5Documento5 pagineEspecificaciones de Cal Viva para Propositos Estructurales 5jose antonioNessuna valutazione finora
- FORMATO DE CELDA y CondicionalDocumento7 pagineFORMATO DE CELDA y CondicionalDick WatsonNessuna valutazione finora
- Medición y errores en el pesoDocumento13 pagineMedición y errores en el pesoyakelin solisNessuna valutazione finora
- Curva de MuestreoDocumento15 pagineCurva de MuestreoEdson SeguraNessuna valutazione finora
- Guía Herramientas Manuales PDFDocumento34 pagineGuía Herramientas Manuales PDFpaola del carmen Riaño arevaloNessuna valutazione finora
- Estimación de velocidad automóvil vs vídeoDocumento13 pagineEstimación de velocidad automóvil vs vídeoAlber QuemasdaNessuna valutazione finora
- Ejercicio FisicaDocumento2 pagineEjercicio FisicaArian WuNessuna valutazione finora
- Solucion 6-4Documento14 pagineSolucion 6-4viviana8constanza8viNessuna valutazione finora
- 07 Vias de Comunicacion I - UTN - FRLAR - Movimiento de SuelosDocumento31 pagine07 Vias de Comunicacion I - UTN - FRLAR - Movimiento de SuelosJuan Manuel BlancoNessuna valutazione finora
- Actividad Semanal Del Curso Resitencia de MaterialesDocumento24 pagineActividad Semanal Del Curso Resitencia de MaterialesHECTOR ALBERTO PASCO GARFIASNessuna valutazione finora
- Informe de QuimicaDocumento7 pagineInforme de QuimicaOscar David Camacho CristanchoNessuna valutazione finora
- Entregable 1 - Toledo Vargas EdithDocumento6 pagineEntregable 1 - Toledo Vargas EdithEdith Andrea100% (1)
- Dispositivos Auxiliares Del CarburadorDocumento7 pagineDispositivos Auxiliares Del CarburadorYoisNessuna valutazione finora
- Crucigrama Funciones Excel EstudiantesDocumento3 pagineCrucigrama Funciones Excel EstudiantesDuvan Fe Villa0% (1)
- Fortalecimiento en Razonamiento Cuantitativo para ArticulacionDocumento6 pagineFortalecimiento en Razonamiento Cuantitativo para ArticulacionJesús GonzálezNessuna valutazione finora
- Cuadro ComparativoDocumento7 pagineCuadro ComparativoPaola GonzalezNessuna valutazione finora
- Robles Luis Tarea3Documento9 pagineRobles Luis Tarea3Luis RoblesNessuna valutazione finora
- Mecanismos de Produccion en YNFDocumento18 pagineMecanismos de Produccion en YNFGaby Huerta100% (1)
- EXAMEN #4 Ordinario Enero-MarzoDocumento2 pagineEXAMEN #4 Ordinario Enero-MarzoSmith SacNessuna valutazione finora
- Manual CuencasDocumento117 pagineManual CuencasHector SolanoNessuna valutazione finora