Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Experimento 2
Caricato da
Armando Martín Torres ReateguiTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Experimento 2
Caricato da
Armando Martín Torres ReateguiCopyright:
Formati disponibili
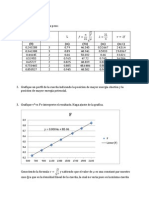
Br2 + 2e- ----- 2Br- +1.
065 reduccin
I2 + 2 e- ----- 2 I- + 0.535 reduccin
Cl2 + 2 e- ---- 2 Cl- + 1.359 reduccin
Mg+2 + 2e- ----- Mg -2.38 reduccin
Zn2+ + 2e- ----- Zn -0.76 reduccin
Cu2+ + 2e- ----- Cu +0.34 reduccin
Na+ + 1e- ----- Na(s) -2.71 reduccin
F2+2 + 2- ------ Fe -0.44 reduccin
EXPERIMENTO 2
OBSERVACIONES:
La reaccin de magnesio con agua de cloro se manifiesta con la aparicin de burbujas
alrededor del metal, formndose cloruro de magnesio; cuando lo hace con agua de
bromo, la reaccin produce ms burbujas, formndose bromuro de magnesio. En esta
ltima reaccin, el color de la solucin es naranja.
Cuando reacciona zinc con agua de cloro, la solucin se torna de color plomo y se
forma cloruro de zinc. En presencia de agua de bromo, el color de la solucin naranja
pasa a plomo, formndose bromuro de zinc.
El cobre caliente no sufri efectos apreciables en la reaccin con agua de cloro, pero
sabemos que se forma cloruro de cobre.
Siendo el agua de bromo de color naranja, cuando reacciona cobre, despus de un
tiempo, la parte baja del tubo de ensayo se torna rojo, evidencindose la presencia de
bromo, y la parte superior se mantiene de color naranja, la reaccin produce bromuro
de cobre.
ECUACIONES QUMICAS:
Cl2(g) + H2O(l) + Mg(s) MgCl2(ac) + H20(l)
Cl2(g) + H2O(l) + Zn(s) ZnCl2(ac) + H2O(l)
Cl2(g) + H2O(l) + Cu(s) CuCl2(ac) + H2O(l)
Br2(g) + H2O(l) + Mg(s) MgBr2(ac) + H20(l)
Br2(g) + H2O(l) + Zn(s) ZnBr2(ac) + H20(l)
Br2(g) + H2O(l) + Cu(s) CuBr2(ac) + H20(l)
DIAGRAMA DE FLUJO:
CONCLUSIONES:
Los halgenos como el cloro y bromo son buenos agentes oxidantes, forman sales con
los metales alcalinos, debido a que los oxidan, mientras que ellos se reducen. Las
propiedades oxidantes de los halgenos disminuyen a medida que el radio atmico se
hace ms grande:
F2>Cl2>Br2>I2 (poder oxidante)
Potrebbero piacerti anche
- Visita Técnica: Ajinomoto Del PerúDocumento11 pagineVisita Técnica: Ajinomoto Del PerúArmando Martín Torres ReateguiNessuna valutazione finora
- Labo Tarsila FinalDocumento9 pagineLabo Tarsila FinalArmando Martín Torres ReateguiNessuna valutazione finora
- Laboratorio de ÓsmosisDocumento10 pagineLaboratorio de ÓsmosisArmando Martín Torres Reategui100% (1)
- Polimerización vinílica mecanismosDocumento6 paginePolimerización vinílica mecanismosArmando Martín Torres ReateguiNessuna valutazione finora
- Fenómenos de TransporteDocumento12 pagineFenómenos de TransporteDavis Cristofer Ramos CollasNessuna valutazione finora
- Acidez y Complejos Trabajo CicloDocumento2 pagineAcidez y Complejos Trabajo CicloArmando Martín Torres ReateguiNessuna valutazione finora
- Fenómenos de TransporteDocumento12 pagineFenómenos de TransporteDavis Cristofer Ramos CollasNessuna valutazione finora
- Datos Diagrama BinarioDocumento3 pagineDatos Diagrama BinarioArmando Martín Torres ReateguiNessuna valutazione finora
- Caratula 1Documento2 pagineCaratula 1Armando Martín Torres ReateguiNessuna valutazione finora
- DatosDocumento3 pagineDatosArmando Martín Torres ReateguiNessuna valutazione finora
- Observaciones Recristal FinalDocumento1 paginaObservaciones Recristal FinalArmando Martín Torres ReateguiNessuna valutazione finora
- Seà Ala El Concepto Que Es Necesario Conocer para Aplicar El Método de Las Titulaciones Volumã©tricas en La Determinaciã N Del Punto EstequiometricoDocumento1 paginaSeà Ala El Concepto Que Es Necesario Conocer para Aplicar El Método de Las Titulaciones Volumã©tricas en La Determinaciã N Del Punto EstequiometricoArmando Martín Torres ReateguiNessuna valutazione finora
- Plan de TrabajoDocumento1 paginaPlan de TrabajoArmando Martín Torres ReateguiNessuna valutazione finora
- Química OrgánicaDocumento2 pagineQuímica OrgánicaArmando Martín Torres ReateguiNessuna valutazione finora
- 2Documento2 pagine2Armando Martín Torres ReateguiNessuna valutazione finora
- Lab 07Documento3 pagineLab 07Armando Martín Torres ReateguiNessuna valutazione finora
- Solucion de Examen Parcial 2014 1Documento2 pagineSolucion de Examen Parcial 2014 1Armando Martín Torres ReateguiNessuna valutazione finora
- CristalizacionDocumento10 pagineCristalizacionArmando Martín Torres ReateguiNessuna valutazione finora
- Lab 03Documento2 pagineLab 03Armando Martín Torres ReateguiNessuna valutazione finora
- Traduccion Del AGNO3Documento1 paginaTraduccion Del AGNO3Armando Martín Torres ReateguiNessuna valutazione finora
- Traduccion Del AGNO3Documento1 paginaTraduccion Del AGNO3Armando Martín Torres ReateguiNessuna valutazione finora
- Informe de Lab. de FluidosDocumento7 pagineInforme de Lab. de FluidosArmando Martín Torres ReateguiNessuna valutazione finora
- Lab Final 3Documento7 pagineLab Final 3Armando Martín Torres ReateguiNessuna valutazione finora
- Electrolisis: Producción de metalesDocumento4 pagineElectrolisis: Producción de metalesArmando Martín Torres ReateguiNessuna valutazione finora
- Labo 9Documento1 paginaLabo 9Armando Martín Torres ReateguiNessuna valutazione finora
- Labo 8Documento2 pagineLabo 8Armando Martín Torres ReateguiNessuna valutazione finora
- Fundamento TeóricoDocumento1 paginaFundamento TeóricoArmando Martín Torres ReateguiNessuna valutazione finora
- Resolución ecuaciones cuadráticasDocumento11 pagineResolución ecuaciones cuadráticasArmando Martín Torres ReateguiNessuna valutazione finora
- PC2UNI20081Documento1 paginaPC2UNI20081Armando Martín Torres ReateguiNessuna valutazione finora