Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Estructura de Lewis
Caricato da
Marvin LopezDescrizione originale:
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Estructura de Lewis
Caricato da
Marvin LopezCopyright:
Formati disponibili
Estructura de Lewis
La estructura de Lewis permite ilustrar de manera sencilla los enlaces qumicos, en ella, el smbolo del elemento est rodeado de puntos o pequeas cruces que corresponden al nmero de electrones presentes en la capa de valencia. Parmetros a considerar en una estructura de Lewis
Escribe el nmero total de electrones de valencia. Considera que cada enlace se formar a partir de dos, y solo dos, electrones. Cada tomo deber cumplir con la regla del octeto. Excepto el hidrgeno que deber tener solo 2 electrones para cumplir con la regla del dueto.
Sabemos que la manera en que los tomos se enlazan ejercen un efecto profundo sobre las propiedades fsicas y qumicas delas sustancias. Qu es un enlace qumico? Aunque esta pregunta se puede responder de diversas formas, el enlace se define como la fuerza que mantiene juntos a grupos de dos o ms tomos y hace que funcionen como unidad. Por ejemplo en el agua la unidad fundamental es la molcula H-O-H cuyos tomos se mantienen juntos por dos enlaces O-H. Se obtiene informacin acerca de la fuerza del enlace midiendo la energa necesaria para romperlo, o sea la energa de enlace. Veremos cmo los tomos interaccionan entre s de diversas formas para formar agregados y se considerarn ejemplos especficos para ilustrar los diversos tipos de enlace. Existen tres tipos importantes de enlaces que se forman entre los tomos de un compuesto: inico(o electrovalente), covalente (polar, no polar y el coordinado) y el enlace metlico. El enlace inico Los elementos qumicos situados a la izquierda del sistema peridico son los que menos electrones han de perder para adquirir estructura electrnica de gas noble. Recordemos que el nmero de la columna donde se encuentran coincide con el nmero de electrones de valencia. De esta forma los elementos de la primera columna, slo han de perder un electrn para pasar a tener 8 en el ltimo nivel (excepto el litio que pasara a tener 2, como el gas noble helio). Anlogamente sucedera con los de las columnas II y III que tendran que perder 2 y 3 electrones respectivamente.
El enlace inico se forma cuando un tomo que pierde electrones relativamente fcil (metal) reacciona con otro que tiene una gran tendencia a ganar electrones (no metal).
El enlace covalente El modelo de enlace entre iones no se puede utilizar para explicar la unin entre cualquier pareja de tomos. Si dos tomos son iguales, no existe ninguna razn que justifique que uno de estos tomos se
transforme en in. Para justificar estas situaciones se utiliza otro modelo de enlace. Cuando los tomos que forman un enlace comparten sus electrones con la finalidad de cumplir con la regla de los ocho, se forma un enlace. El tipo de enlace que se observa en la molcula de hidrgeno y en otras molculas en que los electrones son compartidos por los dos ncleos se llama enlace covalente.
Hasta el momento se han considerado dos tipos de enlace extremos. En el enlace inico, los tomos que participan son tan distintos que ganan o pierden uno o ms electrones para formar iones con carga opuesta. El enlace se debe a las atracciones entre los iones. En el enlace covalente dos tomos idnticos comparten electrones de manera igual. La formacin del enlace se debe a la atraccin mutua de los dos ncleos hacia los electrones compartidos. Entre estos extremos se encuentran casos intermedios en los cuales los tomos no son tan distintos que ganen o pierdan electrones en su totalidad, pero son bastante distintos para que haya un compartimento desigual de electrones y se forme lo que se conoce como enlace covalente polar.
Cuando el par de electrones compartidos pertenece solo a uno de los tomos se presenta un enlace covalente coordinado o dativo. El tomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor. El donador ser siempre el elemento menos electronegativo, tal como se muestra en el ejemplo entre el oxgeno y el azufre, que puede dar lugar a las molculas correspondientes a distintos xidos de azufre. Este enlace una vez formado no se diferencia para nada del enlace covalente normal. Sin embargo debido a cmo se origina se le puede denominar enlace covalente dativo o coordinado. Conviene tener en cuenta que no siempre las molculas que tericamente se podran formar utilizando este tipo de enlace, existen en la realidad, ya que en ello intervienen tambin otros factores que aqu no hemos tenido en cuenta, como por ejemplo, el tamao de los tomos que van a enlazarse y la propia geometra o forma de las molculas.
Enlace metlico Por ltimo estudiaremos el enlace metlico, su importancia la podemos ver en el hecho de que las 3/4 partes de elementos del sistema peridico son metales. El papel que estas sustancias han tenido en el desarrollo de la humanidad es tan importante que incluso se distingue entre la edad de piedra, la edad del bronce y la del hierro. De los 90 elementos que se presentan en la naturaleza algunos metales como el sodio y el magnesio, pueden extraerse de los ocanos donde se encuentran disueltos. Los dems metales se suelen obtener a partir de depsitos minerales que se hallan encimado debajo de la superficie terrestre. Algunos metales son tan poco reactivos que es posible encontrarlos directamente en forma elemental, este es el caso del oro, la plata y el platino. Otros se encuentran formando parte de distintos compuestos qumicos. En general presentan propiedades muy peculiares que los han diferenciado desde hace siglos de las restantes sustancias, tales como: ser excelentes conductores del calor y la electricidad en estado slido, ser fcilmente deformables (lo que permite trabajarlos y fabricar con ellos objetos de distintas formas). Por otra parte suelen presentarse como slidos de dureza variable, con muy diversos puntos de fusin y ebullicin (el galio, por ejemplo, funde a 2978 mientras que otro metal, el tantalio, lo hace a casi3000).
Albrecht Kossel (Rostock, 1853 - Heidelberg, 1927) Fisilogo y qumico alemn. Demostr que en la hidrlisis de las nucleoprotenas hay dos componentes: uno es una protena y el otro el cido nucleico que, a su vez, est formado por timina y adenina. Tambin descubri el cido tmico, la agmatina y la histidina. Aisl las nucleoprotenas a partir de espermatozoides de peces y seal la relacin de los cidos nucleicos con las bases pricas y pirimidnicas. Por estas investigaciones se le concedi el premio Nobel de Fisiologa y Medicina en 1910. Gilbert Newton Lewis Naci el 23 de octubre de 1875 en Weymouth, Massachusetts. En 1884 su familia se radica en Lincoln, Nebraska. Curs estudios en las universidades de Nebraska, Harvard, Leipzig y Gotinga. Fue profesor de qumica en Harvard de 1899 hasta 1906, y en el Instituto de Tecnologa de Massachusetts desde 1907 a 1912. Posteriormente fue profesor de qumica fsica en la Universidad de California en Berkeley, y tambin fue decano de la Escuela de Qumica. Fue el primero en proponer que los tomos podran mantenerse unidos por medio de la comparacin de pares de electrones; de acuerdo con esta idea introdujo el simbolismo de las estructuras, en las que los electrones se representan por puntos (estructuras de Lewis). Desarroll una teora sobre la atraccin y valencia qumicas con el qumico Irving Langmuir, basndose en la estructura atmica de las sustancias, conocida como teora Langmuir-Lewis. En 1926 acu el trmino "fotn" para la menor unidad de energa radiante. Fue el primero tambin en preparar y estudiar, en estado puro, el agua pesada. Reconocido adems por su trabajo sobre la teora de las disoluciones y la aplicacin de los principios de la termodinmica a los problemas qumicos. Gilbert N. Lewis falleci el 23 de marzo de 1946.
Potrebbero piacerti anche
- Factores PonderadosDocumento1 paginaFactores PonderadosAna MurrietaNessuna valutazione finora
- Culturas PrehispanicasDocumento2 pagineCulturas PrehispanicasMarvin LopezNessuna valutazione finora
- Solucionario Nassir SapagDocumento3 pagineSolucionario Nassir Sapaggan dhiNessuna valutazione finora
- Estrategias de MercadeoDocumento7 pagineEstrategias de MercadeoMarvin LopezNessuna valutazione finora
- Cálculo de Un Transformador de Pequeña Potencia (Final)Documento21 pagineCálculo de Un Transformador de Pequeña Potencia (Final)Juan Carlos Casal0% (1)
- Culturas PrehispanicasDocumento8 pagineCulturas PrehispanicasMarvin LopezNessuna valutazione finora
- Tribus Indigenas Organizadas Gerarquicamente A Traves de La ReligionDocumento6 pagineTribus Indigenas Organizadas Gerarquicamente A Traves de La ReligionMarvin LopezNessuna valutazione finora
- Culturas PrehispanicasDocumento8 pagineCulturas PrehispanicasMarvin LopezNessuna valutazione finora
- Culturas PrehispanicasDocumento8 pagineCulturas PrehispanicasMarvin LopezNessuna valutazione finora
- Termometro VisualDocumento2 pagineTermometro VisualMarvin LopezNessuna valutazione finora
- Seguridadfsicaylgica 140330105212 Phpapp02Documento37 pagineSeguridadfsicaylgica 140330105212 Phpapp02Marvin LopezNessuna valutazione finora
- 9 ResueltoDocumento2 pagine9 ResueltoMarvin LopezNessuna valutazione finora
- Ntcyptc EcaDocumento8 pagineNtcyptc EcaMarvin LopezNessuna valutazione finora
- Simbología en Instalaciones Eléctricas ResidencialesDocumento4 pagineSimbología en Instalaciones Eléctricas ResidencialesMiguel Guzmán25% (8)
- ColombiaDocumento3 pagineColombiaMarvin LopezNessuna valutazione finora
- Manual de JavaScriptDocumento23 pagineManual de JavaScriptFranckONessuna valutazione finora
- Documento de Android PDFDocumento56 pagineDocumento de Android PDFMarvin LopezNessuna valutazione finora
- Mecanica de SolidosDocumento0 pagineMecanica de SolidosItzel HpNessuna valutazione finora
- Usb HyperDocumento2 pagineUsb HyperMarvin LopezNessuna valutazione finora
- Generador Van de Graaff1Documento22 pagineGenerador Van de Graaff1Marvin LopezNessuna valutazione finora
- Lab4-A Iaf0 g02 c02-2016 Muestra AcadémicaDocumento2 pagineLab4-A Iaf0 g02 c02-2016 Muestra AcadémicaMarvin LopezNessuna valutazione finora
- Comunicación Escrita IDocumento4 pagineComunicación Escrita IMarvin LopezNessuna valutazione finora
- Código de Ética El Salvador PendriveDocumento11 pagineCódigo de Ética El Salvador PendriveMarvin LopezNessuna valutazione finora
- Lneadetiempo 120417093045 Phpapp01Documento25 pagineLneadetiempo 120417093045 Phpapp01MirnaDedeLeonNessuna valutazione finora
- Term Odin A MicaDocumento3 pagineTerm Odin A MicaMarvin LopezNessuna valutazione finora
- BimestralDocumento4 pagineBimestraldanna valeriaNessuna valutazione finora
- 1PC3 - Basantes JoseDocumento6 pagine1PC3 - Basantes JoseJosé BasantesNessuna valutazione finora
- Taller # 1Documento4 pagineTaller # 1LUISA FERNANDA MARINNessuna valutazione finora
- Cable Vulcanel MRAntitermitas XLP5 y 15 K VDocumento2 pagineCable Vulcanel MRAntitermitas XLP5 y 15 K Vingjorgeuribe5985100% (1)
- Termo PDFDocumento177 pagineTermo PDFEduard GarciaNessuna valutazione finora
- Estadistica Eje 7 DDocumento4 pagineEstadistica Eje 7 DEligio Cruces Wendy JaquelineNessuna valutazione finora
- Tarea 1Documento1 paginaTarea 1DavidNessuna valutazione finora
- PEP 1 2do Sem 2023Documento6 paginePEP 1 2do Sem 2023cesar.munoz.riNessuna valutazione finora
- 7.mini Formulario Física IIDocumento4 pagine7.mini Formulario Física IIJosseth Aguilar GutierrezNessuna valutazione finora
- Cap 4 Propiedades Coligativas 2021Documento33 pagineCap 4 Propiedades Coligativas 2021Abigail CallisayaNessuna valutazione finora
- Equipo5 Practica 3 LabFisica3Documento19 pagineEquipo5 Practica 3 LabFisica3Veronica SanchezNessuna valutazione finora
- Lista Maximos y MinimosDocumento6 pagineLista Maximos y MinimosPAUL JHERSON CARCAHUSTO TUMBILLONessuna valutazione finora
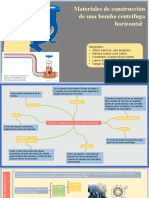
- Materialesde Construccion de Algunas Partes de Bomba Centrifuga HorizontalDocumento6 pagineMaterialesde Construccion de Algunas Partes de Bomba Centrifuga HorizontalAlejandro Vargas GonzalezNessuna valutazione finora
- Ejercicio 2Documento2 pagineEjercicio 2Samuel MoraNessuna valutazione finora
- Distribuciones Normal para ClasesDocumento30 pagineDistribuciones Normal para ClasesAnderson AlvaradoNessuna valutazione finora
- Mecanica de Materiales 2-Sesion 1Documento29 pagineMecanica de Materiales 2-Sesion 1Abed Chamorro VilcaNessuna valutazione finora
- Generador SíncronoDocumento9 pagineGenerador SíncronoJorge VallejosNessuna valutazione finora
- Capitulo 4 Equilibrios de Formacion de ComplejosDocumento12 pagineCapitulo 4 Equilibrios de Formacion de ComplejosGonzalo Plans PerezNessuna valutazione finora
- p1 Practica 1 Fisica 3 FimeDocumento6 paginep1 Practica 1 Fisica 3 FimeLuis Sanchez CordovaNessuna valutazione finora
- Práctica #3 - Proteinas y AminoácidosDocumento9 paginePráctica #3 - Proteinas y AminoácidosAaron QuispeNessuna valutazione finora
- Manual de Cirugia de Tejidos Blandos en Pequenos Animales - 2 EdicionDocumento6 pagineManual de Cirugia de Tejidos Blandos en Pequenos Animales - 2 Edicioncarlithos ramirezNessuna valutazione finora
- Guía No.02 Determinación de Densidad y Viscosidad QuimicaDocumento12 pagineGuía No.02 Determinación de Densidad y Viscosidad QuimicaNayeli QuinatoaNessuna valutazione finora
- AmortiguadoresDocumento4 pagineAmortiguadoresyouacrazyNessuna valutazione finora
- Ensayo de CBR PDFDocumento28 pagineEnsayo de CBR PDFpercyomarherreraNessuna valutazione finora
- Miembros en TraccionDocumento5 pagineMiembros en Traccionmiguel mamaniNessuna valutazione finora
- Derivada Direccional y Vector GradienteDocumento3 pagineDerivada Direccional y Vector GradienteFernando EmilianoNessuna valutazione finora
- Informe 1 Estatica BDocumento3 pagineInforme 1 Estatica BDavid TraslaviñaNessuna valutazione finora
- Reporte de MecanismosDocumento16 pagineReporte de MecanismosDanielNessuna valutazione finora
- Copia de CUESTIONARIOS 1ER TRIMESTRE DE QUÍMICA PRIMERO BACHILLERATO 2023-2024Documento1 paginaCopia de CUESTIONARIOS 1ER TRIMESTRE DE QUÍMICA PRIMERO BACHILLERATO 2023-2024Benito CarriónNessuna valutazione finora
- Tipos de FlujoDocumento26 pagineTipos de FlujoMelissa Rodriguez100% (1)