Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Fisicoquimica Unidad 3
Caricato da
Erick Javier Hernandez PrudencioCopyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Fisicoquimica Unidad 3
Caricato da
Erick Javier Hernandez PrudencioCopyright:
Formati disponibili
MATERIA: PROFESORA: IBQ.
NYX ANAID VARGAS SOTOMAYOR
TEMA DE LA UNIDAD III
SEMESTRE: 4 INTEGRANTES:
GRUPO: B
HORA: 4:00-5:00 N CONTROL:
DIRCIO MORALES MARCO ANTONIO HERNANDEZ PRUDENCIO ERICK JAVIER HERRERA SOBERANIS DAFNE ELIZABETH LEONARDO DANIEL CERVANTES HERNNDEZ GUSTAVO EMIGDIO SNCHEZ NORA BRITO CARBAJAL
10320428 10320421 10320424 10320445 103204
INDICE
UNIDAD 3. FENOMENOS DE SUPERFICIE..
3.1. Fenmenos interfaciales. En una fase, tensin y cintica en la superficie y relacin entre tensin superficial y tensin interfacial.
3.2. Adsorcin. Fundamentos. Tipos de interaccin de adsorcin, isotermas de adsorcin e histresis. Modelos tpicos y sus aplicaciones..
INTRODUCCIN: La Fisicoqumica de superficies se dedica al estudio de cierto tipo de sistemas: los de "superficies de discontinuidad entre fases". En general resulta conveniente dividir el estudio en dos grandes secciones: La primera dedicada a las interfases microscpicas (lquido-gas, lquido-lquido, lquido-
slido, lquido-gas, slido-slido) y la segunda a los llamados "sistemas dispersos" donde el tamao de la partcula en pequeo y la relacin superficie/volumen es muy grande (coloides, emulsiones, espumas, suspensiones). Por la gran trascendencia de los fenmenos que ocurren en las interfases en diversos procesos industriales (detergencia, lubricacin, espumacin, etc). y el empleo extensivo de sistemas dispersos (lodos de perforacin, medicamentos, cosmticos). Este curso debe ser terico-prctico y con mucho nfasis en la parte aplicativa.
Son fenmenos como su nombre lo indica que se dan en la superficie de los cuerpos y estn dados por las atracciones intermoleculares no compensadas. En el interior de una sustancia, las molculas estn rodeadas hacia todos lados, y sus fuerzas de atraccin se compensan. Pero esto no ocurre en la superficie dando lugar a algunas fenmenos que son ms notables cuando la superficie de un cuerpo es mayor en relacin a su volumen (partculas muy pequeas, pelculas muy finas, burbujas, tubos muy finos, huecos muy o pequeos). Los lquidos forman gotas para reducir la superficie expuesta al aire. Esto se debe a una fuerza llamada tensin superficial, que es un fenmeno de superficie. Existen sustancias conocidas como tensioactivos (detergentes) que se acumulan en la superficie modificando la tensin superficial de un lquido. Esto hace que el agua escurra mejor y pase a travs de los tejidos de la ropa, mejorando el lavado. En un tubo pequeo los lquidos se adhieren a las paredes y ascienden. Esto se llama capilaridad y es importante en las plantas. Con este fenmeno de superficie es que el agua llega desde las races a las hojas ms altas de los arboles. Las superficies solidad atraen determinados gases o vapores en los intersticios. Determinados slidos retienen un componente especfico y no otros. Esto sirve para separaciones. El fenmeno se conoce como adsorcin (se escribe as, con "d") y es ms significativo es partculas chicas, con poros
FENOMENOS INTERFACIALES
3
Definiciones Un fenmeno interfacial es por definicin un fenmeno que se produce en una interfase o cuya existencia est ligada a la presencia de una interfase. Una interfase es el lmite entre dos fases inmiscibles. La propiedad ms relevante de la interfase es su rea, la cual es en general grande en la mayora de las aplicaciones de inters. Al dispersar una fase en otra, se obtienen varios sistemas, llamados dispersiones en forma genrica. Humo = dispersin de slido en gas Niebla = dispersin de lquido en gas Espuma = dispersin de gas en lquido o slido Emulsin = dispersin de lquido en lquido Suspensin = dispersin de slido en lquido A los cuales hay que aadir los sistemas en los que el gran rea no se obtiene por dispersin, sino por formacin de un medio poroso bicontnuo, como en las aplicaciones petroleras, catalticas y otras. Ntese que la palabra espaola interfase es la traduccin de dos palabras que en otros idiomas expresan dos conceptos levemente diferentes. Por ejemplo en ingls se tiene la palabra "interface" que textualmente significa entre caras, y la palabra "interphase" que significa entre fases. Ya que la superficie de contacto de una fase con otra se hace a travs de una "cara", los conceptos son muy vecinos y es probablemente por eso que la lingstica castellana no hace la diferencia. La fusin de los dos conceptos es todava ms obvia cuando se nota que el sustantivo "interfase" se escribe con "s" y el adjetivo correspondiente "interfacial" se escribe con "c". En muchos textos se encontrar un uso equivalente de las palabras "superficie" e "interfase", particularmente en la literatura anglosajona. En el presente se prefiere introducir una leve diferencia entre el uso de las palabras, guardando el vocablo "superficie" para el caso del lmite entre una fase condensada (lquido o slido) con una fase no condensada (gas y eventualmente vaco). En cuanto a la palabra interfase se aplicar al lmite entre dos fases condensadas (lquidos inmiscibles o un lquido y un slido). En la mayora de las aplicaciones de inters se encuentra en la interfase un tercer tipo de sustancia llamada surfactante del ingls "surfactant" ( = surface active agent ). Estas sustancias permiten controlar las propiedades del sistema y segn el caso y el uso se califican como jabn, detergente, tensoactivo, emulsionante, dispersante, espumante, humectante, hidrofobante, inhibidor de corrosin, etc... El surfactante juega un papel de primera importancia en los sistemas que poseen una fase continua lquida en la cual el surfactante puede migrar por conveccin o difusin: las espumas, las emulsiones y las suspensiones. La lista anterior evidencia el gran nmero de propiedades que puede tener un agente activo superficialmente o surfactante. Por eso se prefiere el neologismo "surfactante" a la palabra castellana tradicional "tensoactivo", porque esta ltima implica una accin sobre la tensin, lo que es slo una de las propiedades de los surfactantes. Fenmenos interfaciales. En una fase, tensin y cintica en la superficie. TENSION SUPERFICIAL E INTERFACIAL
La fuerza, por unidad de longitud, que se requiere para aumentar una superficie se conoce como tensin superficial, y viene expresada en el sistema cgs en dinas por centmetro. La tensin interfacial es la fuerza o tensin existente en la interfase entre dos lquidos inmiscibles y tambin se expresa en dinas por centmetro. Si dos lquidos son miscibles, entre ellos no existe tensin interfacial alguna. En la tabla 1 se dan algunos valores representativos de las tensiones superficiales e interfaciales. TABLA 1 Tensiones superficiales y tensiones interfaciales (frente al agua) a 20 C*
Sustancia
Tensin superficial Sustancia (dyn/cm)
Tensin interfacial frente al agua (dyn/cm)
Agua .............................. 72,8 .. Acido oleico .................. 32,5 .... Benceno ......................... 28,9 .. Cloroformo .................... 27,1 .... Tetracloruro de carbono 26,7 .... Aceite de ricino ............. 39,0 .... Aceite de oliva ............. 35,8 .... Aceite de semilla de algodn .............................. 35,4 Vaselina lquida ............ 33,1 ...
Tetracloruro de carbono. Benceno .................. .... Cloroformo ............. ...... Acido oleico ................. Alcohol noctlico ......... Acido caprlico ............. Aceite de oliva .............
45,0 35,0 32,8 15,6 8,52 8,22 22,9
La tensin superficial como fuerza por unidad de longitud. La tensin que existe en la superficie de un lquido
se pone de manifiesto al colocar, cuidadosamente, sobre ella una aguja engrasada, observndose cmo permanece sobre la citada superficie sin atravesarla. Tambin puede demostrarse la tensin superficial mediante un bastidor de alambre en el que existe una varilla movible, como se muestra en la figura 1, y poniendo, sobre este bastidor, una gota de disolucin jabonosa que forma: una pelcula sobre el rea ABCD. Esta pelcula puede estirarse aplicando una fuerza f (un peso) a la varilla movible de longitud L, que acta contra la tensin de la pelcula de jabn, pues cuando se quita el peso, la pelcula se volver a contraer a consecuencia de su tensin superficial. La tensin superficial y es la fuerza, por unidad de longitud, a lo largo de la varilla, existente en la superficie de la pelcula, y que se opone al aumento de la citada superficie. Ahora bien, como tanto la superficie superior como la inferior (por encima y por debajo del plano del dibujo) estn en contacto con la varilla, la longitud total a considerar ser 2L. Por tanto, la tensin superficial de la disolucin se calcula a partir de la expresin:
[1] en donde fb es la fuerza necesaria para romper la pelcula y 2L es el doble de la longitud de la varilla mvil. Ejemplo 1. Si la longitud L de la varilla es de 5 cm y la masa necesaria para romper la pelcula fue de 0,5 g, cul es la tensin superficial de la disolucin jabonosa? Recurdese que la fuerza ejercida hacia abajo es igual a la masa multiplicada por la aceleracin de la gravedad. Por tanto:
Energa libre superficial. Para poder calcular el trabajo realizado (energa) al aumentar el rea superficial, se puede escribir la ecuacin [1] as x 2L = f. Cuando la varilla est en la posicin AD y se cuelga el peso necesario para aumentar la superficie en una cantidad ds, el trabajo, dW (fuerza multiplicada por distancia), realizado ser:
y, puesto que 2L x ds es igual al aumento del rea superficial, dA, producido al extender ms la pelcula de jabn:
que para una variacin finita ser: 6
2] en donde W es el trabajo realizado, o sea, el incremento de la energa libre superficial expresada en ergios, la tensin superficial en dinas por centmetro y A es el incremento del rea en centmetros cuadrados. Como toda forma de la energa consta de un factor de intensidad y otro de capacidad (pg. 689), en este caso la tensin superficial es el factor de intensidad y la variacin del rea el factor de capacidad de la energa libre superficial. Por tanto, segn la ecuacin [2], la tensin superficial puede definirse como la variacin de la energa libre superficial por incremento unitario del rea superficial. Algunos qumicos, especializados en coloides, simplifican esta definicin y denominan a la tensin superficial, "energa libre superficial", o "energa superficial libre", pero como esta terminologa se presta a confusiones, no ser empleada aqu. Ejemplo 2. Qu trabajo s requiere en el ejemplo 1 para que la varilla experimente el desplazamiento de 1 cm hacia abajo, tal como indica la figura 1 ? Puesto que el rea aumenta 10 cm2, el trabajo realizado viene dado por la ecuacin: W = 49 dyn/cm x 10 cm2 = 490 erg Mtodo del anillo. El tensimetro de Du Noy es, probablemente, el aparato ms usado para medir la tensin superficial e interfacial, y se basa en l principio antes descrito. El instrumento consiste en un anillo de platin-iridio que se pone en contacto con la superficie del lquido, como se observa en la figura 2. La fuerza necesaria para separar el anillo de la superficie del lquido se suministra mediante un hilo de torsin y se registra en dinas sobre un dial calibrado. La tensin superficial vendr dada por la frmula (comprese con la ecuacin [1]):
Aunque el error de este mtodo es, por lo general, inferior al 5 %, HARKINS y JORDAN 1 han llamado la atencin sobre la posibilidad de introducir errores de hasta un 30%, a no ser que se aplique el factor de correccin necesario. Con el aparato se suele suministrar una grfica para calcular rpidamente el factor de correccin adecuado. Mtodo del ascenso capilar. La tensin superficial puede determinarse midiendo el ascenso de un lquido a travs de un tubo capilar. En un lquido, a
las fuerzas que existen entre las molculas del mismo se las da el nombre de fuerzas de cohesin, y a las que se manifiestan
entre molculas diferentes, como, por ejemplo, las de un lquido y las paredes de un tubo capilar de vidrio, se las llama fuerzas de adhesin. Pues bien, cuando en la superficie de un lquido las fuerzas de adhesin, entre sus molculas y las de la pared del tubo capilar, son mayores que las de cohesin, el lquido moja las paredes, se extiende sobre ellas y asciende por el tubo capilar. Fenmeno ste que servir para medir directamente la tensin superficial del lquido. Considrese, como se indica en la figura 3, un capilar de radio interior r, que se introduce en un lquido capaz de mojar la superficie de aqul. A consecuencia de la tensin superficial, el lquido ascender por el tubo capilar hasta que la fuerza responsable del ascenso se equilibra con la fuerza gravitatoria, de sentido contrario, debida al peso del lquido ascendente. Como se observa en el esquema ampliado de
la figura 4, la componente hacia arriba de la fuerza resultante de la tensin superficial del lquido viene dada, en cualquier punto de la circunferencia, por:
Y la fuerza total ascendente que se manifiesta alrededor de la circunferencia interior del tubo ser:
en de y
donde es el ngulo contacto entre la superficie del lquido la pared del capilar, y es la longitud de 8
la circunferencia interior del capilar. Para el agua y otros lquidos de uso frecuente, el ngulo es muy pequeo debido a que el lquido moja bien la pared del capilar, y por eso, para fines prcticos, se suele considerar a cos como la unidad (vase la parte izquierda de la finura 4).
La fuerza debida a la accin de la gravedad (masa x aceleracin) que se opone a la responsable del ascenso capilar, viene dada por el producto del rea de la seccin recta , la altura h de la columna lquida, hasta el punto inferior del menisco, la diferencia de la densidad del lquido py su vapor y la aceleracin de la gravedad, es decir, , expresin en la que el ltimo trmino w implica el peso de la parte superior del menisco. Cuando el lquido ha alcanzado su altura mxima, la cual puede leerse en la graduacin del propio tubo capilar, las fuerzas opuestas, antes citadas, pueden calcularse, despreciando la densidad del vapor, el ngulo de contacto y w, mediante la expresin:
Ejemplo 3. Una muestra de cloroformo, a 20 C, ascendi hasta una altura de 3,67 cm, en un tubo capilar cuyo radio interior es de 0,01 cm. Cul es la tensin superficial del cloroformo a esta temperatura? La densidad del cloroformo es 1,476 g/cm3
Otros mtodos. Para determinar la tensin superficial e interfacial tambin se emplean otros mtodos, entre los que se incluyen el de la presin de mxima burbuja y el del peso de la gota. CAMPBELL, CHRISTIAN y EATON 2 han ideado una modificacin de la tcnica de, la gota pendiente para la determinacin rpida de la tensin superficial. Influencia de la temperatura sobre la tensin superficial. La tensin superficial de la mayor parte de los lquidos disminuye linealmente al aumentar la temperatura, o sea, al elevarse la energa cintica de las molculas. As, en el caso del agua, la tensin superficial a 0 C es 75,6 y a 75 C es 63,5 dyn/cm. La tensin superficial de un lquido se hace cero en las proximidades de su temperatura crtica.
Tensin superficial
En fsica se denomina tensin superficial de un lquido a la cantidad de energa necesaria para aumentar su superficie por unidad de rea.1 Esta definicin implica que el lquido tiene una resistencia para aumentar su superficie. Este efecto permite a algunos insectos, como
el zapatero (Gerris lacustris), desplazarse por la superficie del agua sin hundirse. La tensin superficial (una manifestacin de las fuerzas intermoleculares en los lquidos), junto a las fuerzas que se dan entre los lquidos y las superficies slidas que entran en contacto con ellos, da lugar a la capilaridad. Como efecto tiene la elevacin o depresin de la superficie de un lquido en la zona de contacto con un slido. Otra posible definicin de tensin superficial: es la fuerza que acta tangencialmente por unidad de longitud en el borde de una superficie libre de un lquido en equilibrio y que tiende a contraer dicha superficie. Tensin interfacial Se llama tensin interfacial a la energa libre existente en la zona de contacto de dos lquidos inmiscibles. Esta energa es consecuencia de las tensiones superficiales de los dos lquidos, y evita que se emulsiones espontneamente. Las unidades de medida de la tensin interfacial son las mismas que las de la tensin superficial. El valor de la tensin interfacial del aceite es indicativo de varias caractersticas del aceite: Es una medida de la inmiscibidad del aceite: Cuando dos lquidos inmiscibles estn en contacto, las molculas en el interior del lquido se atraen unas a otras en todas direcciones. Sin embargo, en la zona de contacto de los lquidos las molculas de cada lquido estn en contacto con las del otro y experimentan fuerzas distintas, unas debidas a las molculas de su fase y otras debidas a las molculas de la otra fase. Al formarse la emulsin, el rea de contacto entre los lquidos se incrementa notablemente, incrementndose la tensin interfacial. En consecuencia, la tensin interfacial tender a unir las gotas y reducir el rea de contacto. Cuanto ms alta sea la tensin interfacial del aceite, ms difcil ser romper la interfase y formar la emulsin, y, una vez conseguido, lograr que la emulsin sea estable ser igualmente difcil. En el caso de los aceites aislantes, la tensin interfacial es un indicativo de la capacidad aislante del aceite. Con el paso del tiempo, y debido a la combinacin de calor, campos elctricos, agua y oxgeno se van generando compuestos polares en el aceite que afectan a su capacidad aislante, ya que estos compuestos facilitan el paso de la corriente elctrica a travs del aceite. Los compuestos polares se van acumulando y afectan a la tensin superficial, reducindola. Esta reduccin facilita que el agua y otros contaminantes se emulsionen con el aceite, aumentando su conductividad. Este aumento de la conductividad del conlleva que el calor disipado por ste sea menor, lo que facilita a su vez la degradacin del aceite y la acumulacin de contaminantes insolubles, que forman lodos. Se produce as un efecto "bola de nieve", acelerndose el proceso exponencialmente. El valor de la tensin interfacial, comparado con el del aceite nuevo, nos da una indicacin bastante precisa de la capacidad aislante del aceite. Debido a que la acumulacin de contaminantes y productos de la degradacin del aceite hacen bajar el valor de la tensin interfacial (como se acaba de decir), este valor, comparado con el del aceite nuevo, nos da una indicacin del grado de envejecimiento del aceite, de su nivel de oxidacin, y / o de la presencia de impurezas. En el aceite nuevo y sin aditivos, la tensin interfacial tiene un valor de entre 40 y 45 dinas/cm, que con el uso de aditivos puede bajar a 25-30 dinas/cm.
10
El valor de la tensin interfacial en un aceite nuevo, comparado con otros, es un indicativo del grado de refino. Una tensin interfacial alta en un aceite nuevo indica la ausencia de compuestos polares orgnicos (aromticos) en el aceite. (Estos compuestos han sido eliminados durante el refinado del aceite). Relacin entre la tensin interfacial y superficial. Al ser la tensin interfacial consecuencia directa de la tensin superficial, la tensin interfacial se ve afectada por los mismos factores que la tensin superficial. La tensin interfacial (al igual que la superficial) puede reducirse con el uso de aditivos emulsificantes. Estas sustancias se acumulan en la zona de contacto de las dos fases de la emulsin, reduciendo la tensin interfacial. Las siliconas, por ejemplo, se utilizan en los aceites minerales para reducir la tensin superficial y facilitar la formacin de emulsiones. La tensin interfacial est en relacin con otras propiedades del aceite, tales como la viscosidad, el pH y la viscosidad.
Fundamentos La adsorcin puede definirse como la tendencia de un componente del sistema a Concentrarse en la interface, donde la composicin interfacial es diferente a las Composiciones correspondientes al seno de las fases.
Hay una clara diferencia entre el fenmeno de adsorcin y el de absorcin, en el segundo existe una penetracin fsica de una fase en la otra; sin embargo es factible que ambos sucedan simultneamente, y en este caso puede ser muy difcil separar los efectos de ambos fenmenos, inclusive un fenmeno puede afectar al otro.
11
Sorcin: se emplea como termino general para los dos fenmenos (ad- y absorcin, cuando se desconoce la naturaleza del fenmeno Absorcin: la sustancia acumulada difunde dentro del cuerpo de un slido (absorbente y absorbato) Adsorcin: la sustancia se acumula sobre la supercie del slido (adsorbente y adsorbato)
El fenmeno de adsorcin es de particular relevancia en la ciencia de los coloides y superficies. El proceso de adsorcin de tomos y molculas en las interfases, es una de las principales formas en que las interfases de alta energa pueden modificarse para disminuir la energa total del sistema. a) La adsorcin puede ocurrir en cualquier tipo de interfase (L-G, S-G, L-S), sin embrago las diferentes caractersticas de las interfases slidas y lquidas hace necesario un anlisis particular de cada caso. En los procesos de adsorcin hay dos aspectos que deben ser considerados; El efecto de la adsorcin sobre la energa interfacial del sistema en el equilibrio (Termodinmica) La rapidez del proceso de adsorcin (cintica) Definicin de trminos Adsorbato: Sustancia que se pega (adsorbe) en la superficie. Adsorbente: Superficie sobre la que sucede la adsorcin. x Cantidad de adsorbato adsorbida en una cantidad dada de adsorbente. m Cantidad de adsorbente sobre la que sucede la adsorcin.
12
x/m = y Cantidad adsorbida por gramo de adsorbente. Ym Cantidad adsorbida por gramo de adsorbente en la mono capa. rea superficial especfica del adsorbente (m2/g). rea molecular del adsorbato (m2/molcula). Fraccin de superficie cubierta por el adsorbato. (1 ) Fraccin de superficie no cubierta por el adsorbato.
Una isoterma de adsorcin, es la relacin general entre la cantidad de gas adsorbido por un slido, a temperatura constante como funcin de la presin del gas. Tambin puede definirse como la relacin en el equilibrio entre la cantidad de gas adsorbido y la presin del gas a temperatura constante.
Segn sus caractersticas la adsorcin puede clasificarse en dos tipos: Adsorcin fsica (fisisorcin): fuerzas de van der Waalls, H~ 20 KJ/mol, reversible desorcin si T y P, no es de naturaleza especfica (sitios activos), formacin de multicapas, el adsorbato conserva su identidad.
Adsorcin qumica (quimisorcin): fuerzas anlogas al enlace qumico (atraccin entre iones opuestos o coulombicas, coordinadas o covalentes), H~ 200 KJ/mol, irreversible no hay desorcin si T y P a menos que sean cambios muy drsticos, es de naturaleza especfica (sitios activos), formacin de mono capas, el adsorbato puede perder su identidad,
13
Factores que afectan a la cantidad adsorbida o Cantidad del adsorbente (m): Superficie disponible o P o C del adsorbato: Cantidad de material disponible o Temperatura: Generalmente la adsorcin es exotrmica Si T, P C y m dadas, entonces Y (x/m) se ve afectada por: o Naturaleza del adsorbato. o Naturaleza del adsorbente. o Naturaleza del disolvente.
Adsorcin en interfases liquidas
Cuanto ms soluto tengamos, menor tensin supercial (energa libre). La concentracin est favorecida En consecuencia, el soluto se concentra sobre la supercie de adsorcin
14
Cuanto menos soluto tengamos en la supercie mayor tensin supercial (energa libre) La concentracin no est favorecida El soluto es repelido de la supercie
Tipos de interaccin de adsorcin, isotermas de adsorcin e histresis Existen 5 tipos o perfiles de isotermas I-V. Para explicarlos se han propuesto Diferentes ecuaciones.
Fenmenos en la adsorcin fsica. 1. Adsorcin mono molecular 2. Adsorcin multimolecular. 3. Condensacin en poros o capilares.
15
16
Adsorcin especca
Concentracin soluto, c, en el global del lquido
Exceso supercial o Adsorcin especca, T Cantidad de sustancia por unidad de rea en exceso de la que hay en el global del lquido (exceso supercial).
17
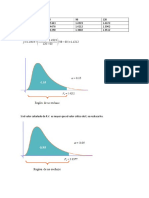
Isoterma de adsorcin de Gibbs Basada en consideraciones termodinmicas
Descenso de la tensin supercial al aadir un sustancia anflica La pendiente de /lnc alcanza un valor lmite y permanece cte. Se alcanza saturacin en el punto B (la adsorcin especca no aumenta a pesar de que la concentracin total sigue subiendo La tensin supercial disminuye ampliamente hasta que alcanza C En el segmento B-C, las molculas de surfactante estn empaquetadas en la supercie, y el rea supercial ocupado por la molcula es constante (se puede calcular el exceso supercial y el rea supercial empleando la ecuacin de Gibbs) La validez de la ec. De Gibbs se ha comprobado experimentalmente
Justicacin: Isoterma de Gibbs
18
Otras isotermas de adsorcin
Ejemplo: Los datos experimentales siguientes indican que la cantidad de CO adsorbido sobre carbn a diferentes presiones y a 0C. Cumple la ecuacin de Langmuir? Qu cantidad de CO se requiere para cubrir 1 g de carbn? P (mm Hg) x/M (mmol/g) 100 0.15 200 0.27 301 0.38 402 0.46 503 0.55
19
Los datos proporcionan un buen ajuste del modelo de Langmuir (r = 0.9952). La pendiente de la lnea 1/y es 0.6 g/mmol. Ya que y da la cantidad de gas CO requerida para formar una monocapa sobre 1 g de carbn, y mm= 1.7 mmol de CO. La ordenada en el origen es 601 mmHg/mmol/g
Isotermas de adsorcin
Tipos De Interaccion De Adsorcion Isotermas De Adsorcion E Histeresis La adsorcin es el fenmeno de concentracin (depsito) de una sustancia (adsorbato o soluto) sobre la superficie de un slido o un lquido (adsorbente). La adsorcin se debe a la presencia de fuerzas intermoleculares sin balancear, de las molculas que se encuentran en la superficie de un slido o un lquido (interfase), por lo cual atraen a las molculas de otras sustancias con las que se ponen en contacto, equilibrando de esta manera las fuerzas atractivas y disminuyendo la energa superficial. La interfase puede ser: Slido gas. Slido lquido. Lquido gas. Lquido lquido La adsorcin puede ser fsica (fisisorcin) o qumica (quimisorcin):
ADSORCION FISICA ADSORCION QUIMICA 1. Interacciones dbiles adsorbato adsorbente, del1. Enlaces fuertes, del tipo covalente (se forma un tipo Van der Waals, dipolo-dipolo, puentes denuevo compuesto). hidrgeno. 2. Adsorcin reversible. 2. Generalmente irreversible.
20
Isoterma de adsorcin de Henry o multicapas. 3. Formacin de mono
o o o o
3. Formacin de monocapas. 4. Calor de adsorcin (entalpa) relativamente bajo, H4. Calor de adsorcin elevado, H = 50 100 kcal/mol. Temperatura constante. = 1 10 kcal/mol. Superficie lisa adsorcin de agua sobre el desecante silicaEjemplos: formacin de xido de Fe, por la reaccin Ejemplos: y homognea. Superficie infinita (adsorcin sin restricciones). gel, vapores de disolventes sobre Cactivado, depsitodel oxgeno con la superficie de objetos de Fe, algunas de vapor de agua sobre vidrios, espejos, etc. reacciones especficas de catlisis, reacciones No existen interacciones entre las molculas adsorbidas. covalentes para inmovilizar enzimas, etc
La isoterma de Henry, establece que la adsorcin es directamente proporcional a la concentracin del soluto. Este La cantidad de soluto una isoterma funcin de del Tipo I y rea especfica superficial del modelo, linealiza la primera parte deadsorbido es experimentalla naturalezadel Tipo II, y por lo tanto, slo se aplica a adsorbente y del muy bajas concentraciones. soluto, as como de la presin (P) concentracin (C) de este ltimo y de la temperatura del sistema. Isoterma de adsorcin de Langmuir Ecuacin de Langmuir linealizada
A temperatura constante, se obtienen las isotermas de adsorcin, que cuantifican la adsorcin en Temperatura constante. funcin de la concentracin sitios definidos (activos) de representan grficamente. Adsorcin localizada, slo en del soluto en el equilibrio y sela superficie. La superficie es homognea y se forma una monocapa, asumiendo que cada sitio de adsorcin puede adherir slo unaDonde: La cantidad de soluto molcula de adsorbato. adsorbida, se denota por la letra a. a = cantidad de soluto adsorbida. presin La energa de adsorcin es la misma para todos los sitios de P C =Tipo III concentracin del adsorbato. Tipo I K = constante de Langmuir. Tipo II adsorcin. am = adsorcin mxima. Isoterma polimolecular. Isoterma que se presenta Isoterma monomolecular No existe interaccin entre las molcula adsorbidas. cuando existe baja interaccin Isoterma de B.E.T. Isoterma de Langmuir. adsorbato adsorbente
Las isotermas experimentales que ms comnmente se obtienen, son:
La isoterma de Langmuir linealiza la isoterma del Tipo I.
La adsorcin mxima (am) indica la mxima capacidad de adsorcin (saturacin monomolecular) del adsorbente. Ecuacin de Freundlich linealizada Isoterma emprica de adsorcin de Freundlich
o o o o
Temperatura constante. Superficie rugosa (microporosa). Distribucin exponencial de la energa de los sitios de adsorcin. No supone la formacin de una monocapa.
Donde: a = cantidad de soluto adsorbida. 1/n = constante que representa la velocidad de saturacin del adsorbato. Aunque la isoterma de Freundlich linealiza la m = constante emprica que indica la capacidad de adsorcin y laisoterma del Tipo I, no predice la adsorcin mxima y presenta desviaciones 21valores a afinidad del adsorbato por el adsorbente. elevados de adsorcin.
Isoterma Emmet y T
La ecuacin de Brunauer-Emmett-Teller se emplea rutinariamente para la determinacin del rea especfica superficial to Este modelo de adsorcin linealiza la isoterma del Tipo II.
En la teora de BET se ampla la teora del modelo de monocapa de Langmuir mediante la introduccin de cierta adsorcin en multicapa y la condensacin capilar.
o o
La adsorcin en la primera capa tiene lugar sobre sitios en la superficie de energa homognea. Las molculas adsorbidas en la primera capa actan como sitios de adsorcin de la segunda capa y as sucesiva simple se aproxima a un espesor infinito conforme la presin de vapor Pv, se aproxima a la presin de vapor (presin de vapor de lquido puro). Las caractersticas de condensacin y evaporacin son idnticas en todas las capas excepto en la primera. El cal y dems capas son iguales al calor de condensacin del gas (DHv).
a = cantidad de soluto adsorbida. am = adsorcin mxima, cuando se forma la monocapa. C = es una constante que relaciona el calor de adsorcin de la primera capa y el calor de adsorcin de las multicapas capa HISTERESIS El fenmeno de histresis se manifiesta cuando la isoterma de adsorcin no coincide con la isoterma de desorcin.
Esto se debe a la presencia de microporos en la superficie, que provoca condensacin capilar del adsorbato y entonces bajo la presin del lquido puro, P.
22
Regreso a Adsorcin Regreso a Isoterma de Henry Regreso a Isoterma de Langmuir Regreso a Isoterma de Freundlich Regreso a Isoterma B.E.T. Procesos de adsorcin
La adsorcin es un proceso mediante el cual se extrae materia de una fase y se concentra sobre la superficie de otra fa ello se considera como un fenmeno subsuperficial. La sustancia que se concentra en la superficie o se adsorbe se adsorbente se llama "adsorbente". Por contra, la absorcin es un proceso en el cual las molculas o tomos de una fase interpenetran casi uniform constituyndose una "solucin" con esta segunda.
Diferentes procesos de sorcin (Appelo and Postma, 1993) Representacin esquemtica de los procesos de adsorcin.
23
El proceso de cambio inico supone un intercambio de una sustancia o in por otra sobre la superficie del slido. El adsorcin y la absorcin conjuntamente, siendo una expresin general para un proceso en el cual un componente se acumularse en otra, principalmente en los casos en que la segunda fase es slida. La principal distincin entre sorcin (adsorcin y absorcin) y cambio inico es que las ecuaciones que describen la sorc especie qumica, de manera que la distribucin del soluto entre la disolucin y el slido responde a una relacin simpl para el cambio inico tienen en cuenta todos los iones que compiten por los lugares de intercambio.
En general, la adsorcin desde una disolucin a un slido ocurre como consecuencia del carcter liofbico (no afi disolvente particular, o debido a una afinidad elevada del soluto por el slido o por una accin combinada de estas dos fu El grado de solubilidad de una sustancia disuelta es el factor ms importante para determinar la intensidad de la prime Cuanto mayor atraccin tiene una sustancia por el disolvente menos posibilidad tiene de trasladarse a la interfase para cambio inico son procesos de gran inters en hidrogeoqumica ya que regulan de manera notable el transporte de acuferos y suelos. Tipos de adsorcin
Cabe distinguir tres tipos de adsorcin segn que la atraccin entre el soluto y el adsorbente sea de tipo elctrico, de V qumica. La adsorcin del primer tipo cae de lleno dentro del intercambio inico y a menudo se le llama adsorcin por in mediante el cual los iones de una sustancia se concentran en una superficie como resultado de la atraccin electrosttica superficie. Para dos absorbatos inicos posibles, a igualdad de otros factores, la carga del in es el factor determinante en Para iones de igual carga, el tamao molecular (radio de solvatacin) determina el orden de preferencia para la adsorc comenta con detalle ms adelante. La adsorcin que tiene lugar debido a las fuerzas de Van del Waals se llama generalmente adsorcin fsica adsorbida no est fija en un lugar especfico de la superficie, sino ms bien est libre de trasladarse dentro de la interfas predomina a temperaturas bajas. La adsorcin de la mayora de las sustancias orgnicas en el agua con carbn activa fsica.
24
Si el adsorbato sufre una interaccin qumica con el adsorbente, el fenmeno se llama adsorcin qumica, adsorci energas de adsorcin son elevadas, del orden de las de un enlace qumico, debido a que el adsorbato forma unos enla centros activos del adsorbente. Esta adsorcin suele estar favorecida a una temperatura elevada. La mayor parte de los fenmenos de adsorcin son combinaciones de las tres formas de adsorcin y, de hecho, no es f fsica y qumica.
Equilibrio de adsorcin e isotermas de adsorcin La adsorcin de una especie qumica presente en la solucin constituyentes de la fase slida del suelo (adsorbente) ocurre debido a la interacciones entre la superficie activa d adsorbato. La cantidad adsorbida de una determinada especie depende no slo de la composicin del suelo sino tambi que se trata y de su concentracin en la solucin. Para estudiar la adsorcin de un compuesto qumico sobre un suelo pueden ser usadas dos tcnicas de laborato experiencias con columnas. Las experiencias en batch consisten en mezclar y agitar una cantidad determinada de suelo c concentraciones del soluto estudiado, por ejemplo, un metal pesado. Previamente, se tiene que determinar la concentraci La grfica que representa el metal adsorbido, Cs, en funcin de la concentracin de la disolucin, Cm, es la isoterma general es : Cs = Kd Cm donde Kd se llama constante de adsorcin, coeficiente de distribucin o coeficiente de particin. Cuando la isoterma no es lineal, hay otras aproximaciones para describir la distribucin entre el suelo y la disolucin. Freundlich y Langmuir. La ecuacin general de la isoterma de Freundlich es : Cs Ks Cm donde K es la constante de adsorcin y n una constante cuyo valor vara entre 0 y 1.
25
Las experiencias en batch no son totalmente representativas de las condiciones naturales, ya que ofrecen una gra tanto, la mxima posibilidad de adsorcin. Adems, se puede considerar que el flujo es nulo. Las experiencias en condiciones de campo, ya que permiten controlar la velocidad de flujo y obtener de este modo coeficientes de distribuci Coeficientes de distribucin para contaminantes orgnicos
Muchos contaminantes orgnicos son hidrofbicos, lo que significa que tienen baja afinidad para solubilizarse en agu mayor para hacerlo en lquidos apolares. Estos contaminantes son fcilmente absorbidos en la materia orgnica de los distribucin de estos compuestos qumicos est relacionado con el coeficiente de distribucin del compuesto entre el Li (ug/g) CL (ug/ml) agua y un lquido apolar, como el octanol. Este ltimo es llamado tambin constante de particin o c puede ser calculado en un embudo separador, con agua y octanol, en el que introduce el compuesto; despus de agitar s se analiza la concentracin en cada una de ellas, Cw y Co, obtenindose el coeficiente de distribucin Kow = Co relacionado con el coeficiente de distribucin entre el carbono orgnico y el agua, Koc, segn la ecuacin (Karickhoff, 1 log Koc = a log Kow + b Tipo de sustancia a b Sustancias para agricultura 0.544 1.337 Hidrocarburos policclicos aromticos 1.00 -0.21 Triacinas, nitroanilinas 0.937 -0.006 Herbicidas, insecticidas 1.029 -0.18 Compuestos heterocclicos aromticos 1.00 -0.317 Hidrocraburos cloruados alquibencenicos 0.72 0.49 Fenilureas sustituidas y alquil-N feni Carbamatos 0.52 0.64
26
Dado que puede variar la naturaleza de la materia orgnica presente en el agua y en el sedimento, es preferible ut aproximacin al Koc, excepto que se tenga datos experimentales del Koc. El log Koc se refiere a la particin entre carbono orgnico; el coeficiente de distribucin real para el sedimento se obtiene como K'd = Koc foc donde foc es la fraccin de carbono orgnico. Esta relacin es vlida para foc mayor de 0.001, ya que de lo contrario la adsorcin sobre compuestos no orgnicos puede ser relativamente importante. INTERCAMBIO INICO
En el transcurso del trayecto subterrneo, las aguas entran en contacto con diferentes sustancias minerales, algunas de de intercambiar ciertos iones con otros contenidos en el agua, fenmeno que tiene una particular relevancia en la qumica Determinados slidos tienen su superficie cargada elctricamente y, cuando estn en contacto con las aguas naturales, s carga opuesta, presentes en el agua, se concentren en la interfase solucin-slido. La causa del intercambio obedece a q superficie lo estn muy dbilmente (iones lbiles) de modo que pueden ser fcilmente reemplazados por otros iones, co de un fenmeno regulado por un equilibrio dinmico entre los iones adsorbidos y los del agua. En general, todos los minerales tienen cierta capacidad de cambio, pero slo la presentan de forma acentuada algunas esp destaca el grupo de las arcillas. Las arcillas, a valores de pH normales, estn cargadas negativamente. El hecho de que sus cargas negativas libres de sup la adsorcin de cationes, hace que habitualmente el fenmeno sea conocido como intercambio catinico o de bases. En general, la fuerza de enlace de los cationes depende de su valencia, tamao efectivo e hidratacin, y de las cara principio, los iones de igual carga son adsorbidos con igual fuerza sobre la superficie slida cargada; en la prctica, sin determina la fuerza de adsorcin, siendo ms fuertemente retenidos los de menor radio hidratado. Hay que tener en cuenta que la hidratacin es directamente proporcional a la carga del in e inversamente proporcional a Por otra parte, los iones multivalentes se concentran en la doble capa preferentemente sobre los monovalentes. Es d adsorbidos ms fuertemente que los monovalentes. Esta selectividad, que favorece la adsorcin de cationes de mayor car de la fuerza inica en la solucin, mientras que la dilucin favorece la retencin de los iones de mayor carga. Todo ello importante el proceso de intercambio inico en un agua salinizada. Algunos cationes pueden ser fijados irreversiblemente en las arcillas. Tal es el caso de los cationes de gran tamao no Li+, por su pequeo radio fuertemente hidratado y del Mg2+, que puede formar parte de la red mineral. El proceso de cambio inico puede provocar importantes modificaciones de la composicin qumica del agua sub concentracin de elementos alcalinos, alcalinotrreos, metales pesados y elementos de transicin. Ya se ha comentado que el fenmeno de cambio inico surge de la capacidad de adsorcin de las superficies de las part de intercambio de bases, la fase slida del acufero interacciona con el agua subterrnea, principalmente debido a minerales arcillosos se ve compensada por adsorcin de cationes del agua subterrnea. Dichos cationes, en equilibri pueden reemplazarse por otros cuando se modifican las caractersticas qumicas del agua.
En los procesos de intrusin marina, tanto el incremento en la concentracin de electrolito como la modificacin del pH, variable del sedimento y por tanto el equilibrio inicial, evolucionando el sistema en la bsqueda de una nueva estabi reacciones de intercambio inico (catinico), se asume que existe un equilibrio entre la solucin y el adsorbente en todo dispersin-difusin son insignificantes. Las reacciones de intercambio catinico estn basadas en el principio del equilib en solucin y en la fase adsorbida. Si se considera la reaccin de cambio binario entre dos cationes monovalentes A+ y B+ (intercambio monovalente), donde R representa la partcula slida adsorbente, el intercambio puede ser descrito:
27
donde [A+] y [B+] representan las actividades respectivas de los iones en la solucin y _A_ y _B_ las fracciones molares de los iones adsorbidos por la fase slida o las fracciones equivalente del in en el c _B_ para el medio de intercambio son, en cualquier instante, funcin de las reacciones de equilibrio qumico entre el circulantes. KA/B es la constante o coeficiente de selectividad que expresa la fuerza de enlace de un cambiador en relaci Los procesos de cambio inico involucran principalmente al Ca2+, Mg2+, Na+ y K+ , si bien, los procesos de in seguramente, los ms comunes dentro de los sistemas naturales y el proceso de intercambio ms comn es el que impl Ca. El que la reaccin se produzca en una u otra direccin depender de las caractersticas del material de inter composicin qumica de la solucin en contacto. En acuferos sedimentarios de origen marino, las arcillas estn saturadas en sodio por la alta relacin Na/Ca en el a qumica catinica de las aguas de recarga est usualmente dominada por el calcio y magnesio. As, una arcilla formada tendr la mayora de sus valencias libres, compensadas con sodio, mientras que en ambiente de agua dulce el calcio y, los cationes predominantes. Si una arcilla de ambiente sdico entra en contacto con una solucin donde el calcio es el c iones sodio que pase a solucin, ser remplazado por un calcio adsorbido, de modo que la disolucin perder calcio incremento del contenido de iones Na+ en la solucin permita alcanzar el equilibrio. Este tipo de reaccin, concordante de la adsorcin, es conocido como intercambio directo. En ciertos casos puede suceder que las direcciones de las reacciones de intercambio sean aparentemente anmalas, c adsorbido en la fase arcillosa, es cedido a la solucin a cambio del Na+ disuelto, ya que es sabido que el calcio ti adsorcin y, por consiguiente, tiene aparentemente dificultad para ser cedido a la solucin. Por este motivo, las reaccion a cambio de sodio, son referidas como reacciones de intercambio inverso. Esta reaccin de intercambio suele ser indicat el acufero, en la que no se ha alcanzado el equilibrio entre las aguas subterrneas y la matriz litolgica. El cambio de bases modifica algunas relaciones entre cationes, si bien el indicador ms simple de intercambio inic Tambin es de gran inters el denominado ndice de cambio de bases (icb): icb = rCl-r(Na+K)/ rCl
que es la relacin entre los iones cambiados y los iones de la misma naturaleza, primitivamente existentes, si se admit haba tanto rCl como r(Na+K) y que hay un cambio de Na y K del agua, contra los alcalinotrreos de las permutitas. D cambio de bases no viene definido por un valor determinado, sino por una variacin. En el terreno, los procesos de cambio solamente ocurren cuando la interfase agua dulce-agua de mar est en movimiento o hay una continua evolucin en el acufero, con etapas de salinizacin y desal presentes, especialmente, en el agua de mezcla pero, una vez se estabiliza y la capacidad de intercambio se agota, el inter
El proceso de intercambio, que acompaa frecuentemente al proceso de intrusin marina, se detecta habitualm concentraciones de algunos cationes cuando se relacionan con la mezcla binaria agua de mar-agua dulce, en base a las c en las aguas. La forma ms sencilla de identificar el proceso de intercambio inico es el clculo de deltas (D) o valores entre las concentraciones tericas, correspondientes a la mezcla conservativa agua de mar-agua dulce, y las concentracio
Valores negativos pueden indicar adsorcin del catin por el terreno, mientras que valores superiores a cero, pueden atri la solucin. El cambio Na-Ca es probablemente la reaccin ms importante durante las intrusiones de agua de mar y de a de la intrusin de agua de mar en un terreno inicialmente en equilibrio con agua dulce de facies bicarbonatada sobresaliente es la facies clorurada clcica de las aguas salinas El proceso inverso, cuando el agua dulce desplaza al a lugar a la existencia de aguas de facies bicarbonatada sdica.
28
El cambio inico es en s un proceso rpido, si el material con el que se efecta el intercambio presenta suficiente superf el total de meq/l de iones disueltos. Factores que influyen en la adsorcin e intercambio inicos
La adsorcin depende de las concentraciones respectivas del catin en el adsorbente y el lquido. La fuerza inica intensidad de la adsorcin, pues la adsorcin relativa es proporcionalmente ms intensa en soluciones diluidas q incrementa la fuerza inica de la solucin en contacto con la arcilla, la capa difusa se comprime y el potencial elctrico distancia a la superficie. Por consiguiente, la superficie potencial variar en funcin de la concentracin de electrol superficie de las partculas (constante o dependiente del pH). Para una superficie pHdependiente, un incremento en la generar un descenso de potencial al producirse un aumento de la distancia a la partcula. La temperatura influye en la medida que las reacciones de adsorcin son normalmente exotrmicas y por tanto, presumiblemente mayor, al disminuir la temperatura, aunque las variaciones normales de temperatura slo tienen pequ de adsorcin. La fuerza de enlace con que los iones son retenidos o adsorbidos en los lugares de cambio depende, asim los cuales cabe citar los siguientes: - Valencia y tamao del in - Densidad de carga, estructura y superficie especfica del material de intercambio - Concentracin relativa de los cationes presentes - Contenido de agua en el sistema (efecto dilucin)
En general, la fuerza de enlace de los cationes depende de su valencia, tamao efectivo e hidratacin y de las cara capacidad de intercambio vara, para un determinado tipo de arcilla, con el tamao de la partcula, siendo ms eleva mayor su superficie especfica. Para arcillas diferentes, la capacidad depende de la estructura; as, por ejemplo, en el caso los cationes situados dentro de la estructura son intercambiables, mientras que los cationes intercapa de la illita no son t forman parte de la red. La teora de Gouy-Chapman predice que los iones de igual carga son adsorbidos con igual fuerza sobre la superficie sli embargo, el radio hidratado, o bien la polarizacin del in, determinan la fuerza de adsorcin, siendo ms fuertemente hidratado. La hidratacin es directamente proporcional a la carga del in e inversamente proporcional al radio inic tamao del in y por tanto reduce su movilidad. Los radios inicos hidratados determinan la movilidad en el filtro de concentracin relativa de los metales en las aguas.
Si se asume que las fuerzas de enlace en la adsorcin, son esencialmente electrostticas y que bajo condiciones ordinar hidratados, los cationes con radios hidratados ms pequeos se acercarn a los lugares de carga negativa ms fcilmen fuerza que un catin de mayor radio hidratado. Segn sto, el Ca2+ ser ms fuertemente adsorbido que el Mg2+. La teora de Gouy establece tambin que los iones multivalentes se concentran en la doble capa preferentemente sobre lo iones divalentes son adsorbidos ms fuertemente que los monovalentes. Consecuentemente, la relacin [M2+]/[M+ aumenta la distancia a la superficie de adsorcin. Dicha selectividad, que favorece la adsorcin de cationes de mayor car de la fuerza inica en la solucin, mientras que la dilucin favorece la retencin de los iones de mayor carga. Todo ello importante el proceso de intercambio inico en un agua salinizada. Algunos cationes pueden ser fijados irreversiblem caso de los cationes de gran tamao no hidratado (NH4+ y K+), del Li+, por su pequeo radio fuertemente hidratado y la red mineral. La adsorcin irreversible tiende a ocurrir cuando hay fuertes interacciones qumicas entre el adsorbente y La adsorcin es, por tanto, in selectivo. Las series respectivas, para iones mono y bivalentes, ordenadas atendiendo a siguientes: Li+<Na+<K+ <Cs+ Mg2+<Ca2+<Sr2+<Ba2+
No existe unanimidad entre los autores a la hora de establecer un orden prioritario de adsorcin, entre los diferentes cat Hofmeister es la siguiente: 29
Li+< Na+< K+< NH4+< Mg2+< Ca2+< Sr2+< Ba2+< Al3+< H+
La posicin de los iones monovalentes y bivalentes en una serie combinada tiende a variar con la naturaleza del mate estructura y distribucin de carga) y con la concentracin y caractersticas de la solucin en contacto. Schachtscha Vahtras, 1982), estudiando el papel del NH4+ en los cidos hmicos y varios minerales, observ la secuencia siguie reemplazamiento de cationes: * Caolinita Li+<Na+<H+<K+<Mg2+<Ca2+ * Montmorillonita Li+<Na+<K+<H+<Mg2+<Ca2+ * Moscovita Li+<Na+<Mg2+<Ca2+<K+<H+ * Acidos hmicos Li+<Na+<K+<Mg2+<Ca2+<H+
Estas series pueden considerarse como de orden normal; sin embargo, en muchos casos puede ocurrir una seleccin o ad que la teora de la hidratacin no puede explicar. La polarizacin y parcial deshidratacin de cationes estn considerada para justificar las desviaciones del "orden normal" de afinidad de intercambio, sin olvidar la concentracin inica caractersticas del material de cambio. Se debe considerar, tambin, el efecto que puede tener la adsorcin de aniones sobre los procesos de cambio. La ad incrementa la carga negativa de la partcula slido. Experiencias sobre el efecto de los iones Cl- en las reacciones de c montmorillonita, han puesto de manifiesto que la exclusin de aniones en el estudio del intercambio puede cond ignificativos. Los aniones asociados con los cationes adsorbidos pueden afectar a la extensin del cambio catinico, ya q incrementa cuando lo hace la fuerza de adsorcin del anin de la sal. La serie de Hofmeister de aniones, en orden decreciente de adsorcin, es la siguiente: SO42-> F-> NO3 -> Cl-> Br-> I-> C y S > OH
30
https://docs.google.com/viewer? a=v&q=cache:qJwvbWLwFfsJ:https://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r4813 +tension+superficial+y+tension+interfacial&hl=es&gl=mx&pid=bl&srcid=ADGEESgJ5qJiTlJRSw yKLSWd_tZtXs4xgmCsd8CGJXfUmtxYmbWba79aGyUwrr8TiVWOmBYf4MrT3pjmjwlfHRxVjINpsM8 TcdOqeZm17IUnz3cQRkE&sig=AHIEtbTtto48DntKXZpCeuXNJCj4J2Co7Q http://es.wikipedia.org/wiki/Tensi%C3%B3n_superficial
https://docs.google.com/viewer? a=v&q=cache:t_kFXlyG_bgJ:www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r17017.DOC+ =es&gl=mx&pid=bl&srcid=ADGEESgaoW-SdeqrC8iHOvGWHKe51k1IbTxXTJiLpDsdAKp6iMiuKXFsKegx6aPXxPbsJBhQK9e5wchRebnWPhJwwql2UKxcTmuFIwoKJ9LjdKfOv98yzEyy31
15rMdIPXD6Geq&sig=AHIEtbQ_jxKurH2i4f4nSBp3vIBPxkjJyQ https://docs.google.com/viewer?a=v&q=cache:4SfCXellbgcJ:asignatura.us.es/amatodon/imagen %25207%2520FENOMENOS%2520DE %2520SUPERFICIE.doc+fenomenos+de+superficie&hl=es&gl=mx&pid=bl&srcid=ADGEESg7zdW lHNj07GYhA5zIRQgwXD6AMhCb9pjuBwMH54yWGWNYaIFgxXdCxGzX6G91BfaUoO8liIbvkxuZRNuMmP9ysCBTCsKWZEsnusEGfa500s AHIEtbSqfCy_Tn5HwNy1bXYXltBlbwSp0g http://depa.fquim.unam.mx/amyd/archivero/Unidad2.TensionsuperficialyTensionInterfacial_1936 http://es.scribd.com/doc/78992612/FAFQII-Fenomenos-interfaciales http://ucmfarmaciadatos.netai.net/segund0/FAFQ%20II/segundo%20parcial%20apuntes%20B.pdf http://www.apuntescientificos.org/adsorcion-bio.html
32
Potrebbero piacerti anche
- Teoría U3 Mecanismos en La Transferencia de Calor - PPT 09-28-29-145Documento11 pagineTeoría U3 Mecanismos en La Transferencia de Calor - PPT 09-28-29-145Daniela FernandezNessuna valutazione finora
- Secado de Solidos Original PDFDocumento16 pagineSecado de Solidos Original PDFFrancibelNessuna valutazione finora
- Trabajo Final FisicoDocumento24 pagineTrabajo Final FisicoTito Perez0% (1)
- IsotermasDocumento5 pagineIsotermasAldoTorreNessuna valutazione finora
- Unidad 2 Clase Equilibrio Quimico LidiaDocumento39 pagineUnidad 2 Clase Equilibrio Quimico LidiaDan CheshireNessuna valutazione finora
- TRANSFERENCIA de MASA, Diapositivas Difusividades de Gases y LiquidosDocumento13 pagineTRANSFERENCIA de MASA, Diapositivas Difusividades de Gases y LiquidosSteffi MaciasNessuna valutazione finora
- Actividades Previas Al Experimento 1Documento4 pagineActividades Previas Al Experimento 1dany_289Nessuna valutazione finora
- AdsorciónDocumento36 pagineAdsorciónEdgarAcevedoAguilarNessuna valutazione finora
- Reporte LEM6 2Documento5 pagineReporte LEM6 2Emmanuel Ramirez RecillasNessuna valutazione finora
- Manejo de FluidosDocumento28 pagineManejo de FluidoskatherineNessuna valutazione finora
- Ecuacion de Adsorcion de Gibbs PDFDocumento14 pagineEcuacion de Adsorcion de Gibbs PDFMarisol GHNessuna valutazione finora
- Capitulo 7Documento12 pagineCapitulo 7Tony SctNessuna valutazione finora
- INFORME 3. Isotermas de AdsorcionDocumento5 pagineINFORME 3. Isotermas de AdsorcionJessy ParraNessuna valutazione finora
- CatalisisDocumento24 pagineCatalisisMaJuTorresRimeyNessuna valutazione finora
- 01a Transf Masa y DifusiónDocumento15 pagine01a Transf Masa y DifusiónCubi Anyosa GarciaNessuna valutazione finora
- Informe 5 Calores de CombustionDocumento13 pagineInforme 5 Calores de CombustionValentina Vallejo CarvajalNessuna valutazione finora
- Reporte Intercambiador de Calor de Placas 2020-IDocumento16 pagineReporte Intercambiador de Calor de Placas 2020-IJose Emmanuel ChemaNessuna valutazione finora
- Ley de NewtonDocumento22 pagineLey de NewtonMartinez De La Cruz CesarNessuna valutazione finora
- Diapos Finales de AdsorcionDocumento64 pagineDiapos Finales de AdsorcionDavis Salcedo PereiraNessuna valutazione finora
- Maquinas Simples CLASESDocumento8 pagineMaquinas Simples CLASESAna YUNessuna valutazione finora
- Superficies ExtendidasDocumento33 pagineSuperficies ExtendidasGabriel PaezNessuna valutazione finora
- 3.4. Sustancias Puras ConceptosDocumento25 pagine3.4. Sustancias Puras ConceptosFlorentino ArosemenaNessuna valutazione finora
- Adsorción de Ácido Acético Sobre Carbón ActivadoDocumento9 pagineAdsorción de Ácido Acético Sobre Carbón ActivadolyncolNessuna valutazione finora
- Reporte Difusion MolecularDocumento18 pagineReporte Difusion MolecularKalalita PueblaNessuna valutazione finora
- Lem III 8-1Documento13 pagineLem III 8-1juan islasNessuna valutazione finora
- LAB 3 Fenol AguaDocumento2 pagineLAB 3 Fenol AguaSebastián MachucaNessuna valutazione finora
- Caracteristicas de Los CatalizadoresDocumento1 paginaCaracteristicas de Los Catalizadoresjippygirl97100% (1)
- INFORME 1 DifenilcarbinolDocumento3 pagineINFORME 1 DifenilcarbinolDanGodAlvNessuna valutazione finora
- Informe N15 Catalisis Del Peroxido de HidrogenoDocumento33 pagineInforme N15 Catalisis Del Peroxido de HidrogenogersonNessuna valutazione finora
- Teoria de La Colisión de Las Reacciones BimolecularesDocumento20 pagineTeoria de La Colisión de Las Reacciones BimolecularesStephany Navas100% (1)
- Transferencia de Calor2Documento31 pagineTransferencia de Calor2Bryan Anthony Aranda CastilloNessuna valutazione finora
- GuiaDocumento81 pagineGuiaaffdhfjhjkgklhljkjhlh;Nessuna valutazione finora
- Regresión - Tratamiento POLINOMIALDocumento11 pagineRegresión - Tratamiento POLINOMIALFernanda GuatibonzaNessuna valutazione finora
- Ayo Practica2Documento11 pagineAyo Practica2HernanGascaEstradaNessuna valutazione finora
- Metodos de Transferencia de Calor en Flujo Bidireccional Por ConducciónDocumento18 pagineMetodos de Transferencia de Calor en Flujo Bidireccional Por Conducciónninoskadj26Nessuna valutazione finora
- Practica1 - Dilucion Del HierroDocumento16 paginePractica1 - Dilucion Del HierroBrandon Quiroz ZárateNessuna valutazione finora
- Práctica Yodacion de La AcetonaDocumento9 paginePráctica Yodacion de La AcetonaAda Sarahi Torres HadidNessuna valutazione finora
- Informe T BurbujaDocumento14 pagineInforme T BurbujaRicardo Felipe Cortes CruzNessuna valutazione finora
- Previo 3 Fusion Lab OrganicaDocumento2 paginePrevio 3 Fusion Lab OrganicaAlexis SanchezNessuna valutazione finora
- Lab Organica VirtualDocumento7 pagineLab Organica VirtualPAULA ESTEFANÍA ÁNGEL HERNANDEZNessuna valutazione finora
- Descomposición Catalítica Del Peróxido de HidrógenoDocumento5 pagineDescomposición Catalítica Del Peróxido de HidrógenoHugo Cruz GalindoNessuna valutazione finora
- VITRIFICACIONDocumento5 pagineVITRIFICACIONJovanyGopar100% (1)
- Practica de Balance de Materia y Energía N°4Documento4 paginePractica de Balance de Materia y Energía N°4Alejandra SanchezNessuna valutazione finora
- Laboratorio 4. Calor Latente de Fusión.Documento13 pagineLaboratorio 4. Calor Latente de Fusión.Karlita DomínguezNessuna valutazione finora
- Electroquimica IIDocumento6 pagineElectroquimica IIFabiola CalderonNessuna valutazione finora
- Modelos TermoDocumento10 pagineModelos TermoSandra MartinezNessuna valutazione finora
- Secado de Tomate en Charolas Lem 4Documento90 pagineSecado de Tomate en Charolas Lem 4Julio Cesar OrtizNessuna valutazione finora
- Clase - Evaporación Jueves 16-04-20Documento34 pagineClase - Evaporación Jueves 16-04-20DanielVasquezNessuna valutazione finora
- Unidad 3. Psicrometría - ESTDocumento43 pagineUnidad 3. Psicrometría - ESTIvan SinningNessuna valutazione finora
- Reología y Textura 2Documento51 pagineReología y Textura 2Zaira GuadarramaNessuna valutazione finora
- Introducción ALA Transformada Wavelet Continua: Jaime Navarro Fuentes David Elizarraraz MartínezDocumento35 pagineIntroducción ALA Transformada Wavelet Continua: Jaime Navarro Fuentes David Elizarraraz MartínezIvan BallesterosNessuna valutazione finora
- Marco Teorico AgitacionDocumento3 pagineMarco Teorico AgitacionMateria GrisNessuna valutazione finora
- Laboratorio Virtual #1 (Transmisión de Calor A Través de Una Pared Esférica)Documento4 pagineLaboratorio Virtual #1 (Transmisión de Calor A Través de Una Pared Esférica)Judhy Pauline Sáenz VizcayaNessuna valutazione finora
- Difusion Molecular 1-3-5-7Documento8 pagineDifusion Molecular 1-3-5-7Lina TorresNessuna valutazione finora
- Reacciones CatalizadasDocumento9 pagineReacciones CatalizadasWalther JesusNessuna valutazione finora
- Destilación Simple y FraccionadaDocumento7 pagineDestilación Simple y FraccionadaValeria M. Diaz75% (4)
- Tema 1 Introducción A La TermodinámicaDocumento52 pagineTema 1 Introducción A La Termodinámicasteven villa cantiiloNessuna valutazione finora
- Propiedades InterfacialesDocumento18 paginePropiedades InterfacialesFernando LópezNessuna valutazione finora
- Incendios IndustrialesDocumento172 pagineIncendios IndustrialesBorjita Nomada100% (1)
- Fenomenos SuperficialesDocumento30 pagineFenomenos SuperficialesFabián R ContrerasNessuna valutazione finora
- Quimica Analitica Ejercicios ResueltosDocumento5 pagineQuimica Analitica Ejercicios ResueltosErick Javier Hernandez PrudencioNessuna valutazione finora
- Manual Quimica Con EjerciciosDocumento43 pagineManual Quimica Con EjerciciosErick Javier Hernandez PrudencioNessuna valutazione finora
- NUTRICIÓNDocumento3 pagineNUTRICIÓNmilena sanchezNessuna valutazione finora
- La Industria Quimica Importancia y RetosDocumento1 paginaLa Industria Quimica Importancia y RetosErick Javier Hernandez PrudencioNessuna valutazione finora
- 2 Materia y Su Constitución Division de QuimicaDocumento7 pagine2 Materia y Su Constitución Division de QuimicaErick Javier Hernandez PrudencioNessuna valutazione finora
- BALDO QUIMICA MAT Comipems-Quimica Organica-RcR (Act)Documento17 pagineBALDO QUIMICA MAT Comipems-Quimica Organica-RcR (Act)Erick Javier Hernandez PrudencioNessuna valutazione finora
- 60Documento2 pagine60Erick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 1 Reconocimiento de Material de LaboratorioDocumento6 paginePractica 1 Reconocimiento de Material de LaboratorioErick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 1 AlcanosDocumento6 paginePractica 1 AlcanosErick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 1 Reconocimiento de Material de LaboratorioDocumento4 paginePractica 1 Reconocimiento de Material de LaboratorioErick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 1 Reconocimiento de Material de LaboratorioDocumento6 paginePractica 1 Reconocimiento de Material de LaboratorioErick Javier Hernandez PrudencioNessuna valutazione finora
- 2.2.3.1 Al 2.2.4 Segunda Unidad ErickDocumento7 pagine2.2.3.1 Al 2.2.4 Segunda Unidad ErickErick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 2 Soluciones SaturadasDocumento5 paginePractica 2 Soluciones SaturadasErick Javier Hernandez PrudencioNessuna valutazione finora
- Practica 1 Reconocimiento de Material de LaboratorioDocumento4 paginePractica 1 Reconocimiento de Material de LaboratorioErick Javier Hernandez PrudencioNessuna valutazione finora
- Clase Pseudomonas AeruginosaDraMGomezDocumento14 pagineClase Pseudomonas AeruginosaDraMGomezErick Javier Hernandez PrudencioNessuna valutazione finora
- Libro de ChicharoDocumento323 pagineLibro de ChicharoErick Javier Hernandez PrudencioNessuna valutazione finora
- Guia Tesis 20113bcdDocumento42 pagineGuia Tesis 20113bcdRoberto Laines ReyesNessuna valutazione finora
- Unidad 3 Ingeniería de BiorreactoresDocumento49 pagineUnidad 3 Ingeniería de BiorreactoresErick Javier Hernandez Prudencio50% (2)
- Efecto Del Contenido de HumedadDocumento9 pagineEfecto Del Contenido de HumedadErick Javier Hernandez PrudencioNessuna valutazione finora
- El Cultivo de La ArvejaDocumento13 pagineEl Cultivo de La ArvejacascarincitoNessuna valutazione finora
- Reg LgpgirDocumento62 pagineReg LgpgiringealdoNessuna valutazione finora
- Caracter I Sticas Virus 03Documento46 pagineCaracter I Sticas Virus 03Laydesker ValvuenaNessuna valutazione finora
- Pag 13Documento23 paginePag 13Erick Javier Hernandez PrudencioNessuna valutazione finora
- Introduccion A La Tecnologia de AlimentosDocumento113 pagineIntroduccion A La Tecnologia de AlimentosErick Javier Hernandez PrudencioNessuna valutazione finora
- Elaboración de Productos CárnicosDocumento8 pagineElaboración de Productos CárnicosJhoner Diaz100% (1)
- Articulo ViscosidadDocumento7 pagineArticulo ViscosidadErick Javier Hernandez PrudencioNessuna valutazione finora
- NOM-130 Alimentos EnvasadosDocumento41 pagineNOM-130 Alimentos EnvasadosArlette GarzaNessuna valutazione finora
- Cancer de MamapdfDocumento136 pagineCancer de MamapdfErick Javier Hernandez PrudencioNessuna valutazione finora
- NOM-130 Alimentos EnvasadosDocumento41 pagineNOM-130 Alimentos EnvasadosArlette GarzaNessuna valutazione finora
- Plan de Contingencia MatpelDocumento31 paginePlan de Contingencia Matpelsilvina leonor gongora oviedoNessuna valutazione finora
- Sintesis N 1 La GeoastronomiaDocumento3 pagineSintesis N 1 La GeoastronomiaAna Luz Chijo MamaniNessuna valutazione finora
- AguarrasDocumento5 pagineAguarrasJulio CarosiniNessuna valutazione finora
- Cadena Transportadora de ElectronesDocumento3 pagineCadena Transportadora de ElectronesRodrigo MoralesNessuna valutazione finora
- 02 Nuclidos Estructura Atomica IIDocumento9 pagine02 Nuclidos Estructura Atomica IILuzmarina Pineda Mendoza100% (3)
- Taller Filtro de MangasDocumento5 pagineTaller Filtro de MangasLaura CastroNessuna valutazione finora
- Los Terremotos Más Trágicos de AméricaDocumento5 pagineLos Terremotos Más Trágicos de AméricaÁngel ArchilaNessuna valutazione finora
- Ficha Tecnica Alcohol 70°Documento4 pagineFicha Tecnica Alcohol 70°Fernando Lazo Talledo100% (1)
- Lab 1Documento11 pagineLab 1Sarela GarridoNessuna valutazione finora
- Reduccionismo y La Unidad de La Ciencia (Grupo 12)Documento12 pagineReduccionismo y La Unidad de La Ciencia (Grupo 12)Christian SoteloNessuna valutazione finora
- Funcion Trabajo y Frecuencia Umbral.Documento9 pagineFuncion Trabajo y Frecuencia Umbral.Susana Nava Andrade0% (1)
- Practica 7Documento12 paginePractica 7Nancy EscobarNessuna valutazione finora
- Ejercicios de Examen 6ºDocumento3 pagineEjercicios de Examen 6ºAlejandro Marrero PeiranNessuna valutazione finora
- Practica Ureasa AdelantoDocumento9 paginePractica Ureasa AdelantoChuyínGeraldoLeónNessuna valutazione finora
- Lab. Péndulo Simple.Documento6 pagineLab. Péndulo Simple.Tatiana LeonelNessuna valutazione finora
- TP1 Estructuras CristalinasDocumento15 pagineTP1 Estructuras Cristalinasbasterman20% (1)
- Brest Od 300Documento19 pagineBrest Od 300Daniel Zuñiga JimenezNessuna valutazione finora
- Teoría Cinética Molecular de Los LíquidosDocumento5 pagineTeoría Cinética Molecular de Los LíquidosMiriam Navarro100% (1)
- Almacenamiento 2Documento31 pagineAlmacenamiento 2ruben dario salas severicheNessuna valutazione finora
- HDS-LB-ERF07-1147 Aprobado-REVELADOR CANTESCODocumento12 pagineHDS-LB-ERF07-1147 Aprobado-REVELADOR CANTESCOALPBGREATNessuna valutazione finora
- Listado de SecuenciasDocumento25 pagineListado de Secuenciasjesus lopezNessuna valutazione finora
- Problemas Propuestos - Clase 09 - Conducción Paredes CompuestasDocumento2 pagineProblemas Propuestos - Clase 09 - Conducción Paredes CompuestasJHOAN FERNANDEZNessuna valutazione finora
- Problemas Masa 1Documento4 pagineProblemas Masa 1Fernando Pinedo MirandaNessuna valutazione finora
- Partes de Una Sección de Tronco de MaderaDocumento4 paginePartes de Una Sección de Tronco de MaderaRegorNessuna valutazione finora
- Solucion Ejercicios Resueltos de Calor de TermodinamicaDocumento5 pagineSolucion Ejercicios Resueltos de Calor de TermodinamicaMaximiliano OlivaresNessuna valutazione finora
- Seminario 2-Estructura AtomicaDocumento5 pagineSeminario 2-Estructura AtomicaAgustin VinceNessuna valutazione finora
- Cielonet7 Net - Los ÉteresDocumento9 pagineCielonet7 Net - Los ÉteresCielonet7 NetNessuna valutazione finora
- TiristorDocumento3 pagineTiristorDaviid SaldañaNessuna valutazione finora
- Reflexión y Reafracción de OndasDocumento17 pagineReflexión y Reafracción de Ondasjose alfredo gonzalez carrilloNessuna valutazione finora
- Control de La Microestructura U4Documento37 pagineControl de La Microestructura U4Noe AvilaNessuna valutazione finora