Documenti di Didattica
Documenti di Professioni
Documenti di Cultura
Reactores
Caricato da
Abraham CastilloTitolo originale
Copyright
Formati disponibili
Condividi questo documento
Condividi o incorpora il documento
Hai trovato utile questo documento?
Questo contenuto è inappropriato?
Segnala questo documentoCopyright:
Formati disponibili
Reactores
Caricato da
Abraham CastilloCopyright:
Formati disponibili
r1= k1CA^2 r2= k2CA2* r3= k3CA CB r4= k4CA CAB En PSSH la rA2* =0 0=r1-r2-r3-r4 0= k1CA^2 - k2CA2* - k3CA
A CB - k4CA CAB CA2*= k1CA^2 + k4CA CAB / k2 + k3 CB rAB = r3-r4 = k3 [ k1CA^2 + k4CA CAB / k2 + k3 CB] - k4CA CAB
r1= k1CCH3CHO r2= k2CCH3* CCH3CHO r3= k3CCHO* CCH3CHO
Abraham Castillo Espinosa 212290055
Pgina 1
r4= k4CCH3* En PSSH la r CH3* =0 0=r1 + r3-r4 0= k1CCH3CHO + k3CCHO* CCH3CHO - k4CCH3* CCH3*= [ CCH3CHO 2k1/k4 ]^1/2 y r CHo3* =0 0=r1 - r3 0= k1CCH3CHO - k3CCHO* CCH3CHO CCHO* = k1/k3
r CH3CHO = - r1 - r2 -r3 = - k1CCH3CHO - k2CCH3* CCH3CHO - k3CCHO* CCH3CHO r CH3CHO = - k1CCH3CHO - k2 [ CCH3CHO 2k1/k4 ]^1/2 CCH3CHO - k3 k1/k3CCH3CHO r CH3CHO = - 2k1CCH3CHO - k2 [ CCH3CHO 2k1/k4 ]^1/2 CCH3CHO
7.2 La hiptesis del estado seudoestacionario (HESE) aplicada a la desintegracin trmica del etano. La descomposicin trmica del etano a etileno, metano, butano e hidrogeno se cree que procede de la siguiente secuencia: Iniciacin: C2H6 2CH3*
Propagacin: CH3* + C2H6 C2H5* H* + C2H6 Terminacin: CH4 + C2H5*
C2H4 + H* C2H5* + H2
Abraham Castillo Espinosa 212290055
Pgina 2
2C2H5*
C4H10
Desarrollo de la ley de velocidad La velocidad de formacin del etileno (reaccin 3) es r3 = k3 [C2H5*] Dada la siguiente secuencia de reaccin: Para los intermediarios activos: CH3* , C2H5* , H* las velocidades netas de reaccin son: [C2H5*]= -r2 - r3 - r4 + r5=0 [H*]= r3- r4 =0 [CH3*]= -2r1 + r2 =0 Sustituyendo las concentraciones en la ecuacin elemental, se obtiene: 2k1[C2H6]-k2[CH3*][C2H6]=0 Resolviendo para la concentracin del radical libre CH3* [CH3*]= 2k1/k2 Luego hacemos -r2 + r5 =0 Sustituyendo las concentraciones en las leyes de velocidad k2 [CH3][C2H6]- k5 [C2H5]^2 =0 resolviendo para [C2H5*], se obtiene [C2H5*]= {k2/k3 [CH3*][C2H6]} ^1/2 = {2k1/k5 [C2H6]}^1/2
Obteniendo asi la velocidad de formacin de etileno rC2H4 = k3 [C2H5*] =k3 (2k1/k5)^1/2 [C2H6]^1/2
A continuacin escribimos la velocidad neta de formacin de H* en trminos de la concentracin. K3[C2H5*] k4[H*][C2H6]=0
Abraham Castillo Espinosa 212290055
Pgina 3
[H*]= k3/k4 (2k1/k5)^1/2 [C2H6]^-1/2 La velocidad de desaparicin del etano es rC2H6 = -k1[C2H6] k2 [CH3*] [C2H6] k4[H*][C2H6] Sustituyendo la concentracin de los radicales libres, la ley de velocidad de desaparicin del etano es rC2H6 = (k1+2k2) (C2H6) + k3 (2k1/k5)^1/2 C2H6^1/2 Para un reactor intermitente de volumen constante, los balances molares combinados y las leyes de velocidad de descomposicin de etano (P1) y formacin de etileno (P5) son dCP1 /dt = - [3k1CP1 + k3(2k1/k5)^1/2 CP1 ^1/2] dCP5/dt = k3(2k1/k5)^1/2 CP1^1/2 A 1000 K las velocidades de reaccin especifica son k1 = 1.5 x 10 -3 s-1 , k2= 2.3 x 106 dm3 /mol.s , k3 = 5.71x 10 4 s-1 , k4= 9.53 x 108 dm3 /mol.s , k5= 3.98 x 109 dm3 /mol.s Para una concentracin de entrada de etano de 0.1 mol/dm3 y una temperatura de 1000 K Prueba de la hiptesis de estado seudoestacionario para la desintegracin del etano. Se cree que la desintegracin trmica del etano ocurre por la secuencia de reaccin dada en el inciso a, las velocidades de reacciones especificas se dan en funcin de la temperatura:
Abraham Castillo Espinosa 212290055
Pgina 4
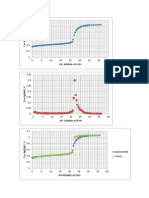
Concentracin del etano
Concentracin del intermediario CH3*
Concentracin del metano
Abraham Castillo Espinosa 212290055
Pgina 5
Concentracin de Butano
Ejemplo 7-3 Evaluacin de los parmetros de Michaelis-Menten Vmax y Km Determine los paramtros de Michaelis-Menten Vmax y Km para la reaccin Urea + Ureasa [Urea.Ureasa] * 2NH3 + CO2 + Ureasa
La velocidad de reaccin se da como una funcin de la concentracin de urea en la siguiente tabla C urea -r urea 0.2 1.08 0.02 0.55 0.01 0.38 0.005 0.2 0.002 0.09
1/-rurea = 1/Vmax + KM /Vmax Curea Una grafica del reciproco de la velocidad de reaccin contra el reciproco de la concentracin de urea debe ser una lnea recta con una interseccin en 1/Vmax y una pendiente Km /Vmax . Este tipo de grafica se conoce como grafica de Lineweaver-Burk . la interseccin es 0.75 de modo que 1/ Vmax = 0.75 m3 s /kmol Datos experimentales y procesados C urea 0.2 0.02 0.01 0.005 0.002 -r urea 1.08 0.55 0.38 0.20 0.09 1/C urea 5.0 50 100 200 500 1/-r urea 0.93 1.82 2.63 5.00 11.11
Abraham Castillo Espinosa 212290055
Pgina 6
Por lo que la velocidad mxima de la reaccin es Vmax= 1.33 kmol /m3 s Del valor de la pendiente, que es de 0.02 s, podemos calcular la constante de Michaelis ,KM KM/ Vmax = pendiente = 0.02s KM= 0.0266 kmol/m3 Grafica de Michaelis-Menten
-r urea
1.2 1 0.8 0.6 0.4 0.2 0 0 0.05 0.1 0.15 0.2 0.25
Grafica de Lineweaver-Burk
1/-r urea
12 10 8 6 4 2 0 0 100 200 300 400 500 600
Sustituyendo KM y Vmax en la ecuacion, tenemos -r = 1,33 Curea / 0.0266 + Curea
Abraham Castillo Espinosa 212290055
Pgina 7
Por lo que la Vmax = 1.205 mol/dm3 KM= 0.0233 mol/dm3
Problema 7.6 NO2 + hv O2 +O + M NO+ O3 NO + O O3 + M NO2 + O2 r1= k1CNO2 r2= k2CO2 CO CM r3= k3CO3 CNO
0= k1CNO2 - k2CO2 CO CM Abraham Castillo Espinosa 212290055 Pgina 8
CO = k1CNO2 /k2CO2 CM 0= k2CO2 CO CM - k3CO3 CNO 0= k2CO2 (k1CNO2 /k2CO2 CM ) CM - k3CO3 CNO CO3= k1CNO2 /k2CNO CO3= K CNO2 /CNO
Mecanismo de reaccion cuando NO y NO2 estan ausentes O2 + hv O2 +O + M hv+ O3 O + O3 2O O3 + M O2 + O 2 2O2
7.7 I2 2I* IH + R* RO2 * ROOH + R* r1= k1CI2 r2= k2CI* CRH r3= k3CR* CO2 r4= k4CRO2* CRH r5= k5CRO2* ^2
I* + RH R* + O2 RH + RO2 * 2RO2*
INACTIVO
Abraham Castillo Espinosa 212290055
Pgina 9
CON ANTIOXIDANTE AH + RO2 * A* + RO2* ROOH + A* INACTIVO r6= k6CRO2* CAH r7= k7CA* CRO2*
CI* = 2 k1CI2 / k2 CRH CR* = 2 k1CI + k4CRO* CRH / k3CO2 CRO2* = [2 k1CI2 / k5 ] ^1/2
A) SIN ANTIOXIDANTE r5= k5CRO2* ^2 rinactivo = k5 ([2 k1CI2 / k5 ] ^1/2)^2 rinactivo = 2 k1CI2 B) CON ANTIOXIDANTE A*= 0= r6- r7 0= k6CRO2* CAH - k7CA* CRO2* CA*= k6CAH / k7
RO2* = r3-r4-r5-r6-r7 0= k3CR* CO2 -k4CRO2* CRH -k5CRO2* ^2 -k6CRO2* CAH - k7CA* CRO2* 2k1CI2 = k5CRO2* ^2 + k6CRO2* CAH + k7CA* CRO2* 2k1CI2 = k5CRO2* ^2 + k6CRO2* CAH + k7(k6CAH / k7)CRO2* 2k1CI2 = k5CRO2* ^2 + 2k6CRO2* CAH CRO2* = -k6CAH /k5 (4 k62CAH2-8 k5 k1CI2 )^1/2 / 2k5 rinactivo = r5+r7 rinactivo = k7CA* CRO2* + k5CRO2* ^2 rinactivo = 4k6 2 CAH2 / k5 - 2k1 CI2 Abraham Castillo Espinosa 212290055 Pgina 10
Potrebbero piacerti anche
- Guia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFDocumento51 pagineGuia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFLiz MartínezNessuna valutazione finora
- Ambientales 2 Parcial ProblemasDocumento16 pagineAmbientales 2 Parcial ProblemasFrank Mucha Lopez75% (4)
- Guia Problemas Resueltos Cinetica ReactoresDocumento51 pagineGuia Problemas Resueltos Cinetica Reactoresbarbaroj83% (23)
- Solucionario Problemas Balance de MateriaDocumento22 pagineSolucionario Problemas Balance de MateriaSamuel LepeNessuna valutazione finora
- Presentación Balance Con ReacciónDocumento19 paginePresentación Balance Con ReacciónGabriel CastroNessuna valutazione finora
- Problemas RQ 10 - 11Documento29 pagineProblemas RQ 10 - 11Carlos Camacho CaeroNessuna valutazione finora
- Balances de MateriaDocumento27 pagineBalances de MateriaClari EsquivelNessuna valutazione finora
- 6ta - Clase - CÁLCULO DE ENERGÍADocumento33 pagine6ta - Clase - CÁLCULO DE ENERGÍAManuel Quispe SotoNessuna valutazione finora
- Problemas de Combustion EDocumento15 pagineProblemas de Combustion EDarkLaw 10Nessuna valutazione finora
- Práctico de Termodinámica y Termoquimica-1 - 199Documento2 paginePráctico de Termodinámica y Termoquimica-1 - 199Giovani Alexis Dorado CuellarNessuna valutazione finora
- Balanceo de Reacciones Químicas SiderurgiaDocumento8 pagineBalanceo de Reacciones Químicas Siderurgiadaskin94Nessuna valutazione finora
- Aq 4Documento5 pagineAq 4Manuel Almansa MontejanoNessuna valutazione finora
- Solucionario de Ciencias AmbientalesDocumento17 pagineSolucionario de Ciencias Ambientalesshinidragon1Nessuna valutazione finora
- Explosivo - Slurrex 110Documento16 pagineExplosivo - Slurrex 110Walter Gomez SalcedoNessuna valutazione finora
- Ejercicios de Análisis y Diseño de ReactoresDocumento21 pagineEjercicios de Análisis y Diseño de ReactoresGianna RivasNessuna valutazione finora
- Unidad 5Documento6 pagineUnidad 5Francisco Javier Placido SalinasNessuna valutazione finora
- TP FluidizacionDocumento9 pagineTP FluidizacionleasturbaNessuna valutazione finora
- Guia de Ejercicios CineticaDocumento26 pagineGuia de Ejercicios CineticaAnabel HernándezNessuna valutazione finora
- Deber II FisicoDocumento37 pagineDeber II FisicoBryan DanielNessuna valutazione finora
- Facultad de Ingenierias Química General Práctica de EstquiometriaDocumento4 pagineFacultad de Ingenierias Química General Práctica de EstquiometriaJamen Luis Quinonez BellidoNessuna valutazione finora
- Facultad de IngenieriasDocumento4 pagineFacultad de IngenieriasJamen Luis Quinonez BellidoNessuna valutazione finora
- Problemario TQ11Documento16 pagineProblemario TQ11FELIXTTTNessuna valutazione finora
- TALLERDocumento25 pagineTALLERValentina Alfonso Parra100% (3)
- Ejercicios PrácticosDocumento6 pagineEjercicios PrácticosyairNessuna valutazione finora
- Solucionario Cap 3 TreybalDocumento19 pagineSolucionario Cap 3 TreybalNicolásFrancoHernández100% (6)
- Análisis de Prestaciones de Un Ciclo de Turbina de GasDocumento3 pagineAnálisis de Prestaciones de Un Ciclo de Turbina de Gasrobert_emsNessuna valutazione finora
- Solucion de Balancede EnergiaDocumento12 pagineSolucion de Balancede EnergiaDavid Vilca MontesNessuna valutazione finora
- Cálculo EnergíaDocumento26 pagineCálculo Energíaabel silvestre100% (2)
- Mecanismos de ReaccionDocumento2 pagineMecanismos de Reaccionalivit martinezNessuna valutazione finora
- Ejercicios PrácticosDocumento5 pagineEjercicios PrácticosRobinsonNessuna valutazione finora
- Proyecto ReactoresDocumento10 pagineProyecto ReactoresKalalita PueblaNessuna valutazione finora
- TRABAJO 2 DE POTENCIA - Prensa 120 Ton PDFDocumento7 pagineTRABAJO 2 DE POTENCIA - Prensa 120 Ton PDFedinsonNessuna valutazione finora
- AnaisDocumento12 pagineAnaisMaria Fernanda Parra Cardenas100% (1)
- Ejercicios de Siderurgia IIDocumento14 pagineEjercicios de Siderurgia IIstivenNessuna valutazione finora
- Resolucion Regularizador 10-08-2022Documento3 pagineResolucion Regularizador 10-08-2022Cami TurdoNessuna valutazione finora
- Balance de Materia Parte 2Documento16 pagineBalance de Materia Parte 2criimesorciiere33% (3)
- TP Fluidizacion 2019 Resuelto 01Documento9 pagineTP Fluidizacion 2019 Resuelto 01francolm88Nessuna valutazione finora
- Serie 2012Documento5 pagineSerie 2012Joaquin Ureña0% (1)
- S13 - s2 - Ejercicios en ClaseDocumento8 pagineS13 - s2 - Ejercicios en ClaseEdith CcahuaNessuna valutazione finora
- Problemas resueltos de Hidráulica de CanalesDa EverandProblemas resueltos de Hidráulica de CanalesValutazione: 4.5 su 5 stelle4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IDa EverandIngeniería química. Soluciones a los problemas del tomo INessuna valutazione finora
- Balance de materia orientado a procesosDa EverandBalance de materia orientado a procesosNessuna valutazione finora
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDa EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSValutazione: 4.5 su 5 stelle4.5/5 (7)
- Guía de cálculo y diseño de conductos para ventilación y climatizaciónDa EverandGuía de cálculo y diseño de conductos para ventilación y climatizaciónValutazione: 5 su 5 stelle5/5 (1)
- Guía práctica de dimensionado de tuberías: Agua, gas, calefacción y energía solarDa EverandGuía práctica de dimensionado de tuberías: Agua, gas, calefacción y energía solarValutazione: 3.5 su 5 stelle3.5/5 (4)
- MF1165_3 - Instalaciones de ventilación-ExtracciónDa EverandMF1165_3 - Instalaciones de ventilación-ExtracciónNessuna valutazione finora
- Guía de laboratorio de mecánica de fluidosDa EverandGuía de laboratorio de mecánica de fluidosNessuna valutazione finora
- Ejercicios prácticos con Electrónica: Proyectos de electrónica con Arduino y Raspberry PiDa EverandEjercicios prácticos con Electrónica: Proyectos de electrónica con Arduino y Raspberry PiValutazione: 5 su 5 stelle5/5 (1)
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSADa EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANessuna valutazione finora
- UF1811 - Manejo de equipos de medida de contaminantes atmosféricosDa EverandUF1811 - Manejo de equipos de medida de contaminantes atmosféricosNessuna valutazione finora
- Dinámica De Fluidos Computacional Para IngenierosDa EverandDinámica De Fluidos Computacional Para IngenierosValutazione: 4 su 5 stelle4/5 (1)
- Manual técnico de refrigerantesDa EverandManual técnico de refrigerantesValutazione: 4 su 5 stelle4/5 (4)
- La Vida No Podrá Ser PerfectaDocumento1 paginaLa Vida No Podrá Ser PerfectaAbraham CastilloNessuna valutazione finora
- Cuaderno de Ejercicios de Ecuaciones DiferencialesDocumento228 pagineCuaderno de Ejercicios de Ecuaciones DiferencialesSebastian reyes beltranNessuna valutazione finora
- Puede Que Te Parezca AburridaDocumento2 paginePuede Que Te Parezca AburridaAbraham CastilloNessuna valutazione finora
- Unidad Quimica OrganicaDocumento27 pagineUnidad Quimica OrganicaNicolas Araya100% (1)
- Etiquetado FrontalDocumento14 pagineEtiquetado FrontalAbraham Castillo100% (1)
- Quimica 1Documento67 pagineQuimica 1Abraham CastilloNessuna valutazione finora
- TareaDocumento2 pagineTareaAbraham CastilloNessuna valutazione finora
- Tarea 2Documento7 pagineTarea 2Abraham CastilloNessuna valutazione finora
- Tarea 3Documento6 pagineTarea 3Abraham CastilloNessuna valutazione finora
- Tarea 4Documento3 pagineTarea 4Abraham CastilloNessuna valutazione finora
- Tarea 5Documento26 pagineTarea 5Abraham CastilloNessuna valutazione finora
- Queso ProcesadoDocumento6 pagineQueso ProcesadoAbraham CastilloNessuna valutazione finora
- ProtocoloDocumento10 pagineProtocoloAbraham CastilloNessuna valutazione finora
- GraficasDocumento1 paginaGraficasAbraham CastilloNessuna valutazione finora
- Problemas de Mec. de FluidosDocumento34 pagineProblemas de Mec. de FluidosHctor AlvaradoNessuna valutazione finora
- Laplace EjerciciosresueltosDocumento19 pagineLaplace EjerciciosresueltosAbraham Castillo100% (2)
- DetergenteDocumento1 paginaDetergenteAbraham CastilloNessuna valutazione finora
- Fluidos ViscososDocumento19 pagineFluidos Viscososdavid2118Nessuna valutazione finora
- Ecuaciones DiferencialesDocumento5 pagineEcuaciones Diferencialesjuliocarlos282Nessuna valutazione finora
- BoyleDocumento4 pagineBoyleAnthonny GutierrezNessuna valutazione finora
- 1examen Avance FisicoquímicaDocumento2 pagine1examen Avance FisicoquímicaDiego CCNessuna valutazione finora
- Hydraulic Power Production Business Plan by SlidesgoDocumento41 pagineHydraulic Power Production Business Plan by Slidesgoalexihto0Nessuna valutazione finora
- Ventajas y Desventajas Del Gas NaturalDocumento3 pagineVentajas y Desventajas Del Gas NaturalSergio Illimani FloresNessuna valutazione finora
- Practica 4 - Gases Liquidos y Solidos LautaroDocumento9 paginePractica 4 - Gases Liquidos y Solidos LautarocelsoNessuna valutazione finora
- Estudio Equilibrio Fases Arce PDocumento12 pagineEstudio Equilibrio Fases Arce PPaul DavilaNessuna valutazione finora
- Compresor Atlas CoopcoDocumento152 pagineCompresor Atlas CoopcoRoman Arango HerreraNessuna valutazione finora
- Sesion 15 - Sifon FinalDocumento28 pagineSesion 15 - Sifon FinalJerson Cuba SanchezNessuna valutazione finora
- Ciclo Real de RefrigeraciónDocumento9 pagineCiclo Real de RefrigeraciónRONALD CHRISTIAN NUÑEZ LIPANessuna valutazione finora
- Informe Cromatografia Gas..en - EsDocumento6 pagineInforme Cromatografia Gas..en - EsOrtiz HelenNessuna valutazione finora
- Ejercicios Fluidos 2Documento26 pagineEjercicios Fluidos 2Eduardo Paredes ramirezNessuna valutazione finora
- Cómo Leer Una Tabla de VaporDocumento6 pagineCómo Leer Una Tabla de VaporEmiliano ZolorzaNessuna valutazione finora
- Practica # 3 FisicoquimicaDocumento8 paginePractica # 3 FisicoquimicaMiguel Potosí MndzNessuna valutazione finora
- QuimicaDocumento4 pagineQuimicaCaren RojasNessuna valutazione finora
- Tema 5 Principio de PascalDocumento3 pagineTema 5 Principio de Pascalnicol LeonNessuna valutazione finora
- 3-Recuperacion de Hidrocarburos LiquidosDocumento5 pagine3-Recuperacion de Hidrocarburos LiquidosBRUNO RENATO GONZALES ZAPATANessuna valutazione finora
- Unidad 01 y 02 (Termodinamica)Documento15 pagineUnidad 01 y 02 (Termodinamica)Geraldine Esthefani Poquioma GuillenNessuna valutazione finora
- 8b JOAQUIN REINA ENERGY WASTE - Vertederos 2015Documento28 pagine8b JOAQUIN REINA ENERGY WASTE - Vertederos 2015Kevin Serrano UréndezNessuna valutazione finora
- PRODGS00032 R0 Lineamientos Generales para Uso de Detector de Gases ALTAIR 4XDocumento5 paginePRODGS00032 R0 Lineamientos Generales para Uso de Detector de Gases ALTAIR 4XLuis Arturo Gómez LunaNessuna valutazione finora
- Tarea 9 Seleccion de CompresoresDocumento10 pagineTarea 9 Seleccion de CompresoresreneNessuna valutazione finora
- Analisis BetDocumento24 pagineAnalisis BetJoselyn CarguaNessuna valutazione finora
- Tecnologias de Obtencion de La Urea Y SYNGASDocumento19 pagineTecnologias de Obtencion de La Urea Y SYNGASRocio Mamani CastroNessuna valutazione finora
- Aplicación de La Ecuación de La EnergíaDocumento25 pagineAplicación de La Ecuación de La EnergíagarevaNessuna valutazione finora
- Biofisicadelarespiracion 150827182944 Lva1 App6891Documento23 pagineBiofisicadelarespiracion 150827182944 Lva1 App6891Gayle AlmonteNessuna valutazione finora
- Calderas y Accesorios GCM - 04Documento50 pagineCalderas y Accesorios GCM - 04javier soria aramayoNessuna valutazione finora
- Factor AcentricoDocumento2 pagineFactor AcentricoCarlos Ccq100% (1)
- Medidores de FlujoDocumento16 pagineMedidores de FlujoAngel GilNessuna valutazione finora
- Ejercicios Mecánica de FluídosDocumento2 pagineEjercicios Mecánica de FluídosWUDIEL HUMBERTO VASQUEZ MARTINEZNessuna valutazione finora
- Clase 16 17-11-2020 PDFDocumento12 pagineClase 16 17-11-2020 PDFAndres Dario Torres ValenciaNessuna valutazione finora
- Hornos A Fuego DirectoDocumento37 pagineHornos A Fuego DirectoEnrique ArceNessuna valutazione finora